鸭源新城疫病毒、鸭瘟病毒和鸭圆环病毒三重PCR 检测方法的建立
2013-08-14许宗丽谢芝勋谢丽基刘加波邓显文谢志勤庞耀珊罗思思
许宗丽,谢芝勋,谢丽基,刘加波,邓显文,谢志勤,庞耀珊,范 晴,罗思思
(1.广西大学动物科学技术学院,广西南宁530004;2.广西壮族自治区兽医研究所,广西畜禽疫苗新技术重点实验室,广西南宁530001)
鸭新城疫(Duck Newcastle disease)是由鸭源新城疫病毒(Duck Newcastle disease virus,DuNDV)引起的以消化道病变为主要特征、具有高度发病率和致死率的烈性传染病。鸭群中流行的新城疫会给养鸭业造成较大损失[1],同时也严重威胁着我国养鸡业的安全。鸭瘟(Duck plague,DP)是由鸭瘟病毒(DPV)引起的一种急性、高度接触性传染病[2]。鸭瘟流行广泛,传播迅速,发病率和病死率都很高,是危害养鸭业较为严重的传染病[3]。鸭新城疫和鸭瘟都有相同的临床症状,精神沉郁,两腿无力,呼吸困难,角弓反张,下痢[4-5],在临床上较难做出诊断。鸭圆环病毒病(Duck circovirus disease)是由鸭圆环病毒(DuCV)引起的一种主要侵害免疫系统的病毒病[6],致免疫功能的下降或免疫抑制的疾病[7]。圆环病毒感染的鸭群机体免疫力受抑制,造成鸭群与其他病原菌或病毒的混合感染情形非常复杂[8-9]。可见,这三种传染病严重地影响着养鸭业的发展。因此,建立同时快速鉴别检测鸭源新城疫病毒、鸭瘟病毒和鸭圆环病毒的方法对这三种传染病的防控有着重要的意义。
目前对于病毒性疫病的诊断一般采用病原分离鉴定和血清学方法,但这些方法存在操作复杂,费时费力敏感性较差等缺点,特别是当鸭群混合感染多种病原时,应用常规方法难以进行早期快速检测和鉴别诊断。多重PCR是在PCR基础上发展的,即在同一反应体系中加入多对引物,从而实现对多个目的基因同时进行扩增的方法,具有可同时检测、鉴别多种病原体的突出特点,在临床多种病原混合感染的鉴别诊断上具有独特的优势和很高的实用价值[10-11]。本研究设计了3对特异引物,建立了鸭源新城疫病毒、鸭瘟病毒和鸭圆环病毒的三重PCR检测方法。
1 材料与方法
1.1 材料
1.1.1 主要试剂 2×Taq PCR Mix购自北京天根生物技术公司;TIANamp血液/细胞/组织 基因DNA提取试剂盒购自天根公司;RNA提取试剂TRIzol LS Reagent购自Invitrogen公司。
1.1.2 病毒株 鸭瘟病毒(DPV)购自中国兽医药品监察所;鸭源新城疫病毒(DuNDV)、鸭圆环病毒(DuCV)、番鸭细小病毒(MDPV)、鸭源小鹅瘟病毒(鸭源GPV)、番鸭呼肠病毒、鸭源H9亚型流感病毒、H5亚型流感病毒核酸、鸭疫里默杆菌、大肠埃希菌(E.coli)、禽多杀性巴氏杆菌等由本实验室保存。
1.2 方法
1.2.1 引物设计和合成 从GenBank中下载鸭源新城疫病毒、鸭瘟病毒和鸭圆环病毒的基因序列,利用Lasergene软件进行多序列比对,在保守区运用软件Primer Premier 5.0设计引物。引物由上海Invitrogen公司合成,引物序列见表1。

表1 研究用PCR引物Table 1 PCR primers used in this study
1.2.2 核酸的提取 参照TIANamp血液/细胞/组织 基因DNA提取试剂盒说书,提取DuCV、MDPV、DPV、鸭源GPV、鸭疫里默杆菌、E.coli、禽多杀性巴氏杆菌的DNA;参照Trizol LS Reagent使用说明书抽提DuNDV、番鸭呼肠病毒、鸭源H9亚型流感病毒的RNA,反转录成cDNA,置-70℃保存备用。
1.2.3 三重PCR反应条件的优化 对反应体系进行优化:对DuNDV引物、DPV引物、DuCV引物、模板等用量进行优化,多次重复试验后确定最佳反应用量。将温度按50℃~65℃依次递增,多次重复试验后确定最佳退火温度。PCR扩增产物用15 g/L琼脂糖凝胶进行电泳鉴定。
1.2.4 三重PCR的特异性试验 利用优化好的三重PCR反应体系,以 DuNDV、DPV、DuCV、MDPV、番鸭呼肠病毒、鸭源GPV、H5亚型流感、鸭源H9亚型流感病毒、鸭疫里默杆菌、E.coli、禽多杀性巴氏杆菌的核酸为待检样品进行检测,检验三重PCR方法的特异性。
1.2.5 三重PCR的灵敏性试验 使用Beckman UV-800紫外分光光度计测定DuNDV、DPV和DuCV的核酸浓度,并按10倍递增稀释。从第二稀释度开始进行三重PCR扩增。同时设阴性对照,评估该三重PCR检测方法的敏感性。
1.2.6 三重PCR的应用 应用建立的三重PCR方法对广西地区送检的180份病料进行检测,评价该方法的临床实用性。
2 结果
2.1 三重PCR反应体系的构建和优化结果
通过对各反应条件的优化,最终确定三重PCR反应体系为25μL:2×TaqPCR Mix 12.5μL,引物DuCV140、DuCV477、 DPV47、 DPV622 (50 μmol/mL)各 0.2 μL,引 物 DuNDV424、DuNDV1247(50μmol/mL)各0.3μL,模板各1 μL,加水至25μL。反应退火温度的优化(图1),确定最佳的反应条件:94℃5min;94℃1min,55℃0.45min,72℃1min,35个循环;72℃10min(图2)。
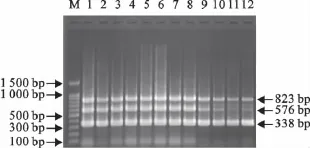
图1 三重PCR退火温度优化结果Fig.1 Optimized results of the annealing temperature for triplex PCR

图2 三重PCR的最佳反应结果Fig.2 The results of optimal reaction for the triplex PCR
2.2 三重PCR特异性试验结果
特异性试验结果显示,从DuNDV扩增出823 bp的特异性条带,DPV扩增出576bp的特异性条带,DuCV扩增出338bp的特异性条带;而其他病原均未扩增出特异条带(图3)。

图3 三重PCR特异性试验Fig.3 The specificity test of the triplex PCR
2.3 三重PCR灵敏性试验结果
用DU 800紫外分光光度计测得DuNDV、DPV、DuCV核酸浓度分别为2.59×107、1.12×107、4.67×106拷贝/μL,并按10倍稀释梯度进行稀释。从第2个稀释梯度开始应用建立的三重PCR方法进行核酸模板检测,结果显示,建立的三重PCR方法对DuNDV、DPV和DuCV的核酸最低检出限分别为2.59×103、1.12×103、4.67×102拷贝/μL(图4)。
2.4 三重PCR的临床应用
对广西地区的180份病料进行检测,结果检出10份鸭圆环病毒,阳性率为5.6%;检出1份鸭源新城疫病毒,阳性率为0.56%;未检出鸭瘟病毒;无混合感染。
3 讨论
多重PCR是一种特殊的PCR技术,具有独特的优势。能在同一PCR反应管内同时检测出多种病原或对有多基因型的病原进行分型[12-13];适用于成组病原体的检测,如肠道致病性细菌和病毒等;经济便捷,多种病原在同一反应管内同时检出,大大缩短检测时间,节约试剂和经费,为临床提供更多诊断信息。但由于一个体系中有多种引物和模板,容易相互干扰而引起非特异扩增。因此,引物特异、各引物浓度适宜、各引物退火条件相近以及合适大小梯度的目的片段是建立多重PCR的关键环节。本研究设计了一套特异性的引物,通过优化反应体系,建立了一个反应管能同时检测鸭源新城疫病毒、鸭瘟病毒和鸭圆环病毒的多重PCR检测方法。
目前,由于DuCV尚没有一个合适的体外培养方法,鸭圆环病毒病的诊断往往借助于分子生物学方法如PCR,荧光定量PCR等[14]。鸭圆环病毒感染导致鸭免疫力下降而容易感染其他病毒。刘少宁等[15]对我国山东省742只樱桃谷鸭(Cherry Valley ducks)中DuCV及混合感染的情况进行了流行病学调查,结果显示,单纯感染DuCV的样品只占被调查样品总数的18.10%,15.19%为DuCV和其他病原的混合感染。张坤等[16]曾报道山东省潍坊市某鸭场暴发鸭瘟与鸭源新城疫病毒的混合感染。鸭瘟和鸭新城疫都是烈性传染病,一旦暴发两者混合感染的疫情,就会给我国养鸭业造成重大损失。本研究建立的PCR方法快速准确,适于鸭圆环病毒、鸭源新城疫病毒与鸭瘟病毒的混合感染检测,为鸭圆环病毒病、鸭瘟和鸭新城疫等重大动物疫病监测提供可靠的技术服务。
用本研究建立的三重PCR方法对广西地区180份病料进行检测,检测出鸭圆环病毒的感染率为5.6%,表明广西地区存在鸭圆环病毒的感染;检出鸭源新城疫病毒的感染率为0.56%;未检出鸭瘟病毒,可能该种病毒在该地区已得到较好的防控,同时也提示需要进行更多的临床样品的检测。
[1] 张 存,叶伟成,刘蔓雯,等.鹅与番鸭溃疡性胃肠炎病原的分离鉴定[J].畜牧与兽医,2002,34(2):27-28.
[2] Sandhu T S,Shawky S A.Duck virus enteritis(duck plague)[C]//Saif Y M,Barnes H J,Glisson J R,et al.Diseases of Poultry.11th ed.Ames:Iowa State University Press,2003:354-363.
[3] 卡尔尼克BW.禽病学[M].10版.高 福.苏敬良,译:北京:中国农业出版社,1999:857-867.
[4] 殷 震,刘景华.动物病毒学[M].北京:北京科学出版社,1997:67-78,1073-1079.
[5] 贾荣泽,张 璇,亓丽红.常见肉鸭病毒性传染病的诊治[J].水禽世界,2007(1):23-24.
[6] 蔡宝祥.圆环病毒与禽鸟免疫抑制[J].中国家禽,2001,23(19):6-9.
[7] Soike D K,Albrecht K,Hattermann C,et al.Novel circovirus inmulard ducks with developmental and feathering disorders[J].Vet Rec,2004,154:792-793.
[8] Chen C,Wang P,Lee M,et al.Development of a polymerase chain reaction procedure for detection and differentiation of duck and goose circovirus[J].Avian Dis,2006,50:92-95.
[9] 柴同杰.山东省樱桃谷鸭群鸭圆环病毒及混合感染的调查[J].中国家禽,2009,31(6):4-7.
[10] Elnifro E,Ashshi A,Cooper R,et al.Multiplex PCR:Optimization and application in diagnostic virology[J].Clin Microbiol Rev,2000,13(4):559.
[11] 谢芝勋,庞耀珊,邓显文,等.多重RT-PCR同时鉴别三种对虾病毒的研究与应用[J].病毒学报,2005,21(5):393-396.
[12] 谢芝勋,谢志勤,庞耀珊,等.应用三重聚合酶链反应同时检测鉴别鸡新城疫、鸡传染性支气管炎病毒、鸡传染性喉气管炎病毒和鸡毒支原体的研究[J].中国预防兽医学报,2000,12(6):443-446.
[13] Xie Z,Pang Y S,Liu J,et al.A multiples RT-PCR for type A influenza virus and di fferentiation of avian H5,H7and H9 hemagglutinin subtypes[J].Mol Cell Probes,2006,20(3-4):245-249.
[14] Fringuelli E,Scott A N J,Beckett A,et al.Diagnosis of duck circovirus infections by conventional and real time polymerase chain reaction tests[J].Avian Pathol,2005,34:495-500.
[15] 刘少宁,张兴晓,陈 智,等.我国自然发病鸭群中鸭圆环病毒的流行病学调查[J].中国兽医学报,2009,29(11):1402-1405.
[16] 张 坤,刁有祥,陈 琳.鸭瘟与鸭副黏病毒混合感染种鸭的诊治[J].中国家禽,2011,33(22):56-57.
