虹鳟(Oncorhynchus mykiss)传染性造血器官坏死病(IHN)抗病力遗传参数估计及其抗病家系筛选
2013-08-09王炳谦姜再胜石存斌白庆利
王炳谦,姜再胜,户 国,石存斌,王 芳,谷 伟,白庆利
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院黑龙江水产研究所,哈尔滨 150070;3.中国水产科学研究院珠江水产研究所,广州 510380)
传染性造血器官坏死病毒(Infectious haemato⁃poietic necrosis virus,IHNV)属于弹状病毒科诺拉弹状病毒属(Novirhabdovirus),病毒粒子形态为弹状,直径80~90 nm,长度为160~180 nm,有囊膜,对热、酸、乙醚不稳定[1-2]。由该病毒引起传染性造血器官坏死病是一种严重养殖鲑科鱼类病毒性疾病,发病急、死亡率高。我国现阶段虹鳟养殖模式大部分是作坊式个体养殖,不注重遗传改良和亲本种质遗传维护,养殖环境比较恶劣,疾病防控意识和能力较差[3]。集约化高密度养殖导致环境胁迫,以及苗种引种管理方式不当,极易出现IHN疫病传播[1]。近年来,辽宁本溪、河北涞源、甘肃永登、永昌等虹鳟主要养殖区域大面积爆发IHN疫病,给当地虹鳟养殖业造成损失加强对鲑鳟鱼传染性造血器官坏死病防控尤为重要。
目前,国内外在疫苗制备和中草药制剂等防控虹鳟IHN疾病暴发方法研究处于早期研制阶段,通过遗传改良手段提高虹鳟对IHN等病毒性疾病抗性成为防此类疾病主要途径。
近年来,欧美及日本等国养殖鲑科鱼类IHN爆发较少,上述地区主要爆发性病毒是传染性胰脏坏死病毒(Infectious pancreatic necrosis virus,IPNV),相应地养殖鲑科鱼类IPN抗病育种相关研究开展较多[3-5]。Okamoto等研究发现,IPN爆发后存活个体作为亲本交配获得后裔IPN抗病力显著提高[6]。在大西洋鲑中,不同品系群体对IPN抗病能力存在很大差异,挪威Aqua Gen公司通过家系选择提高大西洋鲑IPN抗病力,并在商业群体中得到应用[7]。上述研究表明,主要养殖鲑科鱼类IPN抗病力可以通过遗传选择得到提高,进而可以获得有商业价值抗病群体(品系)。虹鳟和大西洋鲑IPN抗病力开展抗病育种取得成功经验,提示我们采用选择育种手段对虹鳟IHN抗病性能进行遗传改良在技术上可行。
本研究采用虹鳟优良品系G2世代作为基础群体,在避免全同胞和半同胞交配基础上,通过随机交配组建60个全同胞家系,对上述家系进行IH⁃NV人工感染试验,估计虹鳟对IHN抗病力方差组分,计算虹鳟IHN抗病力遗传力,并尝试对虹鳟IHN抗病家系进行筛选,以期为虹鳟抗传染性造血器官坏死病新品种选育提供参考依据,为虹鳟抗病种质创新提供必要遗传学材料。
1 材料与方法
1.1 动物
试验用虹鳟来自于中国水产科学研究院黑龙江水产研究所以中国渤海品系(由朝鲜品系与日本品系群体混杂形成品系)、丹麦品系(来自丹麦一个品系)、挪威品系(来自挪威)、道氏品系(道氏优质虹鳟)和加州品系(来自美国加州)等5个地理远缘品系建立为基础群体,利用家系选育结合动物模型BLUP多性状复合育种选育获得虹鳟优良品系[8-10]。本试验使用该品系G2世代性成熟亲鱼在避免全同胞和半同胞交配基础上,随机交配组建60个全同胞家系进行后续分析。将上述虹鳟全同胞家系受精卵平均分为两份,其中一份用于后续IH⁃NV病毒感染试验;另一份放置于专用育种孵化车间经至60 mg·L-1聚维酮碘溶液浸浴消毒后阿特金式孵化器分家系孵化管理,根据试验结果选留抗病性能优良家系备存。每个家系可供攻毒试验上浮稚鱼个体在1 000~1 500尾。另外,随机选择三组共计1 500尾虹鳟稚鱼作为对照组。
1.2 病原体检测确认
1.2.1 病毒分离培养检测
将收集用于攻毒试验毒鱼苗内脏组织匀浆后进行差速离心,取上清,0.22 um过滤除菌,1∶10稀释后接种成致密单层鲤上皮瘤细胞(Epithelioma papulosum cyprini,EPC)株,15℃培养,用倒置显微镜观察细胞表型变化。
1.2.2 RT-PCR及测序鉴定
为进一步确认毒鱼苗出现症状由IHNV感染引起,又进行RT-PCR及测序分析。根据GenBank中已登陆IHNVN蛋白基因设计合成检测引物,共合成3对,其中用于后续测序分析引物为NP3(见表1)。
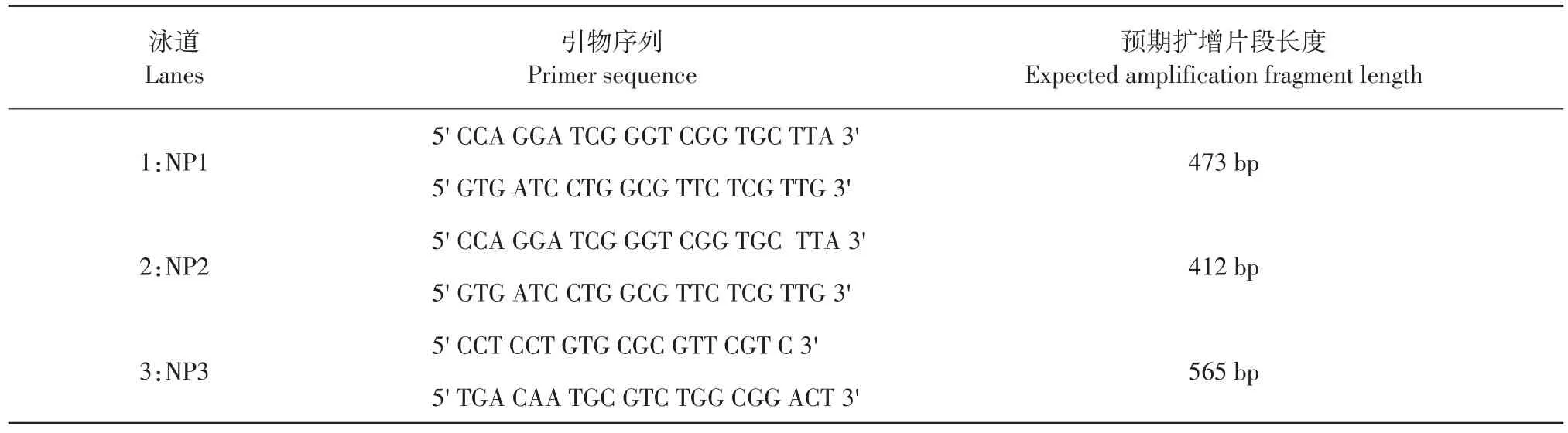
表1 RT-PCR检测所用引物序列Table 1 Primers used in the RT-PCR analyses
取5尾鱼苗肝脏和肾脏等组织混合,Trizol试剂盒方法提取试验鱼内脏总RNA。根据TaKaRa RNA PCR kit Ver 3.0试剂盒说明书,以总RNA为模版,合成cDNA第一链;以cDNA第一链为模版进行G蛋白和N蛋白基因片段PCR扩增。PCR扩增条件均为:94℃预变性4 min,94℃变性30 s,53℃退火30 s,72℃延伸40 s,共30个循环,最后延伸8 min。反应产物用用1.0%琼脂糖凝胶电泳分离、回收、克隆和测序。与GenBank中已登陆IHNVN蛋白进行比对分析,做出判断。
1.3 感染试验
感染试验在高精度可控温封闭水循环养殖系统内进行。该可控温水循环养殖系统规格为60 cm×50 cm×50 cm容积三个隔断培养箱,每个隔断中设置4个同等规格小型网箱。该系统中水质符合饲养虹鳟要求,水中溶解O2>7.0 mg·L-1;pH为6.5~7.5;水中氨氮总含量<5.0 mg·L-1。 配置有紫外消毒系统,温度调控精度可达0.1℃。受精卵在网箱中采用循环水,在水温12±0.2℃温度下,避光孵化至上浮,饲养管理按智利三福(SalmonFood)公司生产VitaCare饲料投喂说明执行。本研究中人工感染试验采用浸浴方式,利用收集带毒苗种处理水体,横向传播病毒。为确认试验平行性与重复性开食之前随机选取3个家系以及随机选取3组常规商业养殖道氏随机群体,每个家系随机均分成3份,任意放置在3个不同水循环养殖系统小网箱中对初浮稚鱼进行感染试验,对照组每组放入随机小网箱中,此时苗种规格为0.15~0.2 g。其他每个受试家系受试个体全部转入前述一个独立小型网箱中,攻毒约15日后大量初浮稚鱼出现疑似IHN发病症状后转入流水养殖条件,饲养在相同规格圆柱形选育缸中,水质符合虹鳟养殖要求,尾排水经无害化处理后排放。上浮90日龄时统计累计死亡率后将所有受试虹鳟苗种销毁。
1.4 IHN抗病力遗传参数估计
本研究中定义IHN抗病力为二元阈性状。阈性状度量一般用有限几个性状相对发生率表示,这种非连续多个表现状态分布具有一个潜在连续分布。在一个两状态阈性状分布情况下,其连续分布上有一取值,称为阈值(Threshold value),它把群体分为两类,各取一种状态。对个体而言,每个个体只能取阈性状中一种状态,而在一个群体中却可以取任一状态。本研究遗传参数估计拟采用贝叶斯动物阈模型处理,该方法基于阈模型和贝叶斯理论,根据贝叶斯理论可知,以第j个全同胞家系中第i个动物个体表型观察值yij为条件联合后验密度为:


在标准阈模型中,个体观察值yij通常被假定由潜连续分布ηij决定,则有

根据本研究实际情况,构建动物模型如下:

其中yij是第j个全同胞家系中第i个动物个体表型观察值;ai是第i个动物个体随机加性效应;tj是第j个家系(由于每个家系都分别处于一个单元中,也是第j个单元)共同环境效应;eij是每个个体随机残差。动物个体效应假定为a~N(0,Aσ2a);全同胞效应假定为t~N(0,Iσ2t);阈模型中随机残差方差固定为1。t效应中除包含共同环境效应,还包含有全同胞效应、母体效应以及非加性效应等无法单独剖分效应。
于是,对于本研究中定义虹鳟IHNV抗性这一性状狭义遗传力(h2)可以这样求解:

公式中σ2a是群体加性方差估计值;σ2t是由每个家系处于单独网箱中所产生方差估计值;σ2e是剩余方差估计值,在阈模型中固定为1。本研究中通过吉布斯抽样(Gibbs sampling)方法求解贝叶斯阈模型方法来获得相关方差组分,进而求得遗传力。统计分析工具为DMU软件包中rjmc组件[11],吉布斯抽样过程共进行10 000次迭代,其中初始阶段1 000次迭代结果被舍弃,其余9 000次迭代结果用于估计随机效应边际分布均值。
1.5 IHN抗病家系筛选
在只考虑单一性状条件下,根据阈性状特点,在每个家系受试个体数量较大时候,不必求解阈性状育种值,只需根据家系感染后存活率这一表型值直接进行选择即可。因此,本研究以上浮90日累积死亡率(90日累积死亡个体数/家系个体总数×100%)和存活率(存活个体数/家系个体总数×100%;也即1-累积死亡率)为考察指标来评价各个家系对IHNV病毒抗病能力,据此排序进行抗病家系筛选。
2 结果与分析
2.1 病原体检测确认
用倒置显微镜检测,接种病鱼上清液EPC细胞,以及再传代EPC细胞,均出现类似细胞病变情况,初步认为用于攻毒试验病料鱼苗感染IHNV病毒。然后提取病料组织匀浆进行RT-PCR及测序鉴定病原体。RT-PCR扩增结果显示,试验鱼扩增IHNV病毒PCR扩增结果都呈阳性且片段大小与预期一致。对引物NP3扩增产物序列进行回收测序,序列结果如下(RT-PCR应设立阴性和阳性对照组)。
CCTCCTGTGCGCGTTCGTCATTGCGGAGACGGTCC CATCGGGGACAGGCACGGTCGCCGAAACTCTGGA AGCCCTGGGCTTCTTGCTGGAGTCTTTGGACACTG GGGCACCACTGGACGCCACTTTCGCAGATCCCAA CAACAAGCTTGCAGAAACGATCGGAAAGGAAAAT GTCCTTGAGGTTGTGACCGGCCTCCTCTTCACCTG CGCTCTACTGACGAAGTATGACGTGGACAAGATG GCCATATACTGCCAAAACAAGCTCGAGCGTCTTGC AACCAGCCAAGGGATTGACGAGTTGGTCAACTTC AACTCCAACAGGGGAGTGCTGGCCAAGATCGGGG CGGTACTTAGACCTGGACAGAAGCTCACCAAGGC TATTTATGGGATCATTCTCATCAACCTGTCTGACC CAGCCACCGCCGCTAGAGCCAAGGCACTGTGCGC CATGAGACTGAGCGGGACAGGGATGACAATGGTG GGACTGTTCAACCAAGCCGCAAAGAACCTGGGCG CCCTTCCAGCAGACCTTCTAGAAGATCTGTGCATG AAGTCAGTGGTGGAGTCCGCCAGACGCATTGTCA(下划线标记部分是引物序列)。
BLAST比对结果显示,该序列与传染性造血器官坏死病病毒zyx N蛋白基因[Infectious hemato⁃poietic necrosis virus strain zyx nucleoprotein(N)gene(HM099906)]一致性(identity)最高,达99%;与其他已登录传染性造血器官坏死病病毒N蛋白基因具有较高一致性,在94%以上。根据病毒分离结果和PCR检测结果,可确定虹鳟鱼苗确实携带有传染性造血器官坏死病病毒(IHNV)。
2.2 试验重复性与平行性
3组对照道氏虹鳟死亡率介于90%~100%,证实常规商业养殖群体对IHNV抗性较低,由于该对照组为常规商业养殖群体,没有系谱记录信息,下一步遗传分析并不涉及对照组数据。3组家系每个家系随机在3个不同小网箱感染试验测试结果显示本研究中感染试验有很好平行性和重复性,具体结果见表2。

表2 3个重复家系存活率每个家系3次平行试验结果Table 2 Survival rate in three replicated families each family with three replicates (%)
2.3 虹鳟IHNV抗性遗传参数估计
表3中计算虹鳟IHN抗病力各个可以剖分方差组分估计值和标准误差,据此根据公式(5)可以计算求得该性状狭义遗传力约为0.34。

表3 虹鳟IHNV抗性方差组分剖分Table 3 Variance components of resistance to IHN in rainbow trout
2.4 抗病家系筛选
本研究计算所有60个全同胞家系IHNV感染至上浮90日期间累积死亡率和存活率。结果显示各家系累计存活率变化范围在0%~90.1%之间,有多达50个家系上浮90日累计死亡率超过90%,即存活率小于10%,存活率在20~50%家系有2个,存活率超过50%家系有8个,其中有1个家系(编号为K23)存活率超过90%(见图1)。结果表明,不同家系IHNV感染后存活率之间确实存在着较大遗传变异,存在着非常大遗传选择潜力。

图1 IHNV感染后存活率超过10%10个虹鳟家系Fig.1 The survival rate of the 10 rainbow trout families greater than 10%after IHNV infection
3 讨论与结论
本研究中定义IHN抗病力性状,类似于人类疾病,是一个非连续二元变量,只有疾病受累和非受累两个状态,在本研究中表征生存或死亡,其分布具有一个潜在连续分布性状,这个潜在连续性状通常被定义为疾病易感性性状(liability trait)[12]。对于疾病易感性遗传分析可以采用如下遗传模型,如测试期间生存模型(Test period survival),测定日生存模型(Test-day survival)以及测试期间累计死亡数据归并模型(Time until death taking censoring into account)等;相应地可以采用广义线性模型、阈模型、Cox&Weibull比例失效率模型等统计模型求解[13-15]。本研究采用Ødegård等提出贝叶斯动物阈模型,该模型对遗传参数估计数值较为精确,适合于本研究中IHN抗病力遗传分析[16]。
免疫学研究结果显示,鲑科鱼类免疫系统与其他鱼类差异不大,感染病毒后病鱼恢复期抗原可使接种鱼类获得部分或全部免疫保护作用,对病毒免疫持续时间可达一年以上。这意味鲑科鱼类感染病毒后可获得有效抗体,亲本有可能通过配子将抗体直接传递给子代,即对病毒性疾病抵抗力极可能是可遗传[17]。遗传学研究也获得类似结果,Mclntyre和Amend研究红大马哈(Onchoryn⁃chus nerka)对IHN抗病力遗传力,对45个全同胞家系后代进行三次独立试验,结果表明,红大马哈孵化后30、60、90日IHN抗性遗传力分别为0.31,0.27和0.38[18]。Yamamoto等对虹鳟IHN抗病力遗传力进行估计,虹鳟对高浓度IHNV病毒抗性父系遗传力为0.51,母系遗传力为0.66[19]。本研究中虹鳟IHN抗病力遗传力约为0.34,低于Yamamo⁃to等获得结果。产生这个差异原因是多方面,首先是本研究采用攻毒方法没有对病毒在水体中浓度进行定量,不能严格与Yamamoto等[19]结果比较;另外,本研究采用贝叶斯阈模型求解相关遗传参数,而Yamamoto等采用统计模型为传统同胞估计,其中还有很多方差组分没有得到很好剖分,同胞估计方法获得遗传力通常要高于该性状遗传力实际值[19]。本研究和上述其他研究中关于IHN抗病力遗传参数估计结果都显示,鲑鱼IHN抗病力遗传力具有中等或中等以上遗传力,即虹鳟对IHN抵抗力性状是可以稳定遗传并可以通过选择育种手段获得改良。
研究表明不同遗传模型分析获得阈性状遗传参数尽管数值有所不同,但是所有模型求解育种值都与家系累计存活率排序存在高度秩相关[13-15]。虹鳟IHN抗病力育种值与家系存活率排序也是高度秩相关。因此,本研究在获得虹鳟IHN抗病力遗传力基础上,未计算该性状育种值,只是直接进行基于表型家系选择。本研究中采用试验群体在农业部冷水性鱼类遗传育种中心处于规范健康养殖环境中,之前从未接触过IHNV病毒,在IH⁃NV感染后,大部分家系存活率都小于10%。但是在这种情况下,本研究仍然发现一些高存活率家系,有K23、K36等两个家系存活率分别达到90.1%和79.9%。根据抗病性状特点,死亡个体不能参与繁殖后代,并不能将其遗传性能真实地遗传到下一世代群体;而同一全同胞家系内存活个体由于父母本都相同,表型值也相同,所以在育种值上表现为同一家系内所有存活个体抗病育种值在数值相等。这个性质使这类性状易纳入到多性状复合育种技术育种指数中,中国水产科学研究院黄海水产研究所在中国对虾、牙鲆、半滑舌鳎等重要海水养殖对象已经开展抗病与生长性状多性状复合育种研究,并取得良好选育效果[20-22]。本研究也考虑将这一性状纳入到虹鳟良种选育整体育种规划中。
已有研究结果表明,IHNV致病力与病原发病季节等时间因素关系不大,但是与病毒采集地点存在密切相关[1]。本研究未采用标准毒株进行感染试验,而是收集当年发病地区病原进行攻毒试验。是因为期望在相对较短时间周期内获得能够抵抗目前正对国内虹鳟养殖业造成危害IHNV株型种质材料。另外,通过碱性磷酸酶免疫组织化学法研究结果表明,IHNV感染一般有两个途径:一是由鳃进入循环系统;二是由口进入消化道[1]。IH⁃NV可以通过水体进入虹鳟循环系统,而一旦进入循环系统,就可扩散至全身。由于目前国内虹鳟养殖过程中从苗种到商品鱼各个规格虹鳟大部分都采用全价配合颗粒饲料,在包装开封之前几乎不存在被病毒污染可能性。据此本研究推测国内养殖环境中IHNV感染途径主要是病毒通过水体进入鱼体循环系统继而感染全身。因此,本研究中采用浸浴方法进行感染试验,以期可以最大限度地模拟在中国养殖环境下虹鳟感染IHNV病毒主要途径。
限于试验设施、试验条件及试验操作方便程度等因素,本研究中对攻毒试验平行性和重复性进行最小可接受3×3试验设计,即采用任意3个家系分别进行3次重复试验,试验结果显示本试验具有良好重复性和平行性。由于这个重复和平行试验测试只是对本研究中60个家系中很少一部分样本进行测试,并不能完全代表整个试验平行性和重复性水平,待试验设施和试验条件完备后,需要进一步扩大重复试验和平行试验规模,并进行多点测试,以期获得更为可靠和稳定结果。
本研究开展虹鳟传染性造血器官坏死病(IHN)抗病力遗传参数估计并初步进行IHN抗病家系筛选工作,获得8个存活率超过50%抗病性能优良家系,其中有1个家系(编号为K23)存活率超过90%,是极具潜力开展虹鳟抗IHN疾病育种遗传材料,从免疫生理、免疫遗传及分子遗传等方面开展进一步深入研究。本研究结果对虹鳟抗传染性造血器官坏死病新品种选育及抗病虹鳟生产推广制种繁育技术体系建立具有参考价值。
[1]Wolf K.Infectious hematopoietic necrosis[M]//Fish Viruses and Fish Viral Diseases].New York∶Cornell University Press,Ithaca,1988∶83-114.
[2]刘荭,范万红,史秀杰,等.国内养殖鱼类和进境鱼卵中传染性造血器官坏死病毒(IHNV)检测及基因分析[J].华中农业大学学报,2006,25(5)∶544-549.
[3]Okamoto N,Matsumoto T,Kato N,et al.Difference in susceptibil⁃ity to IPN virus among rainbow trout populations from three hatch⁃eries in Japan[J].Nippon Suisan Gakkaishi,1987,53∶121-1124.
[4]Moen T,Baranski M,Sonesson A K,et al.Confirmation and fine mapping of a major QTL for resistance to infectious pancreatic ne⁃crosis inAtlantic salmon(Salmo salar)∶Population-level associa⁃tions between markers and trait[J].BMC Genomics,2009(10)∶368.
[5]Wetten M,Kjøglum S,Fjalestad T K,et al.Genetic variation in re⁃sistance to infectious pancreatic necrosis in rainbow trout(On⁃corhynchus mykiss)after a challenge test[J].Aquaculture Re⁃search,2011,42,1745-1751.
[6]Okamoto N,Tanaka M,Fukuda H,et al.A selected strain(RT-101)of rainbow trout,Salmo gairdneriRichardson,highly sensi⁃tive to IPN virus[J].Bulletin of the European Association of Fish Pathologists,1987(7)∶2-4.
[7]Storset A,Strand C,Wetten M,et al.Response to selection for re⁃sistance against infectiouspancreatic necrosis in Atlantic salmon(Salmo salar,L.)[J].Aquaculture,2007,272∶62-68.
[8]王炳谦,谷伟,高会江,等.利用配合力和微卫星标记预测虹鳟品系间杂交优势[J].中国水产科学,2009,16(1)∶1-8.
[9]王炳谦,刘宗岳,高会江,等.应用重复力模型估计虹鳟生长性状遗传力和育种值[J].水产学报,2009,33(2)∶177-182.
[10]户国,谷伟,王鹏,等.电子标记辅助虹鳟家系建立及其快速生长家系筛选[J].中国水产科学,2012,19(1)∶77-83.
[11]Madsen P,Jensen J.A User's Guide to DMU.Version 6,Release 4.7[C].Faculty of Agricultural Science,Department of Genetics and Biotechnology.New Nork∶Aarhus University of Aarhus,2008.
[12]王改芳.概述阈性状遗传参数估计[J].动物科学与动物医学,2004,21(11)∶27-28.
[13]Gitterlet,Ødegård J,Gjerde B,et al.Genetic parameters and ac⁃curacy of selection for resistance to White Spot SyndromeVirus(WSSV)in Penaeus(Litopenaeus)vannamei using di!erent statisti⁃cal models[J].Aquaculture,2006,251,210-218.
[14]Ødegård J,Olesen I,Gjerde B,et al.Evaluation of statistical mod⁃els for genetic analysis of challenge test data on furunculosis resis⁃tance inAtlantic salmon(Salmo salar)∶Prediction of fileld survival[J].Aquaculture,2006,259∶116-123.
[15]Kettunen A,Serenius T,Fjalestad K T.Three statistical methods for genetic analysis of disease resistance against vibriosis in At⁃lantic cod(GadusmorhuaL)[J].Journal of Animal Science.2007,85∶305-313.
[16]Ødegård J,Meuwissen T H E,Heringstad B,et al.A simple algo⁃rithm to estimate genetic variance in an animal threshold model using Bayesian inference[J].Genetics Selection Evolution,2010,42∶29.
[17]Ramstad A,Midtlyng P.Strong genetic influence on IPN vaccina⁃tion-and challenge trials in Atlantic salmon,Salmo salarL[J].Journal of Fish Diseases,2008,31∶567-578.
[18]McIntyre J D,Amend D F.Heritability of tolerance for infectious hematopoietic necrosis in Sockeye salmon(Oncorhynchus nerka)[J].Transactions of the American Fisheries Society,1978,107∶305-308.
[19]Yamamoto S,Sanjyo I,Sato R,et al.Estimation of the heritability for resistance to infectious hematopoietic necrosis in rainbow trout[J].Nippon Suisan Gakkaishi,1991,57∶1519-1522.
[20]张天时,孔杰,李素红,等.中国对虾(Fenneropenaeus ghinensis)自然感染与人工感染WSSV抗病力比较[J].海洋与湖沼,2010,41(5)∶763-768.
[21]陈松林,田永胜,徐田军,等.牙鲆抗病群体和家系建立及其生长和抗病性能初步测定[J].水产学报,2008,32(5)∶665-673.
[22]陈松林,杜民,杨景峰,等.半滑舌鳎家系建立及其生长和抗病性能测定[J].水产学报,2010,34(5)∶1769-1794.
