高赖氨酸蛋白基因Cflr在枯草芽孢杆菌中表达
2013-08-09武彩霞高学军李庆章骆超超毕微微史琳琳
武彩霞,高学军,李庆章,骆超超,毕微微,史琳琳,张 莉
(1.河北北方学院生命科学研究中心,河北 张家口 075000;2.东北农业大学乳品科学教育部重点实验室,哈尔滨 150030)
益生菌发酵饲料集益生菌功效与优质饲料优点,在畜禽生产中具有广阔应用前景[1]。枯草芽孢杆菌作为发酵饲料益生菌之一,已广泛用于生产,具有增进畜禽生长性能和较强抗性等优点,在饲料制粒、储存及在胃肠道中作用稳定并保持较高活性[2]。赖氨酸是人类和动物营养所必需限制性氨基酸,在动物体内会影响其他氨基酸利用率。利用基因工程方法已经成功地将富含赖氨酸基因[3]和富含蛋氨酸基因[4]分别单独转入枯草芽孢杆菌中,并通过发酵枯草芽孢杆菌提高发酵饲料中赖氨酸和蛋氨酸含量,本文旨在研究将另外一种高赖氨酸基因(cflr)转入枯草芽孢杆菌中,以提高枯草芽孢杆菌中赖氨酸含量,并提高发酵饲料中赖氨酸含量。
1 材料与方法
1.1 材料
1.1.1 原料
辣椒花药(采自东北农业大学香坊实验实习基地);野生型枯草芽孢杆菌168(B.subtilis168)(ATCC27370)为本实验室保存;E.coliTOP10和pMD18-T载体,购自大连宝生物科技有限公司;枯草芽胞杆菌表达载体pHT43购自Axygen公司。
1.1.2 药品
Trizol试剂购自Invitrogen公司;PrimeScript RT-PCR Kit、SYBR®Premix Ex Taq™ Ⅱ(Perfect Real Time)、ExTaq酶、T4DNA连接酶、DNA Marker、限制性内切酶以及蛋白Marker,购自大连宝生物科技有限公司;氨苄青霉素、氯霉素、异丙基硫代-β-D-半乳糖苷(IPTG)购自上海生工生物工程公司;L-赖氨酸标准品和1-氯-2,4-二硝基苯(CDNB)购自SIGMA公司;琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒购自Axygen公司;EA⁃SYspin细菌RNA快速提取试剂盒购自北京艾德莱生物科技公司;引物由北京英俊公司合成;其他试剂均为进口或国产分析纯。
1.2 方法
1.2.1 辣椒花药总RNA提取
采用Trizol法提取总RNA,cDNA合成采用试剂盒方法(见宝生物PrimeScript RT-PCR Kit说明书)。
1.2.2 高赖氨酸基因CflrPCR扩增
根据文献[5]和NCBI上报道CflrcDNA全序列(基因登录号:EU367999),设计Cflr引物,分别在上游引物和下游引物5端添加XbaⅠ和SmaⅠ限制性内切酶酶切位点(下划线表示)。
上游引物为:5'GCTCTAGAAAAAGATGGGTT GTGGGGAAT 3'(XbaⅠ)
下游引物为:5'TCCCCCGGGTAAACTAATA⁃AATAGCCCTCTTCCC 3'(SmaⅠ)
以辣椒花药cDNA为模板,进行CflrPCR扩增,反应条件为:94℃预变性1 min,94℃变性30 s,55℃退火30 s,72℃延伸3 min,30个循环;72℃总延伸10 min;4℃保温。取5 μL PCR反应产物进行1%琼脂糖凝胶电泳。按Axygen凝胶回收试剂盒说明操作,对PCR产物进行回收纯化。
1.2.3Cflr基因克隆和序列测定
将Cflr基因PCR扩增产物与pMD18-T载体进行连接,将其转化于大肠杆菌TOP10感受态中,经氨苄筛选后,挑取单菌落培养并提取质粒,通过质粒PCR和双酶切鉴定,筛选出阳性克隆子,然后将阳性克隆子进行核酸序列测定(由北京英俊公司完成),测序结束后,用生物信息学软件将所得测序序列和NCBI发布序列进行比对分析。
1.2.4 枯草芽胞杆菌中重组表达质粒pHT43/Cflr构建以及转化
用XbaⅠ和SmaⅠ双酶切Cflr基因PCR扩增片段并进行胶回收,然后用T4连接酶与同样双酶切后胶回收pHT43连接,构建成重组质粒pHT43/Cflr。通过化学转化法将重组质粒转入Bacillus sub⁃tilis168中[6]。LB培养基中培养,氯霉素筛选。
1.2.5 枯草芽孢杆菌中含有重组质粒鉴定
挑取单菌落于5 mL LB(含氯霉素)培养基中培养,提取质粒[7],用XbaⅠ和SmaⅠ双酶切鉴定,筛选阳性克隆子。
1.2.6 枯草芽孢杆菌中重组质粒pHT43/Cflr在mRNA水平表达
将含有重组表达质粒枯草芽孢杆菌在含有氯霉素LB培养基中培养至OD值为0.5~1.0时,加入1.0 mmol·L-1IPTG,取诱导0、2、12和24 h后菌体,用EASYspin细菌RNA快速提取试剂盒提取细菌总RNA,用于RT-PCR。
使用Primer Premier 5.0软件设计引物,采用SYBR染料法检测不同诱导时间后Cflr基因在mRNA水平表达情况,以B.subtilis16816S rRNA为内参,检测Cflr基因表达情况。反转录和荧光定量PCR程序参照说明书进行。引物设计为:16S rRNA F:GCGTGAGTGATGAAGGTTT,16S rRNA R:GCCGTGGCTTTCTGGTTA;CflrF:GAAAGAA ATGGTGGGAC,CflrR:CTACAGCAGCAACAGC。
1.2.7 枯草芽孢杆菌中重组质粒pHT43/Cflr在蛋白水平表达
将含有重组表达质粒枯草芽孢杆菌在含有氯霉素LB培养基中培养至OD值为0.5~1.0时,加入1.0 mmol·L-1IPTG,诱导24 h后,制取蛋白样,然后进行SDS-PAGE电泳,其浓缩胶浓度为5%,电泳电压为80 V,分离胶浓度为12%,电压为120 V。电泳结束后,用固定液固定蛋白胶45 min,用考马斯亮蓝进行染色,经脱色液脱色后观察表达后产物条带。
1.2.8 HPLC检测菌液中lys含量
测定菌液中表达蛋白所含lys含量,取经过IPTG诱导24 h野生菌和重组菌菌液8 mL,按照GB/T 18246-2000[8]中酸水解法进行水解后,定容至50 mL。吸取1 mL滤液,分别置于50 mL离心管中,再分别吸取Na2CO3-NaHCO3pH 9.0缓冲液2 mL,混匀后,加入CDNB溶液各1 mL,混匀,经0.22 μm滤膜过滤后,取10 μL直接上样测定其中lys含量,试验重复5次,取平均值。
1.2.9 数据处理
使用SPSS 17.0统计学软件进行数据统计和处理,P<0.05和P<0.01表示差异显著和极显著。
2 结果与分析
2.1 Cflr基因序列获得
扩增出Cflr片段如图1所示,在720 bp处出现条带,与预期大小相符,测序片段全长669 bp,将测序结果与NCBI上报道CflrcDNA全序列基因(基因登录号:EU367999)进行同源性比对分析,结果同源性为99%。测序片段全长669 bp与NCBI报道序列比对,同源性达到99%。

图1 Cflr基因PCR产物电泳图谱Fig.1 PCR products ofCflrgene
2.2 枯草芽胞杆菌中重组表达载体构建和鉴定
重组质粒pHT43/Cflr,如图2所示,片段长为8 777 bp。将重组质粒转化到枯草芽胞杆菌中,提取阳性克隆子,进行双酶切鉴定,见图3,在720 bp处出现目条带,条带大小符合预测值,证明重组表达载体质粒已经成功转入到枯草芽胞杆菌中。pHT43载体片段长度为8 057 bp。

图2 枯草芽胞杆菌重组表达载体图谱Fig.2 Map of recombinant expression vector

图3 重组质粒pHT43/Cflr鉴定图谱Fig.3 Identification of the recombinant plasmid pHT43/Cflr
2.3 RT-PCR结果
RT-PCR结果显示,在IPTG诱导以后,Cflr基因在mRNA水平表达,见图4。由图4可知,Cflr基因在2、12 h时,mRNA水平与与未诱导前相比均表现为显著差异,24 h时,可检测到Cflr基因mRNA,但水平与未诱导前相比并未表现为显著差异;同时也证明Cflr基因已成功转入枯草芽孢杆菌中并表达。
2.4 SDS-PAGE结果
将正常枯草芽孢杆菌、含空载体pHT43重组菌和含重组质粒重组菌经IPTG诱导培养24 h后终止,离心取菌体进行SDS-PAGE,如图5所示,与对照组相比,在试验组中出现明显目的蛋白条带(目的蛋白大小是24 ku),表明cflr基因在枯草芽孢杆菌中已成功表达。
2.5 HPLC测菌发酵液中Lys含量
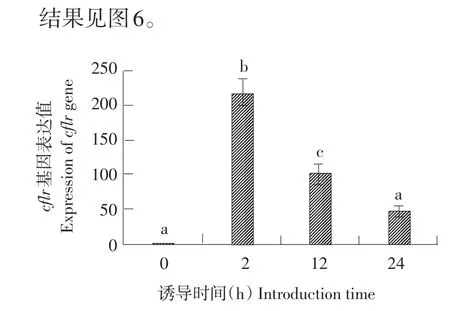
图4 cflr基因表达结果Fig.4 Expression of cflr gene

图5 蛋白电泳检验枯草芽胞杆菌中目蛋白Fig.5 SDS-PAGE detection of expression cflr in Bacillus subtilis

图6 HPLC测定菌发酵液中Lys含量Fig.6 Contents of lysine detected by HPLC in fermentation broth of bacterium
根据标准品各个浓度峰面积制作标准曲线如图6a,给出回归方程;Lys标准品衍生液HPLC结果如图6b。Bacillus subtilisHPLC检测结果和重组菌HPLC检测结果见图6c、6d。野生菌Lys含量是17.32 μg·mL-1,重组菌 Lys含量是 20.1 μg·mL-1,结果重组菌发酵液Lys含量比野生菌提高16.05%(n=5)。目峰出峰时间约在14.224 min。
3 讨论与结论
本研究所用Cflr是高赖氨酸蛋白基因,该基因所编码蛋白质中赖氨酸含量为21.2%,是目前已知赖氨酸含量最高天然蛋白[5]。现已报道天然存在高赖氨酸蛋白基因还有sb401、SBgLR、st901、tsb和wblrp,但这些基因所表达蛋白质中赖氨酸含量都低于Cflr。为提高益生菌枯草芽孢杆菌作为饲料添加剂中赖氨酸含量,本研究从辣椒花药中克隆Cflr基因,并利用基因工程手段将Cflr转入枯草芽孢杆菌中,从而使枯草芽孢杆菌发酵液中赖氨酸含量提高16.05%。李学琳等从四棱豆中克隆wblrp基因,并将其转入枯草芽孢杆菌中,使枯草芽孢杆菌发酵液中赖氨酸含量提高9.85%[3]。与之相比,本研究更进一步。目前关于Cflr研究不多,孙晓波等构建高赖氨酸蛋白基因(Cflr)植物表达载体pAHC25-Cflr,并将其转入植物小麦中[9]。而本研究将Cflr转入微生物枯草芽孢杆菌中属首例。
枯草芽孢杆菌遗传背景清楚[10],蛋白分泌机制健全、生长迅速、培养简便、不分泌内毒素,具有较好生物安全性,是美国食品药物管理局(FDA)和中国农业部批准使用安全菌株;可直接将表达产物分泌到培养基中,产物便于提取和纯化,是表达外源基因良好受体菌。本试验采用野生型宿主菌B.subtilis168是枯草芽孢杆菌表达系统中最为广泛应用的宿主菌,在本试验中外源基因表达成功(在24 ku处出现目条带)。益生菌枯草芽孢杆菌作为外源蛋白宿主菌已成功表达多种类型基因[11],Liu等实现芽孢杆菌akibiⅠ-1内切葡聚糖酶在枯草芽孢杆菌168中过量表达[12];Abbasi-Hosseini等克隆克劳氏芽孢杆菌中碱性丝氨酸蛋白基因,并在枯草芽孢杆菌WB600中成功表达,重组枯草芽孢杆菌比原始菌株产碱性蛋白酶活性增强3倍[13];李爽等构建pHT43-VP2重组表达载体,并转化入枯草芽孢杆菌WB600中诱导表达。结果表明在69 ku处存在目蛋白[14];郭菁等将构建重组质粒通过化学转化法转入枯草芽孢杆菌蛋白酶缺失菌株WB600中,转化子pWT22-BLG4/WB600在IPTG(1.0 mmol·L-1)诱导下,发酵液上清中蛋白酶活达到620 U·mL-1,高于出发菌株G4BLG4酶活(240 U·mL-1)[15];外源基因转入枯草芽孢杆菌中例子还有很多,本研究在枯草芽孢杆菌中表达植物来源高赖氨酸蛋白基因Cflr,可为今后开展高赖氨酸蛋白基因在益生菌中高效表达和应用提供理论基础。
[1]李永凯,毛胜勇,朱伟云,等.益生菌发酵饲料研究及应用现状[J].畜牧与兽医,2009,41(3)∶90-93.
[2]刁其玉,屠焰,齐广海.益生菌(素)研究及其在饲料中应用[J].饲料工业,2002(10)∶105-110.
[3]Li X L,Gao X J,Qiao B,et al.Expression of a lysine-rich gene inBacillus subtilis168[J].Journal of Northeast Agricultural Universi⁃ty,2011(4)∶68-73.
[4]娄丽,高学军,敖金霞,等.富含蛋氨酸玉米醇溶蛋白在枯草芽胞杆菌中表达[J].微生物学杂志,2011,31(5)∶31-34.
[5]孙晓波,房瑞,余桂红,等.辣椒高赖氨酸蛋白基因Cflr全长cDNA克隆及其组织表达特征[J].园艺学报,2008,35(9)∶1310-1316.
[6]李瑞芳,薛雯雯,黄亮,等.枯草芽孢杆菌感受态细胞制备及质粒转化方法研究[J].生物技术通报,2011(5)∶227-230.
[7]吕正兵,张方,夏颖,等.一种适合芽孢杆菌质粒DNA提取改良碱裂解法[J],安徽师范大学学报,2002,75(3)∶630~634.
[8]中华人民共和国国家质量监督检验检疫总局、中国国家标准化管理委员会.中华人民共和国国家标准饲料中氨基酸测定[S].GB/T18246-2000∶280-285.
[9]孙晓波,房瑞,余桂红,等.转高赖氨酸含量基因(Cflr)小麦植株获得及种子中蛋白质和赖氨酸含量分析[J].江苏农业学报,2010,26(6)∶1162-1169.
[10]Wong S L.Advances in the use ofBacillus subtilisfor the expres⁃sion and secretion of heterologous proteins[J].Current Opinion in Biotechnology,1995,6(5)∶517-522.
[11]Farhat-Khemakhem A,Ben Farhat M,Boukhris,et al.Heterolo⁃gous expression and optimization using experimental designs al⁃lowed highly efficient production of the PHY US417 phytase in Bacillus subtilis 168[J].AMB Express,2012,2(1)∶10-14.
[12]Liu S L,Du K.Enhanced expression of an endoglucanase inBacil⁃lus subtilisby using the sucrose-inducible sacB promoter and im⁃proved properties of the recombinant enzyme[J].Protein Expres⁃sion and Purification,2012,83∶164-168.
[13]Seyed Mohsen Abbasi-Hosseini,Fereshten Eftekhar,et al.Clon⁃ing and enhanced expression of an extrcellular alkalin protease from a soil isolate ofBacillus clausii in Bacillus subtilis[J].Iranian Journal of Biotechnology,2011,9(4)∶275-280.
[14]李爽,黄文斌,黄爱玲,等.犬细小病毒VP2基因在枯草芽孢杆菌中表达及鉴定[J].生物技术通报,2011,(12)∶171-174.
[15]Guo J,Tian B Y,Cai W L,et al.Over-expression of an alkaline protease gene BLG4 from Brevibacillus laterosporu G4 inBacillus subtilisWB600[J].Journal of Fujian Agriculture and Forestry Uni⁃versity∶Natural Science Edition,2011,40(2)∶165-171.
