4-硫-5-碘尿苷的合成及其与人血清白蛋白间的相互作用
2013-08-08郑学仿曹洪玉张晓辉
王 健,郑学仿,曹洪玉,张晓辉*
(1.大连大学环境与化学工程学院,辽宁大连 116622; 2.辽宁省生物有机化学重点实验室,辽宁大连 116622)
1 引 言
1965年,Lipsett首先从大肠杆菌分离出4-thiouridylic acid,含硫及硫代类似物的DNA组成部分[如硫碱基(Thio-base) 和硫代核苷(thio-nuceloside)][1]。硫代DNA及硫代类似物拥有独特的性质,尤其是含硫碱基对紫外线的高灵敏度[2-7]。碱基(A,G,C,T)是DNA最主要的发色基团,其吸收光谱分布在紫外短波区(260~270 nm),而含硫类似物则在紫外长波区(UVA)有吸收。徐耀忠等发现4-硫胸苷与UVA光作用能选择地破坏DNA,高选择性的杀死癌细胞,而对正常细胞仅有很小的附带损害[8-11],为癌症和其它疾病治疗提供一种新型的光化学疗法[12-15]。人血清白蛋白(HSA)是血浆中含量最丰富的载体蛋白,它能结合、运输许多内源和外源性化合物分子,是目前研究最多的一种蛋白质[16],常作为研究药物与蛋白质相互作用的模型蛋白[17]。因此,研究药物分子与HSA之间的相互作用,有助于了解药物在人体内的运输、分布和代谢情况,对于阐明药物的药理作用和药物代谢动力学也具有非常重要的意义[18]。
本文设计合成了一种新的4-硫-5-碘尿苷化合物,发现 4-硫-5-碘尿苷的紫外光谱在 345 nm处有最大吸收,相对于5-碘尿苷对UVA光更敏感。利用计算与光谱学实验相结合的方法,进一步研究了4-硫-5-碘尿苷与人血清白蛋白(HSA)的相互作用机制,为硫代核苷对HSA性能的影响提供了一定的实验数据和理论根据。
2 实 验
2.1 仪器与试剂
仪器:JASCO-UV560型紫外-可见分光光度计(日本);JASCO-FP6500型荧光分光光度计(日本);JULABO-F12型制冷和加热循环器(德国,±0.01℃);J-810圆二色分光光度计(日本 Jasco公司);PHB-4酸度计(上海雷磁仪器厂);FA1004电子天平(上海精科天平厂)。
试剂:HSA(去除脂肪酸和球蛋白,Sigma公司,纯度为99%);三羟甲基氨基甲烷(Tris,上海生化试剂厂);尿嘧啶核苷(Sigma公司,纯度98%)。所用的其它试剂均为分析纯。实验用水为二次去离子蒸馏水,无荧光杂质。首先配制0.05 mol/L,pH 为7.40 的 Tris-HCl的缓冲溶液,然后用该 Tris-HCl溶液分别配制浓度为1.0 μmol/L的HSA溶液,以及浓度为1.0 mmol/L的4-硫-5-碘尿苷备用。
2.2 4-硫-5-碘尿苷的合成
4-硫-5-碘尿苷的合成路线如图1所示。
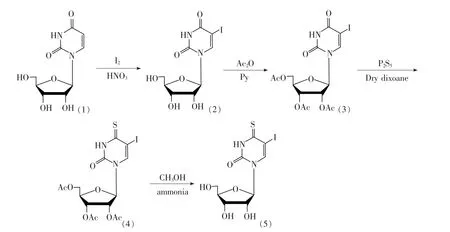
图1 4-硫-5-碘尿嘧啶核苷的合成路线Fig.1 The synthesis route of 4-thio-5-iodouridine
2.2.1 5-碘尿嘧啶核苷的合成(2)
将化合物尿苷(0.98 g,4.00 mmol)(1)溶于20 mL 0.3 mol/L的稀硝酸中,加入碘单质(1.02 g,4.00 mmol),110 ℃油浴加热40 min(TLC 跟踪监测)。反应结束后热过滤,滤液用石油醚萃取3次后,静置于4℃冰箱中冷却,过滤干燥得到白色针状晶体(2)1.26 g,收率 75.32%。
m.p.:207~208 ℃ (文献值 208 ~210℃)[19]。1H NMR(400 MHz,DMSO-d6)δ:3.54 ~3.73(m,2H,H-5',5″),3.89(d,J=4.0Hz,1H,H-4'),4.00(dd,J=4.0 Hz,8.0 Hz,1H,H-3'),4.05(dd,J=4.0 Hz,8.0 Hz,1H,H-2'),5.10,5.29,5.44(d,t,d,1H,1H,and 1H,OH's),5.74(d,J=4.0 Hz,1H,H-1'),8.50(s,1H,H-6),11.71(brs,1H,N—H)。UV(in CH3CN):λmax=280 nm。
2.2.2 2',3',5'-O-三氧乙酰基-5-碘尿嘧啶核苷(3)的合成
将化合物5-碘尿苷(1.00 g,2.70 mmol)(2)溶于15 mL无水吡啶中,冷却至0℃,加入无水乙酸酐(3 mL,32 mmol),在0℃下继续搅拌5 h(TLC跟踪监测)。反应结束后,减压蒸出溶剂,用95%乙醇重结晶,得到白色晶体(3)1.23 g,收率 91.83%。
m.p.:177 ℃ (文献值 177 ~ 178 ℃)[20]。1H NMR(400 MHz,DMSO-d6)δ:2.06,2.07,2.08(3s,3H,3H,3H,OAc's),4.21~4.27(m,2H,H-5',5″),4.31 ~4.36(m,1H,H-4'),5.33 ~5.35(m,1H,H-3'),5.47(dd,J=8.0 Hz and J=8.0 Hz,1H,H-2'),5.88(d,J=4 Hz,1H,H-1'),8.18(s,1H,H-6),11.83(brs,1H,NH)。UV(in CH3CN): λmax=226.5 nm。
2.2.3 2',3',5'-O-三氧乙酰基-4-硫-5-碘尿嘧啶核苷(4)的合成
将化合物 2',3',5'-O-三乙酰基-5-碘尿苷(1.00 g,2.01 mmol)(3)溶于30 mL 无水二氧六环中,加入五硫化二磷固体(0.85 g,3.84 mmol),回流加热1.5 h(TLC跟踪监测),整个体系处于N2保护条件下。反应结束后,减压除去溶剂,粗产品通过硅胶层析分离,得到黄色油状产物0.76 g(4),收率 73.82%。
1H NMR(400 MHz,DMSO-d6) δ:2.07,2.07,2.09(3s,3H,3H,3H,OAc's),4.23~4.31(m,2H,H-5',5″),4.33 ~ 4.36(m,1H,H-4'),5.37(dd,J=4 Hz,8 Hz,1H,H-3'),5.51(dd,J=4.0,4.0 Hz,1H,H-2'),5.86(d,J=4 Hz,1H,H-1'),8.28(s,1H,H-6),13.16(brs,1H,NH)。
2.2.4 4-硫-5-碘尿嘧啶核苷(5)的合成
将 2',3',5'-O-三 乙 酰 基-4-硫-5-碘 尿 苷(0.51 g,1.00 mmol)(4)溶于甲醇的氨气饱和溶液(60 mL,1.50 mmol)中,在室温下密闭搅拌4.5 h。反应结束后,减压蒸出溶剂,粗产品通过硅胶层析分离,得到黄色固体0.47 g(5),收率71.14%。
m.p.:173 ~174 ℃。1H NMR(400 MHz,DMSO-d6)δ:13.00(s,1H,N—H),8.68(s,1H,H-6),5.68(d,1H,J=4 Hz,H-1'),5.40,5.30,5.10(d,t,d,1H,1H,and 1H,OH's),4.06(dd,1H,J=4Hz,J=4 Hz,H-2'),3.88 ~ 3.90(m,1H,H-3'),3.72(dd,1H,J=4 Hz,J=4 Hz,H-5'),3.58(dd,1H,J=4 Hz,J=4 Hz,H-5″)。UV(in CH3CN):λmax=349 nm。IR λmax(film)/cm-1:1 701.6( ==amide C O),1 590.2(C==S)。HR-MS for M++1 calcd m/z 386.935 1,calcd for C9H12IN2O5S found 386.943 3。
2.3 实验方法
2.3.1 紫外吸收光谱
移取2 mL 1.0 μmol/L的HSA于1 cm 的石英比色皿中,用微量进样器逐次加入适量的4-硫-5-碘尿苷溶液(累计体积不超过50 μL),每次加入溶液后静置3 min,测定220~450 nm的紫外吸收光谱。
2.3.2 荧光光谱
288 K 时,移取 2.5 mL 1.0 μmol/L 的 HSA于1 cm的石英比色皿中,用微量进样器逐次加入适量的浓度为1.0 mmol/L 的 4-硫-5-碘尿苷溶液进行荧光滴定(累计体积不超过50 μL),每次加入溶液后静置3 min,以280 nm为激发波长,测定290~450 nm波长范围内HSA的荧光光谱以及HSA在4-硫-5-碘尿苷作用下的荧光猝灭光谱。按同样的方法测定298 K和308 K下相应的荧光光谱。
2.3.3 圆二色光谱
298 K 时,移取 0.5 mL 1.0 μmol/L 的 HSA于1 mm的石英比色皿中,用微量进样器依次加入适量的浓度为1.0 mmol/L 的 4-硫-5-碘尿苷溶液,每次加入溶液后静置3 min,在 CD上测定190~250 nm范围内的圆二色谱。
3 结果与讨论
3.1 4-硫-5-碘尿嘧啶核苷与HSA相互作用的紫外吸收光谱
蛋白质中包含3个残基:色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe),由于它们的生色基团不同而有不同的紫外吸收,其中Trp以及Tyr在280 nm波长附近有一个吸收峰[21]。图2为在HSA中加入不同量比的4-硫-5-碘尿苷后,280 nm下的吸光度值。从实验结果可知,加入4-硫-5-碘尿苷后,HSA的吸光度值有规律地下降,因此可以初步判定,4-硫-5-碘尿苷与 HSA之间有结合,发生了相互作用[22]。

图2 HSA-(4-硫-5-碘尿苷)体系的紫外吸收光谱 (T=298 K)。Fig.2 UV absorption spectra of HSA-ISU system(T=298K).
3.2 4-硫-5-碘尿苷与HSA相互作用的荧光光谱
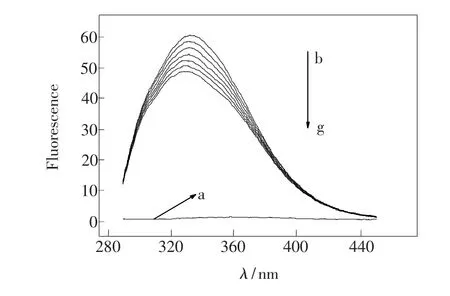
图3 HSA-4-硫-5-碘尿苷体系的荧光光谱。Fig.3 Emission spectra of HSA in the presence of various concentrations of 4-SIU.
蛋白质的内源荧光主要来源于色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)3个残基,三者的荧光发射峰是相互重叠的。由于蛋白质的荧光通常在280 nm或更长的波长被激发,而Phe在绝大多数实验条件下不能被激发,所以很少能观察到Phe的发射,这样蛋白质的内源荧光主要来自Trp和 Tyr残基[23]。从图3可知,使用280 nm为激发波长时,HSA的荧光发射峰主要来自于Trp和 Tyr残基,而4-硫-5-碘尿苷在扫描范围内基本无荧光;随着 4-硫-5-碘尿苷的加入,HSA的荧光强度有规律降低,说明4-硫-5-碘尿苷能使HSA的荧光猝灭,两者之间存在相互作用,我们将进一步对其荧光猝灭机理进行探讨。
3.3 荧光猝灭机理
3.3.1 4-硫-5-碘尿苷与 HSA 的猝灭常数
导致HSA荧光猝灭的原因可能为动态猝灭和静态猝灭。动态猝灭是由于猝灭剂和荧光分子间的彼此扩散和碰撞而导致的荧光强度减弱,是一种能量转移或电子转移的过程,不影响蛋白质的结构和生理活性。静态猝灭则是由于发生了配合作用,通常是生成了不发荧光的复合物,从而导致荧光物质的荧光强度减弱。对于静态猝灭,温度升高会导致基态配合物的稳定性下降,因此静态猝灭常数随温度的升高而下降。为证实4-硫-5-碘尿苷的猝灭过程,将此过程按动态 Stern-Volmer方程处理[24]:

式中F和F0分别为加入和不加入药物HSA溶液的荧光强度;Kq为双分子猝灭过程速率常数;τ0为猝灭剂不存在时荧光体分子平均的寿命(生物大分子τ0约为10 ns),在没有猝灭剂存在的情况下,HSA 的荧光寿命 τ0=1.77 ns;[Q]为猝灭剂(4-SIU)的浓度;Ksv称为动态猝灭常数。滴定时,4-硫-5-碘尿苷总体积小于 50 μL,远小于 HSA 的总体积(2.5 mL),可忽略体积变化。图4为不同温度下,F0/F 随 4-硫-5-碘尿苷浓度变化的 Stern-Volmer图,由图中直线斜率可求出Ksv及Kq,结果如表1所示。

图4 不同温度下的4-SIU-HSA的Stern-Volmer曲线Fig.4 Stern-Volmer plots for the quenching of HSA fluorescence by 4-SIU-HSA at three different temperatures
通常动态猝灭常数Ksv随着温度的升高而增大,表1结果表明,随着温度的升高,4-SIU-HSA体系的Ksv反而减小,且实验结果得出的动态猝灭速率常数Kq远大于各类猝灭剂对生物大分子的最大扩散猝灭常数 Kq=2.0×1010L·mol-1·s-1[25]。因此,可以推断 4-硫-5-碘尿苷与人血清白蛋白体系的猝灭过程为形成配合物所引起的静态猝灭,不是扩散和碰撞引起的动态猝灭。

表1 不同温度下4-硫-5-碘尿苷与HSA的猝灭反应参数Table 1 Quenching reactive parameters of HSA and ISU at different temperatures
3.3.2 人血清白蛋白与 4-硫-5-碘尿苷相互作用的结合常数
根据 Lineweaver-Burk 方程[26]

由(F0-F)-1对[Q]-1作 Lineweaver-Burk 双倒数图。从图5可以看出曲线的线性关系良好,曲线的斜率随着温度的升高有所降低,通过直线斜率的倒数可分别求出不同温度下的4-SIU与人血清白蛋白的结合常数及相关系数(见表1),由结合常数可知4-SIU-HSA之间有较强的结合力,并且受温度影响不大,说明4-SIU可在体内被蛋白质贮存、转运。

图5 不同温度4-硫-5-碘尿苷与 HSA 的 Lineweaver-Burk曲线图Fig.5 Lineweaver-Burk line for the interaction HSA and 4-SIU
3.3.3 4-硫-5-碘尿苷与人血清蛋白之间的作用力
药物小分子与生物大分子间的相互作用力包括氢键、范德华力、静电引力及疏水作用力。通过反应前后热力学参数(如焓变(ΔH)和熵变(ΔS))的变化可以判断药物与蛋白质间作用力类型:△H>0,△S>0为疏水作用力;△H <0,△S<0为氢键和范德华力;△H≈0或较小,△S>0为静电引力。对此我们研究了不同温度条件下二者的结合常数,选择的温度范围为15~45℃,此时HSA不经受任何结构的降解,当温度变化不大时,反应的ΔH可以看作常数。根据Van't Hoff定律[27]:

在式(3)、(4)中,K为对应温度下的结合常数,R为气体常数。由lnK对1/T作图6。

图6 不同温度4-SIU-HSA的Van't Hoff曲线图Fig.6 Van't Hoff plot for the interaction of HSA and 4-SIU-HSA
由直线斜率和截距可以计算出ΔH和ΔS的值,通过式(4)可以计算出不同温度下反应的ΔG。结果见表2。

表2 4-SIU与人血清白蛋白体系的热力学参数Table 2 The related thermodynamic parameters of the 4-SIU HSA system at different temperatures
由表2 中数据可以看出,4-硫-5-碘尿苷与人血清白蛋白相互作用过程中的ΔG为负值。从热力学角度来看,ΔG <0,说明4-硫-5-碘尿苷与人血清白蛋白之间的结合反应能够自发进行。ΔH>0,ΔS >0,表明 4-硫-5-碘尿苷与人血清白蛋白之间的作用力为典型的疏水作用力。
3.3.4 4-硫-5-碘-尿苷与 HSA 之间的能量转移
通过Förster非辐射能量转移理论,可以求出小分子(受体)在蛋白质上的结合位置和与蛋白质分子(供体)中产生荧光的基团之间的距离。理论指出发生能量转移需要满足以下3个条件[27]:(1)供体必须发射荧光;(2)供体的荧光发射光谱和受体吸收光谱之间有适当的重叠;(3)供体与受体之间的距离r范围为2~8 nm。
当能量供体和受体分子间距离为r及能量转移效率为50%时,所对应的临界能量转移距离R0及能量转移效率E之间有如下关系[28]:

其中F0为供体的荧光强度;F为供体和受体浓度为1∶1时的荧光强度;K2指偶极空间取向因子,取给体与受体各向随机分布的平均值2/3;N指介质的折射指数,取水和有机物的平均值1.336;φ为无受体存在时能量给体的荧光量子产率,取HSA 中 Trp 的量子产率为 0.118[29];J 表示给体的发射光谱与受体的吸收光谱之间谱线的重叠的部分(图7中阴影部分);F(λ)为荧光给体在波长为λ时的荧光强度;ε(λ)为受体在波长为λ时的摩尔消光系数。
根据图7可以得到 J=3.66×10-14cm3·L·mol-1,代入式(5) 和(6) 得到 R0=2.13 nm,r=3.01 nm。2 nm <r<8 nm 且满足0.5R0<r<1.5R0[30],说明HSA与ISU间存在非辐射能量转移[31],为 4-硫-5-碘尿苷与人血清白蛋白之间存在猝灭作用提供了理论依据。

图7 HSA的荧光发射光谱和4-硫-5-碘尿苷的紫外吸收光谱(T=298 K),c(HSA)=c(4-硫-5-碘尿苷)=1 μmol/L。Fig.7 Fluorescence emission spectra for HSA and UV absorbance spectra for ISU(T=298 K),c(HSA)=c(ISU)=1.0 μmol/L.
3.4 4-硫-5-碘尿苷与人血清蛋白之间的圆二色光谱
圆二色光谱可以灵敏地检测一些反应引起的蛋白质分子二级结构(如 α-螺旋、β-折叠、β-转角以及无规卷曲等)的变化。图8为4-硫-5-碘尿苷与HSA作用后的CD图。图中在208 nm和222 nm出现2个负槽,这是典型α-螺旋结构的CD光谱信号。当4-硫-5-碘尿苷的浓度从 2.0 μmol/L 逐渐增加至14 μmol/L时,圆二色谱图基本没有发生变化(图8)。结果表明,4-硫-5-碘尿苷对人血清白蛋白的二级结构基本没有改变,其通过血液作用于肿瘤细胞的过程中对人血清白蛋白的结构影响很小,表明HSA是一种可以安全携带4-硫-5-碘尿苷药物达到患处的载体蛋白[32]。
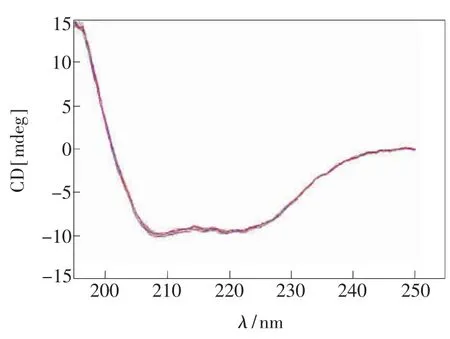
图8 4-SIU与HSA相互作用的CD光谱图Fig.8 Circular dichroism spectra of 4-SIU-HSA
4 结 论
基于硫碱基(thio-base)的易烷基化、易氧化、强紫外长波(UVA)吸收等独特的性质,以及核苷类化合物的抗肿瘤活性,设计合成了一种新化合物4-硫-5-碘尿苷。实验以及理论计算的结果表明4-硫-5-碘尿苷与人血清白蛋白的荧光猝灭属于静态猝灭机制,二者主要靠疏水作用力结合。圆二色数据显示4-硫-5-碘尿苷对HSA的二组结构发生极其微弱的改变,表明此种抗癌药物在人体内只改变氨基酸所处的微环境,在把药物安全输送到肿瘤细胞的过程中,4-硫-5-碘尿苷对HSA没有毒害作用。4-硫-5-碘尿苷与血液中其它蛋白的相互作用有待于进一步的研究,以阐明它的毒理机制。
[1]Lipsett M N.The isolation of 4-thiouridylic acid from the soluble ribonucleic acid of escherichia coli[J].J.Biol.Chem.,1965,240(10):3975-3978.
[2]Milder S J,Kliger D S.Spectroscopy and photochemistry of thiouracils-implications for the mechanism of photocrosslinking in transfer-RNA [J].J.Am.Chem.Soc.,1985,107(25):7365-7373.
[3]Morrison H.In Bioorganic Photochemistry:Photochemistry and The Nucleic Acids[M].New York:Wiley,1990:379-425.
[4]Xu Y Z,Zheng Q G,Swann P F.Preparation of oligodeoxynucleotidescontaining 6-methylthiopurine residues by chemical synthesis or specific methylation[J].Nucleosides& Nucleotides,1995,14(3/4/5):929-933.
[5]Favre A,Saintome C,Fourrey J L,et al.Thionucleobases as intrinsic photoaffinity probes of nucleic acid structure and nucleic acid-protein interactions[J].J.Photochem.Photobiol.B,1998,42(2):109-124.
[6]Xu Y Z,Reactive DNA.2.Thioguanine used as a peg site for direct and specific introduction of biologically useful functional groups[J].Bioorg.Med.Chem.Lett.,1998,8(14):1839-1844.
[7]Xu Y Z.Thiobase DNA:The chemistry and some applications in cancer studies[J].Prog.Nat.Sci.,2002,10:401-413.
[8]Reelfs O,Xu Y Z,Massey A,et al.Thiothymidine plus low-dose UVA kills hyperproliferative human skin cells independently of their human papilloma virus status[J].Mol.Cancer Ther.,2007,6(9):2487-2495.
[9]Liu Z Y,Pan T.Equivalent waveband selection of VIS-NIR spectroscopic measurement for hemoglobin[J].Opt.Precision Eng.(光学 精密工程),2012,20(10):2170-2175(in Chinese).
[10]Gemenetzidis E,Shavorskaya O,Xu Y Z,et al.Topical 4-thiothymidine is a viable photosensitiser for the photodynamic therapy of skin malignancies[J].J.Dermatolog.Treat.,2011,39(22):7698-7703.
[11]Reelfs O,Karran P,Young A R.4-thiothymidine sensitization of DNA to UVA offers potential for a novel photochemotherapy[J].Photoch.Photobio.Sci.,2012,11(1):148-154.
[12]Warren M A,Murray J B,Connolly B A.Synthesis and characterisation of oligodeoxy- nucleotides containing thio analogues of(6-4)pyrimidine-pyrimidinone photo-dimers[J].J.Mol.Biol.,1998,279(1):89-100.
[13]Massey A,Xu Y Z,Karran P.Photoactivation of DNA thiobases as a potential novel therapeutic option[J].Current Biology,2001,11(14):1142-1146.
[14]Loakes D.Modified Nucleosides,Synthesis and Applications[M].India:Research Signpost,2002:1-16.
[15]O'donovan P,Perrett C M,Zhang X,et al.Azathioprine and UVA light generate mutagenic oxidative DNA damage[J].Science,2005,309(5742):1871-1874.
[16]Yan Y,Xu J,Chen G Z.Protein conformation in solution by three-dimensional fluorescence spectrometry[J].Sci.China Ser.B[中国科学(B 辑)],1996,39(5):527-535(in Chinese).
[17]Wu Q H,Wang D Y,Zhou X,et al.Study on the interaction between daidzein and human serum albumin[J].Spectrosc.Spectral.Anal.(光谱学与光谱分析),2009,19(7):1911-1914(in Chinese).
[18]Liang J,Fen S L.Interaction between ambroxolhydrochloride and human serum albumin studied by spectroscopic and molecular modeling methods[J].Spectrosc.Spectral.Anal.(光谱学与光谱分析),2011,31(4):1020-1024(in Chinese).
[19]Morris J R,Philip J B,Jerzy G.Nucleic acid related compounds.38.smooth and high-yield iodination and chlorination at C-5 of uracil bases and p-toluyl-protected nucleosides[J].Can.J.Chem.,1982,60:554-557.
[20]Vineet K,Sanjay V M.Ionic liquid mediated synthesis of 5-halouracil nucleosides:Key precursors for potential antiviral drugs nucleosides[J].Nucleosides & Nucleotides,2009,28(9):821-834.
[21]Wu D,Xu G Y.Study on protein-surfactant interaction by spectroscopic methods[J].Acta Physico-Chimica Sinica(物理化学学报),2006,22(2):254(in Chinese).
[22]Stryer L.Fluorescence energy transfer as a spectroscopic ruler[J].Annu.Rev.Biochem.,1978,47(3):819-846.
[23]Bi S Y,Ding L,Song D Q,et al.Studies on the binding mechanism of several antibiotics and human serum albumin[J].Acta Chimica Sinica(化学学报),2005,63(23):2169-2173(in Chinese).
[24]Xu J G,Wang B Z.Fluorescence Analysis Method[M].Beijing:Science Press,2006:64(in Chinese).
[25]Hu Y J,Liu Y,Zhang L X,et al.Studies of interaction between colchicine and bovine serum albumin by fluorescence quenching method [J].J.Mol.Struct.,2005,750(1/2/3):174-178.
[26]Xie B,Wan B J,Qin Z H.Interaction between congo red and human serum albumin by fluorescence quenching method[J].Chin.J.Spectrosc.Lab.(光谱实验室),2011,28(2):764-769(in Chinese).
[27]Liu B S,Yang C,Wang J,et al.Luminescence mechanism study of the conjugation reaction between cefpirome sulfate and bovine serum albumin[J].Chin.J.Lumin.(发光学报),2011,32(3):293-299(in Chinese).
[28]Kandagal P B,Shaikh S M T,Manjunatha D H,et al.Spectroscopic studies on the binding of bioactive phenothiazine compounds to human serum albumin[J].J.Photochem.Photobiol.A:Chem.,2007,189(1):121-127.
[29]Yu X,Liu R H,Ji D H,et al.Spectroscopic studies on the interactions between 3,4-dihydropyrimidin-2-(1-H)-ones and bovine serum albumin[J].Spectrochim.Acta A,2010,77(1):213-218.
[30]Chen D W,Xie Q J,Su Y H,et al.Fluorescent studies on the interactions between Au nanoparticles and quercetin as well as bovine hemoglobin[J].J.Anal.Sci.(分析科学学报),2008,24(3):259-264(in Chinese).
[31]Mandal P,Bardhan M,Ganguly T.A detailed spectroscopic study on the interaction of rhodamine 6G with human hemoglobin[J].J.Photochem.Photobiol.B,2010,99(2):78-86.
[32]Pei M Y,Zheng X F,Cao H Y,et al.Spectroscopic studies on interaction between 3-bromopyruvic acid and human serum albumin[J].Chin.J.Anal.Chem.(分析化学),2010,7(38):948-952(in Chinese).
