多重PCR快速检测猪伪狂犬病病毒、猪圆环病毒2型方法的建立
2013-08-08谢燕婷
谢燕婷
(厦门银祥集团 肉食品安全生产技术国家重点实验室 福建厦门 361000)
猪伪狂犬病病毒、猪圆环病毒2 型常呈混合感染,在临床上以受感染母猪产死胎、畸形胎、木乃伊胎及病弱仔猪为主要特征,同时能导致疫苗免疫失败,诱发继发感染[1]。目前,对于病毒性疫病的诊断一般采用病原分离鉴定和血清学方法[2],但这些方法存在操作繁琐、耗时长、敏感性差等不足,当猪群感染多种病原时,难以应用常规方法进行早期快速检测和鉴别诊断。而多重PCR 方法可以在一份样品中同时检测出多种病原,对多种疾病进行同步诊断,具有快速、敏感、特异、经济等优点。
1 材料与方法
1.1 病毒与细胞 猪伪狂犬病病毒(PRV)、猪圆环病毒2 型(PCV2)由福建省农业科学院畜牧兽医研究所畜病室惠赠。
1.2 主要试剂 Taq DNA 聚合酶、琼脂糖购于宝生物工程(大连)有限公司,Dneasy Blood&tissue kit 购于德国Qiagen,AxyPrep DNA 凝胶回收试剂盒购于美国Axygen,Endo-free Plasmid Mini KitⅠ质粒提取试剂盒购于美国Omega,TOPO TA Cloning Kit 购自厦门英韦创津生物科技有限公司。
1.3 引物设计 根据Genbank 上发表的序列,引物选择PRV gB 基因、PCV2 ORF2 基因为其扩增靶序列,借助Primer Premier 5.0 及DNAstar 软件筛选设计出符合多重PCR 要求的2 对引物[3-4]。引物由厦门英韦创津生物科技有限公司合成,合成引物于-20 ℃保存。引物序列如下:
SuHV-1:5’CGATGGGGTAGTAGTGCT3’,3’GA ACCTCTGCGTGAACGG5’;
PCV2:5’GAGTAGTTTACATAGGGGTCA3’,3’ATTGCGGAGGAACCTATGC5’。
1.4 病毒DNA的提取 根据Dneasy Blood&tissue kit 提取试剂盒说明书操作步骤进行病毒核酸的提取。
1.5 mPCR 方法的建立 mPCR 反应在50μL 体系中进行,包括10×PCR bufer(Mg2+Free)5μL,2.5 mM dNTP 4μL,MgCl225 mM 3μL、单个病毒的各自上下游引物10μM 各1μL,TaqTM DNA 聚合酶5 U/μL 0.25μL,用去离子水补足50μL,于PCR 仪上扩增。反应条件:95 ℃预变性5 min,95 ℃30 s,57.9 ℃45 s,72 ℃1 min,35个循环;72 ℃延伸10 min。取5μL 扩增产物通过1.5%琼脂糖凝胶电泳进行鉴定。
2 试验结果
2.1 PCR 产物的克隆、鉴定结果 对PRV、PCV2的重组质粒进行PCR 鉴定,PRV、PCV2 分别为373 bp与430 bp,与预期目的片段一致。将测序结果与Genbank 上收录的序列进行BLAST 比较,结果表明扩增片段分别为各自病毒的特异性条带。
2.2 mPCR 反应最佳退火温度的确定 将混合好的反应体系在不同的退火温度条件下进行mPCR反应(见图1),退火温度分别为60.0 ℃、59.3 ℃、57.9 ℃、56.2 ℃、54.9 ℃、54.0 ℃、53.5 ℃。从图1 可以看出,mPCR的最佳退火温度为57.9 ℃。
2.3 单重PCR 及多重PCR的特异性试验 扩增产物的大小,由琼脂糖凝胶电泳试验确定,结果表明PRV为373 bp,PCV2为430 bp,见图2-图3。以双蒸水、PRV、PCV2、PPV、PRRSV、CSFV 病毒为模板分别进行mPCR 反应,结果表明双蒸水、PPV、PRRSV、CSFV 病毒均未扩增出条带,见图4。
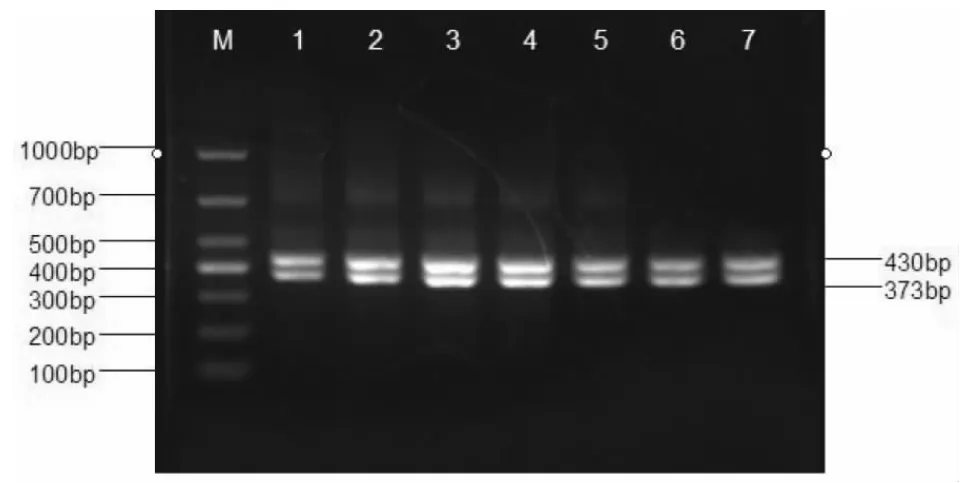
图1 不同退火温度的PCR 反应
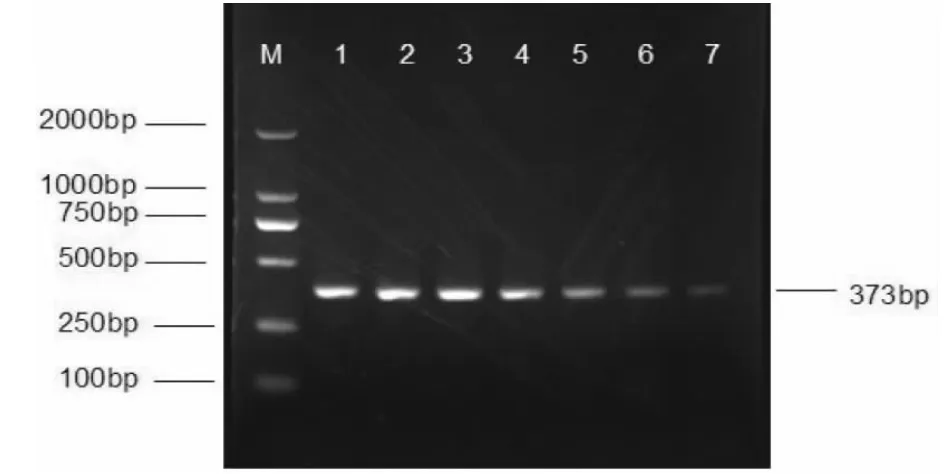
图2 PRVPCR 敏感性试验

图3 PCV2 PCR 敏感性试验
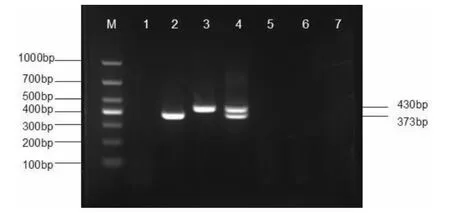
图4 单重PCR、多重PCR 反应及特异性试验
2.4 PCR 扩增的敏感性试验 将提取的PRV、PCV2 质粒用岛津的紫外风光光度计UV-1800 中的DNA 定量功能测定核酸浓度,经过十次重复试验得出PRV 质粒核酸浓度为161.75 ng/μL,PCV2 质粒核酸浓度146.94 ng/μL。用灭菌双蒸水进行l0倍倍比稀释,取10倍倍比稀释的病毒质粒做模板分别进行单个病毒PCR 反应和进行病毒mPCR 反应,检测其敏感性。结果表明,在单个病毒的PCR 反应中,单个病毒PCR 反应检测限量为1.47×10-8~1.62×10-6ng;在病毒mPCR 反应中,病毒mPCR 反应的检测限量为1.47×10-6~1.62×10-4ng,见图5。
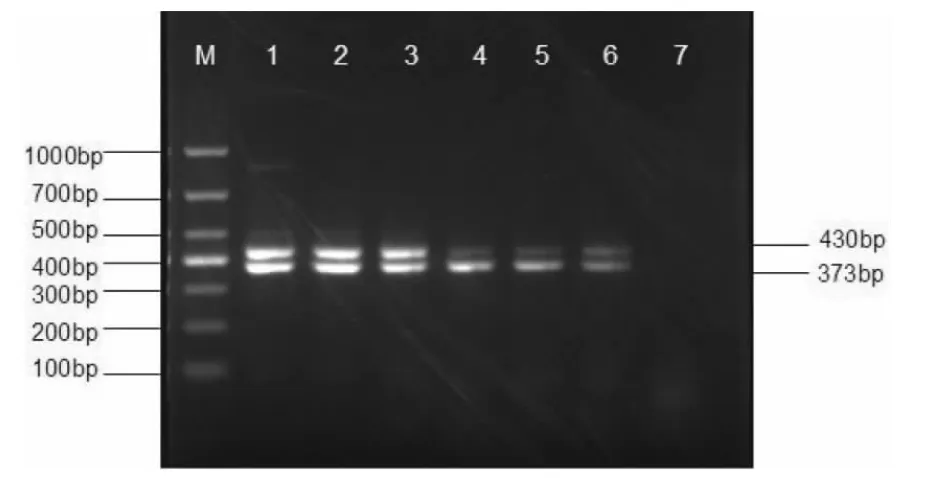
图5 多重PCR 敏感性试验
3 讨论
在mPCR 反应中,引物的设计至关重要,决定mPCR 反应成功与否[5]。本研究从Genbank 上分别下载了21 株PCV2 基因和2 株PRV 基因,通过DNAstar 进行比对,引物的设计是针对以上2 种病毒各自保守的区域,分别为PCV2 ORF2 基因及PRV gB 基因,在最保守的区域设计引物。多重PCR扩增时,反应体系中各组分的浓度及反应条件直接影响试验效果。因此,在多重PCR 扩增前需对PCR扩增的各种反应条件进行优化,使每个病毒的引物长度为18~21 bp,G+C 含量在40%~55%,Tm 值尽量一致,避免引物二聚体及发卡结构。在敏感性试验中,通过将单个病毒PCR的敏感性与mPCR的敏感性进行比较,结果表明,4 种病毒的mPCR 敏感性相对减少了2个稀释倍数,但其核酸检测可至1.47×l0-6~1.62×10-6ng,仍然具有很强的敏感性。而多重PCR 特异性试验结果显示,对双蒸水、猪细小病毒(PPV)、猪繁殖与障碍综合征病毒(PRRSV)、猪瘟病毒(CSFV)多重PCR的扩增结果均为阴性,作为临床上猪伪狂犬病、猪圆环病毒2 型感染的病原学快速诊断方法具有可行性。
[1]曲光刚,沈志强,管宇,等.PRV、PCV-2、PPV 多重PCR检测方法的建立及其应用[J].中国动物检疫,2009,26(1):23-25.
[2]李维华,任慧英,刘文,等.PCV2、PPV、PRV、PRRSV和CSFV 复合PeR的应用研究[J].西北农业学报,2008,17(3):12-15.
[3]Fengxiong Yue,Shangjin Cui,Chaofan Zhang,et al.A multiplex PCR for rapid and simμLtaneous detection of porcine circovirus type 2,porcine parvovirus,porcine pseudorabies virus,and porcine reproductive andrespiratory syndrome virusin clinical specimens[J].Virus Genes,2009,38:392-397.
[4]Hirohito Ogawa,Osamu Taira,Takuya Hirai,et al.Multiplex PCR and mμLtiplex RT-PCR for inclusive detection of majorswine DNA and RNA viruses in pigs with multiple infections[J].Journal of Virological Methods,2009,160(1/2):210-214.
[5]岳丰雄,崔尚金,冉多良,等.多重PCR 方法用于检测猪圆环病毒2 型、猪细小病毒、猪伪狂犬病病毒、猪繁殖与呼吸综合征病毒诊断方法的建立[J].养猪,2010(3):41-44.
