鸡BMP4的结构与功能分析
2013-08-08程博涵
程博涵,冷 丽,李 辉
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.农业部鸡遗传育种重点实验室,哈尔滨 150030)
骨形态发生蛋白(Bone morphogenetic pro⁃teins,BMPs)是多功能细胞因子,属于转化生长因子β(TGF-β)超家族,能够诱导血管周围及结缔组织中未分化的间充质细胞向骨和软骨细胞方向分化,从而形成骨组织,最早由Urist发现[1]。BMP4是BMPs家族中的一种,参与机体细胞的生长、分化、凋亡、迁移及细胞外基质的形成等众多生理、病理活动的调控。BMP4基因在卵巢组织中高丰度表达,且在垂体、下丘脑、子宫、脂肪、心脏等多种组织中均有表达。BMP4不仅具有促进软骨和骨组织形成的作用,可促进原始卵泡发育及向初级卵泡的转化[2]。近期研究表明,BMP4在多潜能干细胞向脂肪细胞定向分化的过程中也发挥着重要作用[3-5]。研究发现,在胚胎发育早期,BMP4对器官的发生和发育同样具有重要意义[6]。
本研究基于NCBI数据库上的鸡BMP4基因全长mRNA序列,应用生物信息学方法对其编码蛋白质进行理化性质、信号肽、结构域、Motif、三维结构等方面的预测,并分析其生物学功能。此外,本研究基于NCBI数据库上10个物种的BMP4 mRNA序列,对其编码的氨基酸进行序列比对,并进行同源性和进化关系分析,旨在为鸡BMP4功能研究奠定基础。
1 材料与方法
1.1 各物种BMP4基因序列
利用NCBI数据库获取BMP4基因序列:鸡NM_205237,小鼠 NM_007554.2,马 NM_00116 3970,绵羊NM_001110277,人NM_001202,非洲爪蟾NM_001101793,猪NM_001101031,牛NM_001045877,斑马鱼NM_131342,山羊EF632080。
1.2 物种间BMP4氨基酸同源性及进化关系分析
利用DNAMAN软件对BMP4基因的氨基酸序列进行比对,并进行同源性和进化关系分析。
1.3 BMP4理化性质分析
利用ProtParam和ProtScale工具对BMP4的氨基酸组成、分子质量、理论等电点和疏水性进行分析。
1.4 BMP4信号肽和跨膜区预测
信号肽能指导蛋白质的跨膜分泌和定位。本研究中BMP4信号肽和蛋白质跨膜区预测分别采用SignalP4.0 Server和TMHMM程序进行分析。
1.5 BMP4结构域预测
结构域是蛋白质中能折叠成特定三维结构的一段区域,具有相同结构域的蛋白被称作一个蛋白家族。本研究使用EMBL网站的SMART工具对BMP4的结构域进行分析。
1.6 BMP4 Motif搜索
Motif是蛋白质序列中较短的保守区域,通常可以决定一个蛋白家族。本研究利用ExPASy网站上的ScanProsite工具对BMP4中的Motif进行搜索。
1.7 BMP4同源建模和三维结构预测
蛋白质的三维结构是蛋白质在体内发挥功能的存在形式,能够提供丰富的功能信息。本研究应用SWISS-MODEL Workspace蛋白质建模平台对BMP4进行同源建模和三维结构预测。
2 结果与分析
2.1 物种间BMP4氨基酸序列同源性及进化关系分析
将鸡、非洲爪蟾、斑马鱼、小鼠、人、猪、山羊、牛、绵羊和马的BMP4氨基酸序列进行比对分析,发现BMP4氨基酸序列比较保守,哺乳动物间序列同源性很高(见图1a)。进化聚类分析显示,由该基因构建的生物进化关系图谱与已知物种进化关系基本一致(见图1b)。

图1 BMP4氨基酸序列聚类分析Fig.1 Cluster analysis of BMP4 amino acid sequence
2.2 BMP4理化性质分析
使用ProtParam工具对BMP4理化性质进行分析(见表1)。

表1 BMP4各种氨基酸残基含量Table 1 The content of a variety of amino acid residues of BMP4
BMP4各种氨基酸残基的含量:亮氨酸含量最高(9.9%),精氨酸次之(8.9%),色氨酸最低(1.5%),半胱氨酸含量为2.0%。BMP4的分子质量为46 ku,理论等电点为9.07。利用ProtScale工具中的Kyte-Doolittle法进行疏水性分析,Window size设置为11,结果显示BMP4为亲水性蛋白(-0.507),其N端氨基酸1~23有1个疏水区段(2.975),而在氨基酸280~305有1个亲水区段(-3.653)(见图2)。
2.3 BMP4信号肽预测和跨膜区分析
通过SignalP-4.0 Server工具分析发现BMP4具有信号肽(氨基酸1~23),可能的剪切位点位于23和24位氨基酸之间(TNH-AS D=0.747,D-cut⁃off=0.450),含有信号肽酶识别的AXXA结构(见图3)。

图2 BMP4疏水性分析Fig.2 Hydrophobicity of BMP4

图3 BMP4信号肽预测Fig.3 Signal peptide prediction of BMP4
使用TMHMM工具进行跨膜区分析,结果表明BMP4没有跨膜区,并处于细胞膜外部(见图4),很可能是一种分泌性蛋白,证实该蛋白可以在细胞外与细胞膜上的受体结合,从而发挥生物学功能。
2.4 BMP4结构域预测
SMART工具分析BMP4结构域结果显示,该蛋白具有TGF-β蛋白家族保守结构域,位于氨基酸304~404,是BMP4的成熟肽区,该结构域具有7个保守的半胱氨酸残基,其中6个形成分子内二硫键,1个参与分子间二硫键的形成(即半胱氨酸结),使2个多肽键连接成二聚体;氨基酸1~23为信号肽区;氨基酸26~275为TGF-β家族前肽区,与成熟肽区之间有一蛋白酶切位点RXXR,并且没有跨膜区及复合螺旋区。
结果见图5。
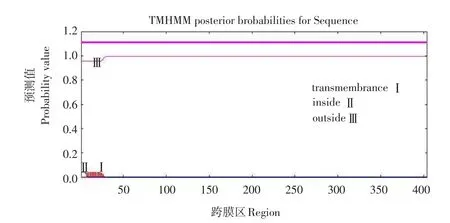
图4 BMP4跨膜区预测Fig.4 Transmembrane region prediction of BMP4

图5 BMP4结构域预测Fig.5 Domain prediction of BMP4
2.5 BMP4 Motif搜索
使用ExPASy网站上的ScanProsite工具进行鸡BMP4的Motif搜索,共找到20个Prosite位点。其中包括:1个TGF-β2家族保守结构,位于氨基酸287~404;1个TGF-β1家族标签,位于氨基酸322~337;1个双向核定位基序,位于氨基酸286~302;3个N-肉豆蔻酸化位点,位于氨基酸20~25(GTNHAS) 、 40~45 (GQAGSG) 、 262~267(GGDWAQ);8个PKC磷酸化位点,位于氨基酸30~32(TGR)、 44~46(SGR)、 111~113(TSR)、116~118(TVR)、189~191(SER)、285~287(TRR)、291~293(SPK)、297~299(SRK);2个酰胺化位点,位于氨基酸30~33(TGRK)和44~47(SGRR);5个酪氨酸激酶Ⅱ磷酸化位点,位于氨基酸92~95(SGEE)、98~101(SLQE)、146~149(SVPD)、154~157(SSAE)、209~212(TRWE);4个 N-糖基化位 点 , 位 于 氨 基 酸 143~146(NLSS)、 207~210(NVTR)、346~349(NSTN)、361~364(NSSI)。
2.6 BMP4同源建模和三维结构预测
应用SWISS-MODEL Workspace平台对BMP4编码的蛋白质进行同源性建模和三维结构预测。反馈结果提示:BMP4成熟肽和2h62B[7-9](1.85A)(303~404)有91.18%的氨基酸序列一致,E值为8.45e-56。SWISS-MODEL Workspace平台以2h62B为模板推测出了BMP4的三维结构(见图6)。

图6 BMP4三维结构预测Fig.6 Three-dimensional structure prediction of BMP4
3 讨论与结论
随着人类和真核生物基因组测序完成,现代基因工程学已经步入后基因组时代[10]。面对核酸、蛋白序列及结构数据资源增长,生物信息学应运而生并逐步发展,逐渐成为生命科学在信息时代的核心内容之一。本研究利用生物信息学网络资源,对鸡BMP4的蛋白性质、结构、功能以及不同物种间BMP4氨基酸序列的同源性及进化关系进行比较详细的分析。
BMP4是一种生长因子,疏水性、信号肽、跨膜区分析表明鸡BMP4具有信号肽(氨基酸1~23,含有信号肽酶识别的AXXA结构),无跨膜区,可能位于细胞外,并通过与细胞膜上的受体结合而向特定细胞传递信号;氨基酸280~305有一个亲水区段(-3.653),包含蛋白酶切位点RXXR,为BMP4成熟肽剪切位点。结构域和Motif搜索发现,该蛋白成熟肽具有TGF-β超家族结构域(7个半胱胺酸残基),其中6个形成分子内二硫键,即半胱氨酸结,1个在BMP4构成二聚体(同源或异源)的过程中形成分子间二硫键,维持蛋白构象并保持生理功能;同时,BMP4分子中存在N-肉豆蔻酸化、PKC磷酸化、酰胺化、酪氨酸激酶Ⅱ磷酸化以及N-糖基化等位点。蛋白三维结构分析发现,鸡BMP4成熟肽序列与2h62B相似性达到91.18%。进化聚类分析显示,由该基因构建的生物进化关系图谱与已知物种进化关系基本一致,这说明该基因在物种进化过程中发生一定程度突变,BMP4信号通路是自然选择的作用位点。
生物信息学分析表明鸡BMP4具有信号转导功能,可作为信号分子在软骨和骨形成、原始卵泡发育、干细胞向脂肪细胞定向分化以及早期胚胎发育过程中发挥作用。本研究为鸡BMP4功能的研究提供理论依据,但对其结构和功能推测还需试验进一步验证。
[1] Urist M R.Bone:formation by autoinduction.[J].Science.1965,150(698):893-899.
[2] Nilsson E E,Skinner M K.Bone morphogenetic protein-4 acts as an ovarian follicle survival factor and promotes primordial follicle development[J].Biol Reprod,2003,69(4):1265-1272.
[3] Butterwith S C,Wilkie R S,Clinton M.Treatment of pluripoten⁃tial C3H 10T1/2 fibroblasts with bone morphogenetic protein-4 induces adipocyte commitment[J].Biochem Soc Trans,1996,24(2):163.
[4] Otto T C,Bowers R R,Lane M D.BMP-4 treatment of C3H10T1/2 stem cells blocks expression of MMP-3 and MMP-13[J].Bio⁃chem Biophys Res Commun,2007,353(4):1097-1104.
[5] Tang Q Q,Otto T C,Lane M D.Commitment of C3H10T1/2 plu⁃ripotent stem cells to the adipocyte lineage[J].Proc Natl Acad Sci,2004,101(26):9607-9611.
[6] Shimasaki S,Zachow R J,Li D,et al.A functional bone morphoge⁃netic protein system in the ovary[J].Proc Natl Acad Sci,1999,96(13):7282-7287.
[7] Arnold K,Bordoli L,Kopp J,et al.The SWISS-MODEL work⁃space:a web-based environment for protein structure homology modelling[J].Bioinformatics,2006,22(2):195-201.
[8] Schwede T,Kopp J,Guex N,et al.SWISS-MODEL:An automat⁃ed protein homology-modeling server[J].Nucleic Acids Res.2003,31(13):3381-3385.
[9] Guex N,Peitsch M C.SWISS-MODEL and the Swiss-PdbView⁃er:an environment for comparative protein modeling[J].Electro⁃phoresis,1997,18(15):2714-2723.
[10] Hubbard M J.Functional proteomics:The goalposts are moving[J].Proteomics,2002,2(9):1069-1078.
