蝴蝶兰花自然衰老与活性氧代谢的关系1)
2013-08-08张永平
张永平
(唐山师范学院,唐山,063000)
有关鲜花衰老的报道相比叶和果实的成熟衰老要少一些[1-2],并且多数研究集中在对鲜切花的衰老与保鲜上,尤其对兰花的研究多集中在栽培生理、鳞球茎的贮藏保存、形态解剖学及授粉后乙烯变化等方面,对采后的生理生化研究较少[3]。到目前为止,尚未见有对蝴蝶兰花自然衰老中活性氧代谢的报道。蝴蝶兰(Phalaenopsis amabilis)作为一种名贵花卉,在自然状况下花期为2~3个月。蝴蝶兰花期的长短直接影响到它的观赏质量,也影响到蝴蝶兰的经济价值和市场效应。因此,探究蝴蝶兰花衰老的相关机制,对于改善蝴蝶兰的观赏价值具有非常重要的理论和实践意义。
本试验以蝴蝶兰的萼片、花瓣和唇瓣为材料,探究蝴蝶兰花衰老与活性氧代谢的关系,以期为延缓衰老,延长花期提供理论参考。
1 材料与方法
蝴蝶兰花取自唐山师范学院生命科学系温室内。根据开放程度将花分为5个时期:小蕾期(花直径1.2 ~1.4 cm)、中蕾期(花直径2.2 ~2.4 cm)、初开期(1~2片萼片开放)、盛开期(花径为8.3~8.5 cm)和衰败期(花瓣已经出现较明显的失水萎蔫症状,此时单花质量约0.4 g)。每天上午8:00—9:00采集花朵,去除花梗和雌雄蕊,留下萼片、花瓣和唇瓣进行试验。
可溶性蛋白质量浓度与活性氧质量摩尔浓度及保护酶活性的测定参照郝再彬[4]和汤章成[5]的方法并加以改进。其中MDA质量摩尔浓度测定采用双组分分光光度法(单位μmol·g-1);可溶性蛋白质量浓度测定采用考马斯亮蓝;H2O2质量摩尔浓度测定采用丙酮提取,Ti(IV)比色法(以 μmol·g-1表示H2O2质量摩尔浓度);·产生速率测定采用羟胺氧化法(以 nmol·min-1·mg-1表示·产生速率);SOD活性测定采用氮蓝四唑光化还原法(酶活性单位U·mg-1);POD活性测定采用愈创木酚比色法(酶活性单位 μmol·mg-1·min-1);CAT 活性测定采用紫外吸收法(酶活性单位 μmol·mg-1·min-1)。
2 结果与分析
2.1 蝴蝶兰花自然衰老过程中SOD活性和·产生速率变化
2.1.1 SOD 活性变化
随着蝴蝶兰花自然成熟与衰老,除萼片中的SOD活性在初开期有小幅回落外,萼片、花瓣和唇瓣的SOD活性总体变化趋势一致,即基本上呈连续升高态势。花瓣和萼片从小蕾期至初开期SOD活性缓慢上升,此后SOD活性急剧上升,到衰败期达到最高。而唇瓣SOD活性变化从小蕾期至衰败期均呈缓慢上升态势。衰败期时萼片、花瓣和唇瓣中的SOD活性分别为小蕾期的18.7、14.1与4.6倍。
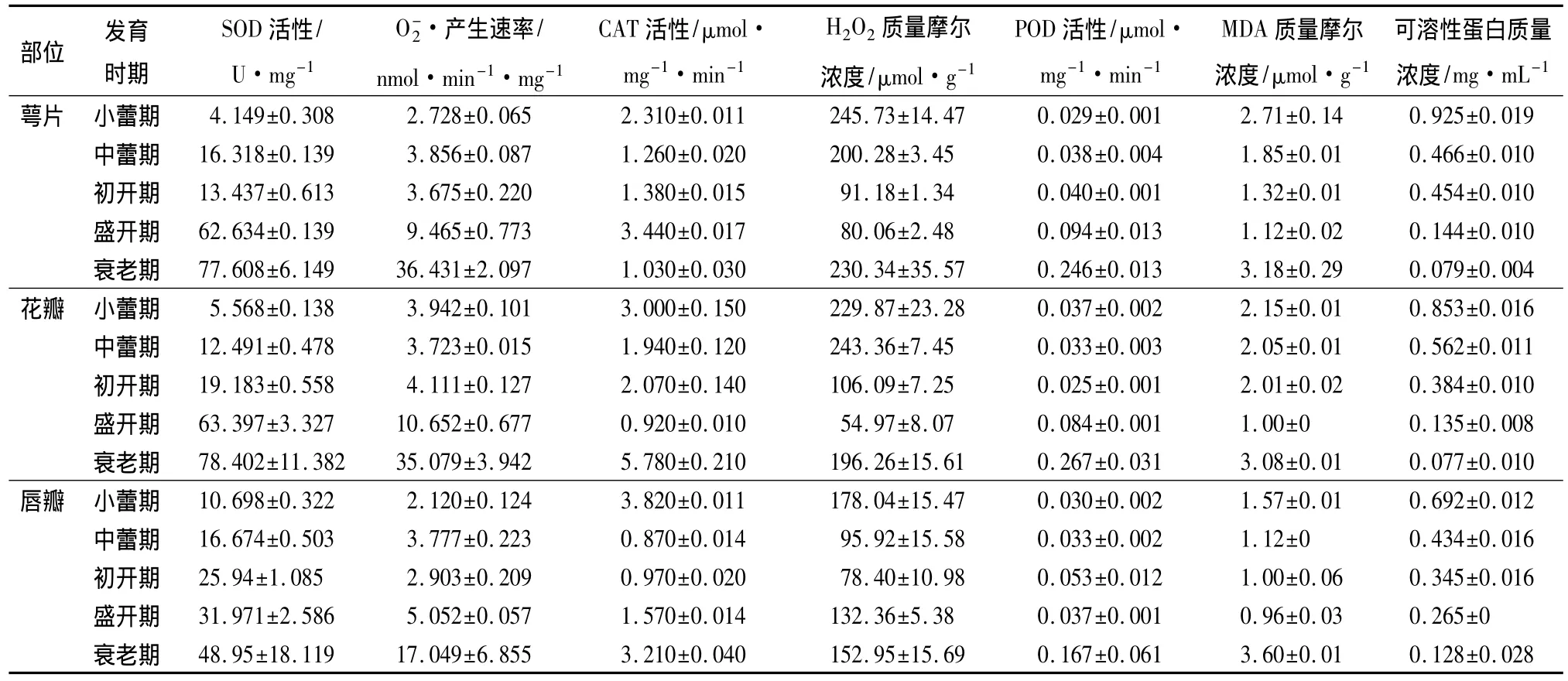
表1 蝴蝶兰花自然衰老过程中萼片、花瓣与唇瓣生理指标的变化
2.2 蝴蝶兰花自然衰老过程中CAT活性和H2O2质量摩尔浓度变化
2.2.1 CAT 活性变化
萼片、花瓣和唇瓣的CAT活性在各个开花时期变化差异较大。从小蕾期到初开期三者变化趋势相似,均呈下降趋势,其中唇瓣的变化幅度最大。初开期后,萼片和唇瓣 CAT活性均迅速升高,而花瓣CAT活性继续下降,一直到盛开期降低为小蕾期的33%。而萼片在盛开期出现高峰。从盛开期到衰败期,CAT活性在萼片中急剧下降,在唇瓣中继续上升,而在花瓣中急剧升高,并在衰败期积累为盛开期的6.3 倍。
2.2.2 H2O2质量摩尔浓度变化
萼片、花瓣和唇瓣的H2O2质量摩尔浓度总体上均呈先降后升的变化趋势。萼片和花瓣从小蕾期至盛开期H2O2质量摩尔浓度迅速下降,盛开期降低为小蕾期的32.6%与23.9%,此后,H2O2质量摩尔浓度急剧上升,一直到衰败期达到最高。而唇瓣H2O2质量摩尔浓度逐渐降低,到初开期达到最低;此后H2O2质量摩尔浓度也升高,衰败期达到最高。萼片、花瓣和唇瓣的H2O2质量摩尔浓度在小蕾期和衰败期均保持在较高水平,并且2个时期的H2O2质量摩尔浓度差异不大。
2.3 蝴蝶兰花自然衰老过程中POD活性变化
从小蕾期到初开期萼片、花瓣和唇瓣的POD活性均保持较低水平,其变化范围为0.025~0.053 μmol·mg-1·min-1。初开期后,萼片和花瓣 POD活性迅速上升,到衰败期达到最高。而唇瓣POD活性从初开期到盛开期有较小的下降趋势,但此后迅速上升,并在衰败期达到最大值。萼片、花瓣和唇瓣在衰败期的POD活性分别是小蕾期的8.4、7.2、5.6 倍。
2.4 蝴蝶兰花自然衰老过程中MDA质量摩尔浓度变化
萼片、花瓣和唇瓣的MDA质量摩尔浓度呈先降低后升高的变化趋势。从小蕾期至盛开期,三者均呈下降趋势,到盛开期达到最低。其中萼片的变化幅度最大,到盛开期降低为小蕾期的42%,花瓣次之,唇瓣最低。盛开期后,三者的MDA质量摩尔浓度急剧上升,到衰败期时萼片、花瓣和唇瓣MDA质量摩尔浓度分别为盛开期的 2.8、3.1、3.8 倍。
2.5 蝴蝶兰花衰老过程中可溶性蛋白质量浓度变化
蝴蝶兰花的萼片、花瓣和唇瓣的可溶性蛋白质量浓度呈明显的下降趋势。从小蕾期到中蕾期,三者的可溶性蛋白质量浓度迅速下降,其中萼片的下降速度最快;从中蕾期到初开期,花瓣蛋白质量浓度下降的速度快于唇瓣,而萼片质量浓度变化不大;到盛开期,萼片和花瓣可溶性蛋白质量浓度急剧下降,三者的可溶性蛋白质量浓度均在衰败期达到最低。
3 结论与讨论
自由基衰老学说认为,衰老过程即活性氧累积的过程[6]。衰老植株活性氧的质量摩尔浓度较正常植株上升明显,引发膜脂过氧化加强,导致植物衰老。大量研究表明,SOD、POD和CAT在果实衰老过程中表现诱导酶特性[7-8],在离体叶片衰老中则表现出保护酶的特性而出现活性下降的现象[7]。在花中也有一些相关的研究结果被报道,如康乃馨、桂花与墨兰衰老过程中表现出抗氧化物酶活性下降[9-11];与上述3种花衰老过程中POD活性表现不同的是,在本研究中,蝴蝶兰花瓣与萼片在衰老过程中过氧化物酶的活性却表现为持续增加的趋势,这与王支槐等[1,12]在海仙花中的结果相似,这说明蝴蝶兰花衰老过程中POD也主要是起诱导酶特性,并且蝴蝶兰花中POD有可能参与IAA降解过程而加速花的衰老,但这需要进一步的试验研究来证明。
与POD活性变化不同,萼片、花瓣和唇瓣中的CAT活性在花衰老过程中是先轻微下降而在盛开后有所增加,虽然花瓣CAT活性又在衰老期下降。但总的来看,蝴蝶兰花瓣与萼片中CAT在小蕾至初开期表现出的是保护酶特性,而在盛开之后又表现出一定的诱导酶特性,这与前人在桂花(CAT活性先升后降)和蜡梅花(CAT活性持续下降)上的试验结果都不相同[11,13]。另外,SOD在盛开期后的蝴蝶兰花中由于活性大幅增加而主要表现为诱导酶特性,这与蜡梅花瓣衰老过程中也不尽相同[13],后者的SOD活性表现总趋势是先增加后下降。结合本研究与前述在康乃馨、桂花、墨兰与海仙花上做的一些相关研究[1,9-13],也可推测在不同种类的花中,其衰老过程中SOD、CAT与POD这些保护酶类所起的作用不尽相同,但具体机理仍需进一步研究。
另外,本试验中萼片、花瓣和唇瓣在不同开花时期各生理指标变化幅度差异明显,其中萼片变化最剧烈,花瓣次之,唇瓣比较缓和,这与外部形态衰老过程基本一致:萼片首先衰老,花瓣次之,唇瓣最慢。因此,萼片、花瓣和唇瓣在衰老过程中,经历相似的变化过程,但三者衰老的先后顺序不同。
[1] 王支槐,韩小琴.海仙花开花和衰老过程与膜脂过氧化[J].西南师范大学学报:自然科学版,1997,22(1):68-72.
[2] 李宪章.花的衰老与切花保鲜[J].植物学通报,1994,11(4):26-32.
[3] 吴岗芳,黄锦佳,蔡世英.蝴蝶兰切花活性氧化代谢及其调控[J].热带作物学,2003,24(1):63-69.
[4] 郝再彬,仓晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:67,106-115.
[5] 汤章成.现代植物生理学实验指南[M].北京:科学出版社,2004:308-309.
[6] 杨淑慎,高俊凤.活性氧、自由基与植物的衰老[J].西北植物学报,2001,21(2):215-220.
[7] 颉建明,颉敏华.果实成熟衰老过程中保护酶活性变化的研究综述[J].甘肃农业科技,2003(3):30-32.
[8] 周春华,刘红霞,韦军.活性氧与果实成熟衰老[J].上海交通大学学报:农业科学版,2002,20(1):77-84.
[9] Droillard M J,Paulin A.Isozymes of superoxide dismutase in mitochondria and peroxisomes isolated from petals of carnation(Dianthus caryophyllcus)during senescence[J].Plant Physiology,1990,94:1187-1192.
[10] 黄执缨.墨兰花朵发育和衰老生理的初步研究[J].生物学杂志,2003,20(4):26-27.
[11] 陈洪国,刘顺枝.湖北咸宁地区桂花开花和衰老过程中花瓣的某些生理生化指标变化[J].植物生理学通讯,2006,42(1):112-114.
[12] 王支槐,徐柳.海仙花开花和衰老过程中的生理变化[J].植物生理学通讯,1995,31(6):419-421.
[13] 王支槐,周启贵,陈晓光.蜡梅花开花和衰老过程与膜脂过氧化[J].西南师范大学学报:自然科学版,1998,23(4):467-470.
[14] Fobel M,Lynch D V,Thompson J E.Membrane deterioration in senescing carnation flowers[J].Plant Physiology,1987,85:204-211.
[15] Itzhaki H,Borochov A,Mayak S.Age-related changes in petal membranes from attached and detached rose flower[J].Plant Physiology,1990,94:1233-1236.
[16] 张圣旺,郑荣生,孟丽,等.牡丹花衰老过程中的生理生化变化[J].山东农业大学学报:自然科学版,2002,33(2):166-169.
