微生物发酵法制备结冷胶的研究进展
2013-08-07吴军林吴清平张菊梅
吴军林,吴清平,张菊梅,张 文
(1.广东省微生物研究所,广东省华南应用微生物重点实验室-省部共建国家重点实验室培育基地;广东省微生物菌种保藏与应用重点实验室,广东省微生物新技术公共实验室,广东广州510070;2.广东环凯微生物科技有限公司,广东广州510643)
结冷胶(gellan gum)是由原称为伊乐假单胞菌(Pseudomonas elodea ATCC 31461),后来基于r-RNA特征及含有鞘氨醇糖脂被进一步确认为少动鞘脂单胞菌(Sphingomonas paucimobilis),又译名少动鞘氨醇单胞菌,经过有氧发酵所产生的细胞外多糖(extraeellular polysaeeharide,EPS)[1]。具有食用安全、用量低、耐酸碱性、适宜的风味释放性、高热稳定性等特性,广泛应用于化妆品、食品、化工等多个领域,是近年来最有发展前景的微生物食用胶。自1978年美国科学家首次发现结冷胶,直到1982年才出现规模化发酵得到结冷胶的报道。日本最早于1988年成功地完成了结冷胶的毒理实验并准许结冷胶在食品中应用,美国食品与药物管理局(FDA)于1992年批准结冷胶作为稳定剂和粘结剂在食品中使用[2]。我国也在1996年批准其作为食品增稠剂、稳定剂使用,并制定了结冷胶的食品安全国家标准GB 25535。结冷胶是一个线性四糖重复单元的长链分子,分子量约为0.5×106u的阴离子型线状聚合物[3]。结冷胶的基本结构如图1所示。图1中n为聚合物的聚合数目,主链由葡萄糖、鼠李糖和葡萄糖醛酸等单糖以2∶1∶1聚合组成,天然结冷胶(高乙酰基结冷胶)和低乙酰基结冷胶在结构上的不同点在于:高乙酰基在每个以β-1-3键连接的葡萄糖分子的C2处被L-甘油酸酯化,C6处被乙酸酯化[4]。目前结冷胶的生产方法主要由微生物发酵法生产,国内外众多学者对结冷胶的生产菌种及发酵工艺条件等方面做了大量研究,其目的是为了提高菌株的生产结冷胶能力,降低生产成本。结冷胶生产菌大都是从自然界分离筛选的原始菌株经物理、化学方法诱变得到。由于诱变的不确定性,高产菌株在产结冷胶的同时,也产生大量的黄色类胡萝卜素,给发酵产品的分离、提纯带来困难,严重制约了发酵法生产结冷胶的工业化生产[5]。近年来,生物工程、基因改良技术突飞猛进,使得结冷胶合成基因簇的基础研究较为透彻,结冷胶基因簇(gel基因簇)中已被识别的结构和序列与已测序的多糖sphingan S-88的合成基因簇(sps基因簇)十分相似,且相对应的基因也有很高的同源性,因此,在分子和基因水平研究少动鞘脂单胞菌发酵产结冷胶的基因调控,对提高结冷胶产量成为可能,本文综述了国内外微生物发酵法制备结冷胶方面的研究进展,以期为结冷胶的研究和开发提供新思路和方向。
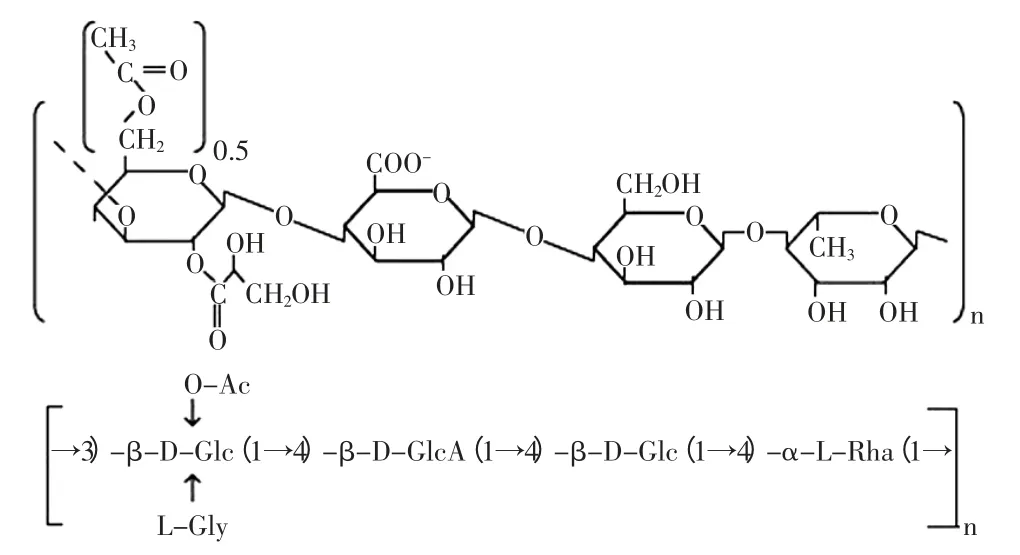
图1 结冷胶的分子结构重复单元Fig.1 Molecular structure of the repeat unit of gellan
1 结冷胶的生物合成
有关结冷胶的合成代谢与调控一直是代谢领域的研究热点。目前以少动鞘脂单胞菌为模式生物的结冷胶生物合成途径是一个多步骤过程,已经阐述清楚,可分为三个连续的步骤:a.胞内糖活化前体的合成;b.四糖重复单元的合成;c.重复单元的移位、聚合及结冷胶分泌到膜外。王霞等[6]对结冷胶的生物合成机理研究报道的比较清晰。
结冷胶的生物合成过程起始于核苷酸糖前体物质:UDP-D-葡萄糖、UDP-D-葡萄糖醛酸、dTDP-L-鼠李糖。合成途径中参与的酶有:Sucrosehydrolase(蔗糖水解酶)、Hexokinase(己糖激酶)、Phosphofructokinase(磷酸果糖激酶)、UGP(UDP-葡萄糖焦磷酸化酶)、TGP(TDP-葡萄糖焦磷酸化酶)、UGD(UDP-葡萄糖脱氢酶)、TRS(TDP-鼠李糖合成酶)。在该途径中,1-磷酸葡萄糖是个关键代谢位点,由它开始代谢途径分为两条,一条合成UDP-D-葡萄糖醛酸;而另外一条途径合成UDP-D-葡萄糖和dTDP-L-鼠李糖。之后,胞内合成的核苷酸前体物质通过与细胞壁内的脂质载体相连接而形成结冷胶多糖的基本单元。细胞质内的一些核糖转移酶将这些多糖片断由细胞内部转移至细胞膜。最后,由细胞膜内的GelS蛋白质协助多糖基本单元跨膜运动,再通过GelC、GelE等蛋白质,将多糖的基本单元合成为具有一定长度的结冷胶多糖重复单元即结冷胶的低聚物,最后通过蛋白质GelC分泌到胞外,形成具有一定聚合度的结冷胶多糖[6-7]。Gai等[1]绘制了少动鞘脂单胞菌ATCC31461染色体基因组序列草图,并从中发现结冷胶生物合成、调控、修饰有关的特征基因,为结冷胶生物合成调控及代谢调控规律研究奠定了基础。
2 结冷胶生产菌种构建
2.1 结冷胶生产菌种的诱变
从生物技术的角度来看,Sphingomonas这一属中的菌株的共同特征是能分泌出如结冷胶、沃仑胶、鼠李胶这样的一类多糖。这些菌株能从多种环境中分离得到,不过Sphingomonas paucimobilis中的多数菌株是从临床样本或医院周边环境中分离到的。结冷胶的生产菌种可以从土壤、空气、水样、动物体组织、植物体中分离获得。工业上最早采用的结冷胶生产菌株为Pseudomonas elodea,它是从一种植物水百合上分离而得的一种好氧的革兰氏阴性菌,端生鞭毛,后确认被为少动鞘氨醇单胞菌(少动鞘脂单胞菌),该菌自1982年首次被发现以来,已广泛应用于结冷胶的工业化发酵生产[2]。近年来,结冷胶的微生物发酵生产越来越引人关注。科研工作者们尝试了通过传统诱变菌种的方法以提高结冷胶的产率。
West等分离出了S.paucimobilis ATCC 31461的突变株,其结冷胶产量较原菌株高约1.4倍,彭志英等利用摇瓶培养分离获得一株少动鞘脂单胞菌Sl,并优化了该菌产胞外多糖的工艺条件,Sl菌胞外多糖的产量最高达8.98g/L,发酵液粘度最高可达45000mPa·s[8]。王姗杰等[9]采用低能N+离子束注入对出发菌Pseudomonas elodea ATCC 31461进行离子照射诱变,确定了合适的诱变条件为离子束照射(10keV,注入剂量为200×1014个N+/cm2,200s),以氨苄青霉素作为抗性筛选药物,经过初筛和复筛得到一株高产结冷胶突变株Pseudomonas elodea A3-5。突变菌株经传代培养,结冷胶产量未出现较大的变化,遗传稳定性较好,突变株形态较出发菌有较大变化,生长速度加快,结冷胶产量达16.5g/L,较出发菌株提高了25%。由此可见,微生物合成结冷胶以氨苄青霉素为药物筛选是一种有效的方法,但对氨苄青霉素抗性与结冷胶产量之间的相关性机制需要进一步的研究。
2.2 改变结冷胶合成途径
基因工程菌的构建一直以来成为提高菌株目的产物的有效手段,由于结冷胶生产过程中糖转化率(40%~50%)较低[5],通过对结冷胶代谢途径的深入了解,Vartak等[10]通过基因工程修饰出发菌株ATCC 31461以增加其合成效率,期盼获得较高的糖转化率。研究者们先从S. elodea细胞内克隆编码葡萄糖-6-磷酸葡萄糖脱氢酶的ZWF基因,部分测序后构建了敲除ZWF基因的工程菌,期望细胞内碳代谢流向结冷胶合成方向,减少在磷酸戊糖途径中因生成大量的CO2而降低转化率,但这种重组并没有显著提高结冷胶的合成效率。Zhu等[11]克隆并鉴定了少动鞘氨醇单胞菌ATCC 31461的类胡萝卜素的生物合成途径中编码八氢番茄红素脱氢酶基因crtI,敲除crtI基因导致黄色类胡萝卜素色素合成受阻,结冷胶的产量与野生型基本相同,但结冷胶回收时所使用的乙醇减少30%,使下游纯化成本显著减少。
2.3 阻断竞争性分支途径
Vartak等[10]发现结冷胶生产菌的最佳发酵条件极易出现C/N比失衡的问题,有利于副产物聚β-羟丁酸(PHB)合成,结冷胶的最佳发酵条件也是副产物PHB合成的最佳条件,因此,发酵过程中结冷胶的合成会与PHB合成竞争碳源。Baird和Cleary通过随机突变,使出发菌株PHB的合成受阻,但没有提高结冷胶的合成效率,可能化学随机诱变在阻断PHB合成的同时,还导致了其他不利突变,因此有学者尝试通过基因敲除的方法阻断PHB的合成途径[12]。Motrison等构建了敲除PHB聚合酶基因(phac)的工程菌种,有效阻断PHB的合成,但此工程菌株产胶能力反而下降[13-14],可能影响工程菌株的生长,需要进一步的深入研究。
2.4 增加结冷胶合成途径中关键酶的表达
随着在结冷胶合成的遗传特性方面取得显著的发展。越来越多的基因工程控制策略已应用于结冷胶的早期合成步骤中。Sá-Correia等[15]在S. elodea ATCC 31461中分别过表达pgmG基因(葡糖磷酸变位酶)和ugpG基因(UDP-葡萄糖焦磷酸化酶),提高了特异性酶的活力,使UDP-葡萄糖合成增加,然而对提高结冷胶的合成并不显著,而同时过度表达pgmG基因和ugdG基因,使结冷胶的产量和ESP粘度增长了20%。将基因工程技术应用于结冷胶的中后期合成步骤中的研究也有报道。Thorne等由Sphingomonas sp. ATCC 21423合成糖活化前体sphingan S-7的基因调控过程中,同时过度表达S-7基因簇的合成基因,包括特异糖基转移酶、重复单元聚合以及聚合物分泌等编码基因,构建成的工程菌的多糖sphingan S-7产量同比增长20%,发酵液的粘度也大大增加[12]。因此对于结冷胶基因工程改造方面还有许多问题需要解决,结冷胶合成及其他糖代谢的关系和调控,仍然需要深入研究。
2.5 其他位点的基因工程改造
Handing等[16]通过EMS化学诱变获得了一株产低酰基结冷胶的突变株LAM-1,破坏菌株合成乙酰基的途径,并通过敲除乙酰基转移酶基因,得到了合成无乙酰基侧链的结冷胶突变株,该工程菌产结冷胶能力没有明显提高,但其合成产物的性质发生了较大的变化。Handing等[17]通过敲除生物合成基因簇中与结冷胶和细胞表面结合相关的酶GeIN或GeIM后,发酵液粘度下降,同时也造成出胶率和强度的下降。推测可能原因是上述基因敲除后,结冷胶更容易受到结冷胶降解酶Ge1R的降解。因此尝试在敲除gelN的基础上,同时敲除结冷胶降解酶基因gelR,所得的结冷胶在较低的粘度下具有更高的强度。
高酰基结冷胶目前主要作为牛奶中的添加剂使用。但是高酰基结冷胶中会残留发酵过程中产生的芳香基硫酸醋酶(arylsulfatase)和β-葡萄糖醛酸酶(β-glucuronidase),影响牛奶的口味。因此Cleary等[18]敲除了这两个酶基因,有效解决了牛奶中添加结冷胶产品影响风味的问题。Wu等[5,19]构建了含透明颤菌血红蛋白VHb基因的工程菌,发现VHb的表达不仅加速了少动鞘氨醇单胞菌的生长,同时也有效地促进了菌株合成结冷胶的能力,VHb的存在改善了细胞对氧气的摄取和利用能力,较有效地缓解了发酵后期低溶氧条件对菌株细胞代谢活性的限制。构建的工程菌株在6.7L小罐发酵48h后,结冷胶产量高达16.82g/L,糖胶转化率达到57.8%,均较原始菌株提高20%。
3 结冷胶发酵生产工艺
影响结冷胶产量的因素有很多,例如培养基的营养成分、发酵条件等。国内外的研究主要集中在培养基配方和工艺条件方面,有研究表明,较高的C/N有利于多糖的合成[15]。关于结冷胶发酵生产的最佳碳源的研究国内外学者得出的结果并不一致。Kanari等[20]发现少动鞘脂单胞菌发酵产结冷胶的最适碳源为葡萄糖、蔗糖以及可溶性淀粉。Ashtaputre和Shah[21]认为蔗糖是用于Sphingomonas paucimobilis-GS1发酵产结冷胶的最佳碳源。Fialho等[22]研究了葡萄糖、乳糖、干酪乳清对Sphingomonas paucimobilis ATCC 31461发酵产结冷胶的影响,发现采用葡萄糖作为最佳碳源时结冷胶产量达到14.59g/L,且利用不同的碳源得到的结冷胶乙酰化程度并不相同。但是,Bajaj等[23]研究结果表明2%可溶性淀粉为最佳碳源,其结冷胶产量可以达到24~28g/L。Banik等[24]研究了利用蔗糖工业上的廉价副产物糖蜜作为碳源来生产结冷胶,并获得了13.8g/L的产量。彭志英等[8]研究发现一葡萄糖或蔗糖为碳源时,菌体及产胶量最好,同时发现碳源添加方式为二步加糖法时更有利于结冷胶发酵生产。
氮源的种类和浓度对结冷胶产量和质量都会产生显著的影响。Dreveton等[25]研究发现有机氮源对菌体的生长和结冷胶的生物合成明显优于无机氮源。Jin等[26]比较了NH4NO3、蛋白胨、大豆油渣对Sphingomonas paucimobilis NK2000发酵产结冷胶的影响,研究发现在没有NH4NO3存在下,使用大豆油渣代替昂贵的蛋白胨作为氮源,结冷胶的产量提高了3倍。Nampoothiri等[8]比较了多种有机氮源和无机氮源对结冷胶发酵的影响,发现蛋白胨为最佳氮源。胡桂萍等[27]研究发现少动鞘脂单胞菌发酵产胶最适氮源为豆饼粉。Bajaj等[23]的研究发现少动鞘氨醇单胞菌在含尿素、NH4NO3等无机氮源的培养基中,菌体长势非常好,但是结冷胶的产量却不高;而利用酵母膏、干酪素、蛋白胨、大豆粉等有机氮源时,虽然菌体的干重有所下降,但是结冷胶的产量却有所提高。
Vanderhoff等[28]利用乙醇加工副产物玉米可溶物(CCS)作为氮源与一定浓度葡萄糖为碳源开发了一种廉价的培养基,结冷胶产量达到12.5g/L,葡萄糖利用率达到90%以上,具有一定的应用前景。
微生物发酵过程中,温度是能够影响结冷胶产量的重要因素之一,结冷胶的发酵温度一般控制在30℃左右[29],也有报道,结冷胶发酵的最适温度为30~31℃,菌体生长的最适温度为31℃,若温度下降到28℃或升高到33℃,生产菌在最适的生长温度下产生的结冷胶要比在其他的温度下的产量提高将近50%[13]。通气量也是一个重要的影响因素,如果能够不断的搅拌发酵液并充分通气,结冷胶的终产物浓度也会相应的增加。一般通过控制搅拌速度和通气量来提高发酵液中氧气浓度[30-31],但当发酵液粘度增加到一定程度时,需要采用能够增加供氧的搅拌系统和结构合适的反应器来提高结冷胶的发酵水平。Arockiasamy和Banik[32]研究了非离子表面活性剂的添加对结冷胶发酵的影响,发现表面活性剂增强氧的传递,在较高的搅拌条件下结冷胶的产量达到27.86g/L。因此,发酵液中溶氧条件直接影响菌株的代谢和生长,发酵体系中具备较好的溶解氧(DO)值,可以显著提高菌株的代谢速率和产量。改善发酵过程中溶氧条件可作为结冷胶发酵生产工艺技术优化的方向。
也有学者对结冷胶的发酵动力学和代谢途径进行了分析,并采用响应面实验设计等方法改进工艺,提高产量。Banik等[33]通过20个影响结冷胶发酵变量的测试,统计分析出糖蜜,蛋白胨,酪蛋白氨基酸,磷酸氢二钠,氯化锰对结冷胶的生产具有显著影响。Arockiasamy 和Banik[32]研究了结冷胶发酵流体力学,通过发酵动力学及胞外多糖流变学特性分析发现,曝气对结冷胶的大规模生产至关重要。徐晓琴等[34]研究了少动鞘脂单胞菌发酵高产结冷胶的发酵过程规律,建立了结冷胶发酵过程中菌体生长、产物积累和基质消耗的数学模型,较好地反映了结冷胶发酵过程中菌体生长、底物消耗和产物合成过程及其动力学机制。Wang等[35]在建立了动力学模型的基础上,使Sphingomonas paucimobilis ATCC 31461结冷胶产量达到17.71g/L,糖胶转换率达到57.12%。
4 展望
结冷胶由于具有的特殊的理化性质及优越的凝胶性能使其具有广泛的应用前景和较高的商业价值。但受其成本的限制,结冷胶的应用受到了极大限制。目前在国内由于结冷胶的研究起步较晚,虽然也有投资生产但生产技术较国外落后,产品质量及产量相对较差。因此降低生产成本,提高结冷胶的质量及产量一直都是结冷胶研究的关键。结冷胶的生物合成途径已基本清晰,但对于其代谢调控规律依然还有许多问题要回答,因此,通过代谢调节基础领域的研究,可以有效指导结冷胶生物合成途径的修饰,调节微生物对结冷胶的生产、增加结冷胶的产量;利用遗传工程和代谢工程对结冷胶代谢途径进行重新设计,如基因打靶、RNAi基因沉默技术阻断结冷胶合成过程中黄色类胡萝卜素色素的生成。结冷胶发酵中后期,发酵液具有高度的粘性,因此降低搅拌的耗能也是一大难题。另外,结冷胶生产菌种退化速度较快也是一个不容忽视的问题,目前关于结冷胶菌种复壮的相关研究还很少,希望会有更多这方面的研究。
[1] Gai Z,Wang X,Zhang X,et al. Genome sequence of Sphingomonas elodea ATCC 31461,a highly productive industrial strain of gellan gum[J]. J Bacteriol,2011,193(24):7015-7016.
[2] Bajaj IB,Survase SA,Saudagar PS,et al. Gellan gum:fermentative production,downstream processing and applications[J]. Food Technol Biotechnol,2007,45(4):341-354.
[3] Freitas F,Alves VD,Reis MA. Advances in bacterial exopolysaccharides:from production to biotechnological applications[J]. Trends Biotechnol,2011,29(8):388-398.
[4] Taylor DL,Ferris CJ,Maniego AR,et al. Characterization of gellan gum by capillary electrophoresis[J]. Aust J Chem,2012,65:1156-1164.
[5] Wu X,Li O,Chen Y,et al. A carotenoid-free mutant strain of Sphingomonas paucimobilis ATCC 31461 for the commercial production of gellan[J]. Carbohydrate Polymers,2011,84(3):1201-1207.
[6] 王霞,袁永,黎盛基,等.结冷胶生物合成机理研究进展[J].中国生物工程杂志,2005,25(11):62-65.
[7] Rocha J,Granja AT,Sá-Correia I,et al. Cloning,expression,purification, crystallization and preliminary crystallographic studies of UgdG, an UDP -glucose dehydrogenase from Sphingomonas elodea ATCC 31461 [J]. Acta Crystallogr Sect F Struct Biol Cryst Commun,2010,66(Pt 1):69-72.
[8] 王琴丹,李柏林,欧杰. 结冷胶的生物合成研究进展[J]. 食品科学,2008,29(10):689-693.
[9] 王姗杰,詹晓北,吴剑荣,等. 低能氮离子注入诱变选育高产结冷胶菌株的研究[J]. 工业微生物,2010(2):20-24.
[10] Vartak NB,Lin CC,Cleary JM,et al. Glucose metabolism in Sphingomonas elodea:pathway engineering via construction of a glucose - 6 - phosphate dehydrogenase insertion mutant[J].Microbiology,1995,141:2339-2350
[11] Zhu L,Wu X,Li O,et al. Cloning and knockout of phytoene desaturase gene in Sphingomonas elodea ATCC 31461 for economic recovery of gellan gum[J]. J Ind Microbiol Biotechnol,2011,38(9):1507-1513.
[12] 黄海东,刘云,刘如林. 合成生物聚合物的重要微生物资源-鞘氨醇单胞菌[J]. 微生物学报,2009,49(5):560-566.
[13] West TP.Effect of temperature on bacterial gellan production[J]. World Journal of Microbiology and Biotechnology,2003,19(6):649-652.
[14] West TP,Fullenkamp NA. Effect of culture medium pH on bacterial gellan production[J]. Microbios,2001,105:133-140.
[15] Fialho AM,Moreira LM,Granja AT,et al. Occurrence,production,and applications of gellan:current state and perspectives[J].Appl Microbiol Biotechnol,2008,79(6):889-900.
[16] Harding NY,Patel YN,McQuown JO. Mutant strain of Sphingomonas elodea which produces non-acetylated gellan gum[P]. US Patent 4352523,2002.
[17] Harding NE,Patel YN,Coleman R. Targeted gene deletions for polysaccharide slime formers[P]. US Patents,2006.
[18] Cleary JM,Coleman RJ,Harding NE,et al. Genetically purified gellan gum[P]. US patent 7361754,2007.
[19] Wu XC,Chen YM,Li YD,et al. Constitutive expression of Vitreoscilla haemoglobin in sphingomonas elodea to improve gellan gum production[J]. Journal of Applied Microbiology,2011,110(2):422-430.
[20] Kanari B,Banik RR,Upadhyay SN. Effect of envirnmental factors and carbohydrateon gellan gum prduction[J].Appl Biochem Biotechnol,2002,102-103(1-6):129-140.
[21] Ashtaputre AA,Shah AK.Studies on a Viscous,Gel-Forming Exopolysaccharide from Sphingomonas paucimobilis GS1[J]. Appl Environ Microbiol,1995,61(3):1159-1162.
[22] Fialho AM,Martins LO,Donval ML,et al. Structures and properties of gellan polymers produced by Sphingomonas paucimobilis ATCC 31461 from lactose compared with those produced from glucose and from cheese whey[J]. Appl Environ Microbiol,1999,65(6):2485-2491.
[23] Bajaj IB,Saudagar PS,Singhal RS,et al. Statistical approach to optimization of fermentative production of gellan gum from Sphingomonas paucimobilis ATCC 31461[J]. J Biosci Bioeng,2006,102(3):150-156.
[24] Banik RM,Santhiagu A,Upadhyay SN. Optimization of nutrients for gellan gum production by Sphingomonas paucimobilis ATCC 31461 in molasses based medium using response surface methodology[J]. Bioresour Technol,2007,98:792-797.
[25] Dreveton E,Frederic M,Jacqueline L,et al. Effect of mixing and mass transfer conditions on gellan production by Auromonaselodea[J]. Ferment Bioerrg,1994,77:642-649.
[26] Jin H,Lee NK,Shin MK,et al. Production of gellan gum by Sphingomonas paucimobilis NK2000 with soybean pomace[J].Biochemical Engineering Journal,2003,16(3):357-360.
[27] 胡桂萍,刘波,朱育菁,等.少动鞘脂单胞菌产结冷胶发酵培养基的响应面法优化[J]. 生物数学学报,2012,27(3):507-517.
[28] Vanderhoff A,Gibbons WR,Bauer N,et al. Development of a low-cost medium for producing gellan from Sphingomonas paucimobius[J]. Journal of Biotech Research,2010(2):67-78.
[29] Kim MK,Lee IY,Ko JH,et al. Higher intracellular levels of uridine monophosphate under nitrogen-limited conditions enhance the metabolic flux of curdlan synthesis in Agrobacterium species[J]. Biotechnol Bioeng,1999,62:317-323.
[30] Giavasis 1,Harvey LM,McNeil B. The effect of agitation and aeration on the synthesis and molecular weight of gellan in batch cultures of Sphingomonas paucimobilis[J]. Enzyme and Microb Technol,2006,38:101- 108.
[31] Banik RM,Santhiagu A. Improvement in production and quality of gellan gum by Sphingomorras paucimobilis under high dissolved oxygen tension levels[J].Biotechnol Lett,2006,28:1347-1350.
[32] Arockiasamy S,Banik RM. Optimization of gellan gum production by Sphingomonas paucimobilis ATCC 31461 with nonionic surfactants using central composite design[J]. J Biosci Bioeng,2008,105(3):204-210.
[33] Banik RM,Santhiagu A,Upadhyay SN. Optimization of nutrients for gellan gum production by Sphingomonas paucimobilis ATCC-31461 in molasses based medium using response surface methodology[J]. Bioresour Technol,2007,98:792-797
[34] 徐晓琴,蒋德宏,黄金,等. 微生物多糖结冷胶的分批发酵动力学模型[J]. 化学工程,2011,39(11):1-5.
[35] Wang X,Xu P,Yuan Y,et al. Modeling for gellan gum production by Sphingomonas paucimobilis ATCC 31461 in a simplified medium[J]. Appl Environ Microbiol,2006,72(5):3367,3374.
