微流控芯片上胰岛素样生长因子1和碱性成纤维细胞生长因子对兔关节软骨细胞增殖的影响
2013-08-02李元城张卫国秦建华林炳承
李元城,张卫国,秦建华,林炳承
微流控芯片上胰岛素样生长因子1和碱性成纤维细胞生长因子对兔关节软骨细胞增殖的影响
李元城,张卫国,秦建华,林炳承
目的在微流控芯片平台上探索三维培养环境下胰岛素样生长因子1(IGF-1)和碱性成纤维细胞生长因子(bFGF)对软骨细胞体外增殖的影响。方法微流控芯片上,分别在IGF-1、bFGF以及二者组合浓度梯度下三维培养兔关节软骨细胞,2周后计算软骨细胞增殖率并与传统的96孔板培养结果进行比较。结果IGF-1在57.14ng/ml产生最大增殖效应,平均倍增2.38倍;bFGF在5.72ng/ml产生最大增殖效应,平均倍增3.85倍;85.71ng/ml IGF-1+1.43ng/ml bFGF的组合可使软骨细胞产生最大的增殖效应,平均倍增4.76倍。微流控芯片与96孔板传统培养的软骨细胞增殖率差异无统计学意义。结论一定浓度组合的IGF-1和bFGF可协同产生最大的增殖效应;微流控芯片技术可用于软骨组织工程领域,具有广阔的应用前景。
软骨细胞;组织工程; 微流控芯片;胰岛素样生长因子1;成纤维细胞生长因子2
关节软骨是一种无血管组织,其结构特点决定了软骨一旦受损便很难自我修复。自体软骨细胞移植技术(autologous cartilage transplant,ACT)首次将组织工程学方法应用到骨科领域,其基本过程为通过关节镜手术收集非负重区软骨组织,体外培养扩增后,再通过手术将软骨细胞回植到软骨缺损处[1-2]。但从患者体内得到的软骨细胞数量有限,且体外扩增时存在软骨细胞表型丢失的现象,从而限制了自体软骨细胞移植在临床上的应用[3]。其中细胞表型丢失考虑与传统的细胞培养方法采用静态的、宏观的培养环境与体内差别过大有关。近年来出现的微流控芯片技术为细胞培养提供了新的方法学支持,它可以模拟人体的微循环系统,持续地提供细胞生长所需的营养物质、氧气等,同时排出细胞代谢产物[4-5]。微流控芯片还可以使多种功能单元在整体可控的微小平台上灵活组合、规模集成,这种集成可以将各种干预因素纳入研究,从而更好地控制细胞行为。本研究在微流控芯片平台上探索三维培养环境下胰岛素样生长因子1(IGF-1)和碱性成纤维细胞生长因子(bFGF)对软骨细胞体外增殖的影响,报告如下。
1 材料与方法
1.1主要材料 健康雄性新西兰大白兔1只,由大连医科大学动物实验中心提供,许可证号SYXK(辽)2008-0002。高糖DMEM、胰蛋白酶购自Hyclone公司;标准胎牛血清购自天津TBD公司;IGF-1、bFGF购自美国Peprotech公司;Ⅱ型胶原酶购自美国Sigma公司;Ⅰ型胶原凝胶购自美国R&D公司;异硫氰酸荧光素标记的右旋糖苷(FITCDextran)购自美国Sigma-Aldrich公司;聚二甲基硅氧烷(PDMS)购自Dow Corning公司。
1.2方法
1.2.1芯片的设计与操作 芯片设计如图1所示,主要由两部分组成:浓度梯度生成器(concentration gradient generator,CGG)和细胞培养单元。CGG的设计原理基于Jeon等[6]的研究。本实验芯片通道的直径为100μm,液体泵入速度为0.1μl/min,流体在微通道中均呈层流特征。通过弯曲的设计使微通道内的多项层流通过流体剪切力混合。流体在微通道网络中分配、混合,即可生成基于多项层流的浓度梯度(图1A、B)。CGG的每个出口连接两个平行的流出通道。在平行的通道之间并联有3个细胞培养微室(每个微室长700μm,宽500μm,高100μm)。每个培养微室连有一个细胞注入口以及细胞注入通道,用于软骨细胞-Ⅰ型胶原混合体的接种。细胞培养微室两侧平行通道内的培养基通过渗透作用进入胶体营养细胞,同时细胞代谢产物通过扩散作用进入两侧通道被排出。另外,由于两侧通道内的细胞因子浓度相同,当它们渗透进入胶体达到饱和后,胶体内细胞因子浓度与两侧通道内细胞因子的浓度相同(图1C)。
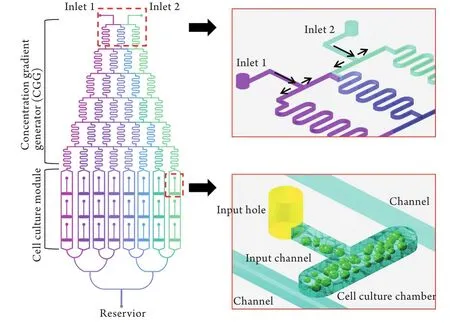
图1 微流控芯片设计Fig. 1 Microfluidic device design
微流控芯片是运用快速成型[7]与软光刻技术[8]由上层的PDMS与底层的玻璃基片构成。外接的两个微泵分别驱动空白培养基和生长因子培养基(浓度为c)通过两个入口注入CGG时,两股液体在通道网络中反复混合、分离、稀释,根据公式计算在CGG的8个出口处,溶液的浓度依次为0、1/7c、2/7c、3/7c、4/7c、5/7c、6/7c和c[9]。每种浓度的液体在相应的两个平行通道中流出并渗透至细胞培养微室中。将芯片放置于37℃、5%CO2孵箱内进行细胞培养,液流速度控制为0.1μl/min。
1.2.2浓度梯度生成器性能考察 IGF-1和bFGF均为大分子物质(分子量分别为7649Da、18 000Da)。为了验证大分子物质在芯片上的浓度梯度生成情况,采用与其分子量相近的FITC-Dextran(分子量20 000Da)进行验证实验。从两个入口以0.1μl/min等速灌注普通培养基和FITC-Dextran染料,荧光染料在CGG中不断被稀释。检测CGG 8个出口处的荧光强度并与理论值进行比较,确定浓度梯度生成的有效性和准确性。
1.2.3软骨细胞培养 自耳缘静脉注射空气处死动物,无菌条件下取双侧肱骨头与股骨头。用手术刀片切取关节表面软骨并剪成1mm×1mm×1mm团块,双抗溶液浸泡30min,吸弃上清液;胰蛋白酶和0.25%Ⅱ型胶原酶消化4h,1000r/min离心10min,弃上清,PBS缓冲液重悬沉淀;200目铜网过滤,再次1000r/min离心10min,弃上清;采用完全培养基重悬沉淀,以5×105/ml密度接种于6cm培养皿,37℃、5%CO2条件下培养。
1.2.4细胞活性及FITC-Dextran在凝胶中的扩散三维环境下培养软骨细胞(即把细胞包埋在凝胶中培养)2周,观察细胞形态以及活性(罗丹明123、碘化丙啶染色)以确定在芯片上培养的可行性。在芯片培养微室内注入Ⅰ型胶原凝胶,然后从上游的两个入口灌入荧光染料(FITC-Dextran),观察其在凝胶中的扩散情况。
1.2.5细胞接种、干预及检测 4℃下将第二代软骨细胞以1×105/ml溶于0.24%Ⅰ型胶原凝胶中并接种于芯片培养微室内(每个微室注入细胞凝胶混合物约0.4μl),37℃孵育1h使胶体凝固。将100ng/ml IGF-1无血清培养基和空白培养基、10ng/ml bFGF无血清培养基和空白培养基、100ng/ml IGF-1无血清培养基和10ng/ml bFGF无血清培养基分别注入到3个芯片中,待稳定产生浓度梯度后计时2周。由于PDMS材料和玻璃基片透明,2周后可以直接在倒置相差显微镜下计数芯片上的软骨细胞数量,计算细胞增殖率。将同批次软骨细胞以相同条件接种于传统的96孔板中培养2周(每孔100μl,每组3个孔),每3d换液1次,2周后利用0.25%胶原酶溶解96孔板中的胶原凝胶,收集悬液并在细胞计数板上计数细胞数量,计算细胞增殖率。
1.3统计学处理 采用SPSS 14.0软件进行统计分析。多组间比较采用单因素多变量χ2检验,进一步两两比较采用LSD Post-hoc检验。微流控芯片与传统的96孔板培养的细胞增殖率比较采用两样本均数t检验。P<0.05为差异有统计学意义。
2 结 果
2.1浓度梯度生成器的性能考察 在芯片分支处,普通培养基与荧光染料起初保持层流状态,但进入弯曲的通道后,两种液体通过剪切力不断混合直至均匀。CGG的8个出口中,从出口1到出口8荧光强度逐渐增强。CGG 8个出口的荧光强度与理论值比较,相关系数r=0.9953(图2)。
2.2细胞形态及活性检测结果 细胞培养平板中二维培养软骨细胞,36h后细胞伸出伪足呈多角形(图3A)。芯片培养微室内,三维培养软骨细胞36h后细胞呈球形(图3B),与软骨细胞在体内的存在方式相同[10]。芯片上三维培养软骨细胞2周后,采用罗丹明123和碘化丙碇测定细胞活性,罗丹明采用488nm激光激发,碘化丙啶采用543nm激光激发,2min后共聚焦显微镜下观察红绿两色荧光并拍照。每个细胞微室接种的软骨细胞数量为100个左右,其中碘化丙啶红染的死亡细胞只有1~2个,表明芯片上三维培养的软骨细胞活性≥95%(图3C)。

图2 CGG性能考察Fig. 2 CGG performance validation
2.3FITC-Dextran在Ⅰ型胶原凝胶中的渗透情况FITC-Dextran随着时间推移通过渗透进入凝胶,凝胶中的荧光强度随之增强直至平衡。
2.4三维环境下IGF-1、bFGF以及二者组合作用下软骨细胞的增殖情况 胶原凝胶中的软骨细胞在生长因子作用下,2周后仍保持球形外观。在0~57.14ng/ml范围内,IGF-1可促进软骨细胞增殖且呈剂量相关性,并于57.14ng/ml达到最大效应(平均倍增2.38倍)。IGF-1在57.14~100ng/ml范围内各组增殖率无明显差异(P>0.05)。在0~5.72ng/ ml范围内,bFGF可促进软骨细胞增殖且呈剂量相关性,并于5.72ng/ml达到最大效应(平均倍增3.85倍);随着bFGF浓度继续增加,细胞增殖率呈下降趋势。IGF-1和bFGF组合的8个浓度(ng/ml)依次为0/10、14.28/8.58、28.57/7.15、42.86/5.72、51.15/4.29、71.43/2.86、85.71/1.43、100/0,其中85.71ng/ml IGF-1+1.43ng/ml bFGF的组合可使软骨细胞产生最大的增殖效应(平均倍增4.76倍),与其他各组合比较差异均有统计学意义(P<0.01,图4)。微流控芯片与96孔板培养的软骨细胞增殖率比较差异均无统计学意义(P>0.05)。
3 讨 论
微流控芯片技术又称微流控芯片实验室(labon-a-chip),指的是在一块几平方厘米的芯片上构建的化学或生物实验室。它把化学和生物等领域中涉及的样品制备、反应、分离、检测、细胞培养、分选、裂解等基本操作单元集成到一块很小的芯片上,由微通道形成网络,以可控流体贯穿整个系统,用以实现常规化学或生物实验室的各种功能。
本次实验中应用浓度梯度生成器可以准确快捷地在30s内将生长因子稀释成8个浓度,并且可以通过改变生长因子的种类和浓度轻易改变实验条件。另外芯片上集成的24个培养微室实现了软骨细胞的自动化培养。实验表明软骨细胞在芯片上具有良好的适应性,2周后细胞存活率≥95%。PDMS材料用于细胞培养的可行性已得到广泛证实[11-12],其主要特点为生物相容性好、无毒、高氧气通透率及视觉透明性。
传统实验中,细胞处于一种静止的培养环境中,培养基的更换是通过人工定期排除然后加入新鲜培养基。这种方式不仅增加了污染机会,而且造成了一种不稳定的培养环境。在以灌注-扩散为基础的微流控培养体系中,当培养基流经两个平行通道时,生长因子等营养物质可持续地渗透到胶体中,同时细胞代谢产物通过渗透被排出。这样的设计充分模拟了体内的物质能量交换方式,不但减少了人工操作及潜在的污染,且为细胞提供了一个持续稳定的环境。
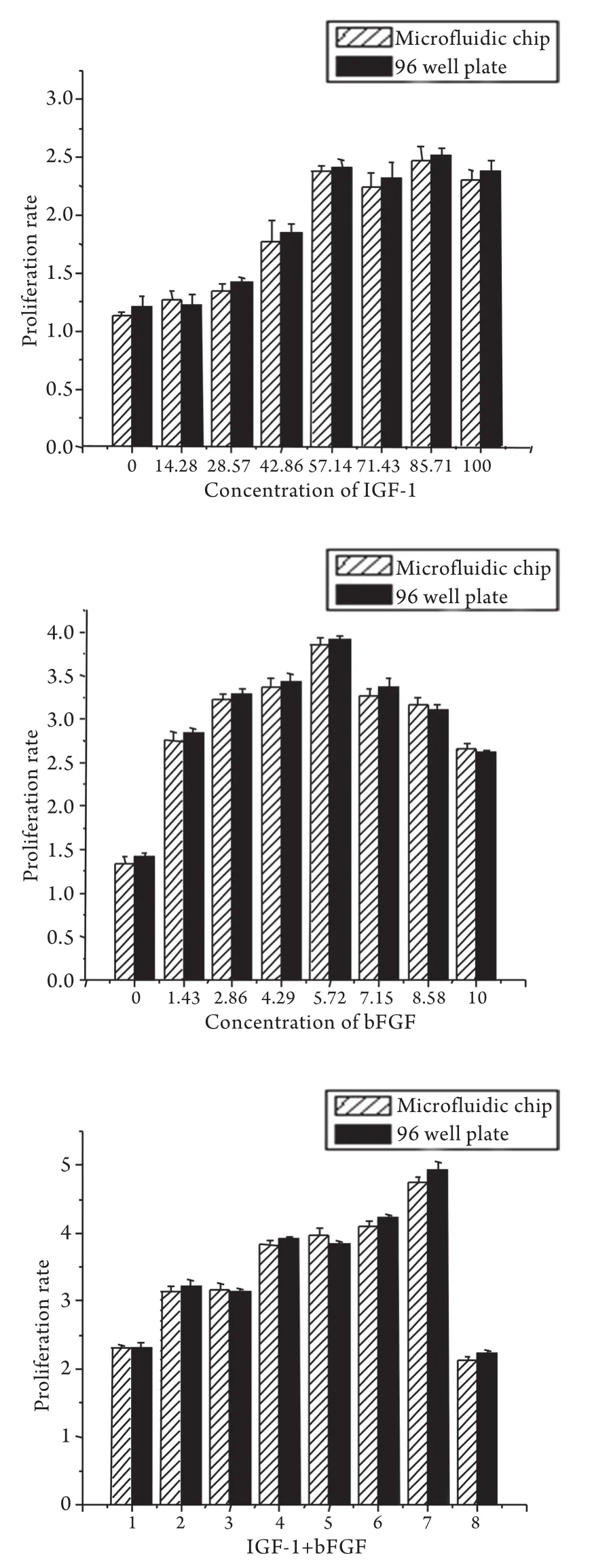
图4 微流控芯片IGF-1、bFGF以及二者组合作用下的软骨细胞增殖情况Fig. 4 Chondrocyte proliferation presented in IGF-1, bFGF and their combinations
微流控芯片操作简便、省时省力,明显降低了耗材试剂的成本。本次实验中,培养基的消耗小于5ml,IGF-1和bFGF的消耗小于200ng。在软骨细胞自体移植时,由于不同个体、年龄、疾病以及不同层面上软骨细胞的体外培养条件是特异的,大量提取软骨细胞来摸索其最佳培养条件不现实,而微流控芯片技术对细胞数量要求极少(1~100个),可平行进行多种实验,因此在自体软骨细胞移植领域具有独特的优势。
在自体软骨细胞移植中,我们可以根据需要设计更为精密的微流控芯片,将多种生长因子、三维环境以及生物力学刺激高度集成,并利用有限的软骨细胞摸索出“菜单”式的培养方案。这种方案完全是个性化的,能满足不同来源软骨细胞的要求且提高了种子细胞的质量,使软骨组织工程产业化成为可能。
[1]Roberts S, McCall IW, Darby AJ, et al. Autologous chondrocyte implantation for cartilage repair: monitoring its success by magnetic resonance imaging and histology[J]. Arthritis Res Ther, 2003, 5(1): R60-R73.
[2]Freed LE, Grande DA, Lingbin Z, et al. Joint resurfacing using allograft chondrocytes and synthetic biodegradable polymer scaffolds[J]. J Biomed Mater Res, 1994, 28(8): 891-899.
[3]Barbero A, Grogan S, Schafer D, et al. Age related changes in human articular chondrocyte yield, proliferation and postexpansion chondrogenic capacity[J]. Osteoarthritis Cartilage, 2004, 12(6): 476-484.
[4]Sittinger M, Schultz O, Keyszer G, et al. Artificial tissues in perfusion culture[J]. Int J Artif Organs, 1997, 20(1): 57-62.
[5]Wu MH, Urban JPG, Cui Z, et al. Development of PDMS microbioreactor with well-defined and homogenous culture environment for chondrocyte 3-D culture[J]. Biomed Microdevices, 2006, 8(4): 331-336.
[6]Jeon NL, Dertinger SKW, Chiu DT, et al. Generation of solution and surface gradients using microfluidic systems[J]. Langmuir, 2000, 16(22): 8311-8314.
[7]McDonald JC, Duffy DC, Anderson JR, et al. Fabrication of microfluidic systems in poly(dimethylsiloxane)[J]. Electrophoresis, 2000, 21(1): 27-40.
[8]Xia Y. Soft lithography and the art of patterning - A tribute to professor George M. Whitesides[J]. Adv Mater, 2004, 16(15): 1245-1251.
[9]Stephan KW, Dertinger, Daniel T, et al. Generation of gradients having complex shapes using microfluidic networks[J]. Anal Chem, 2001, 73(6): 1240-1246.
[10]Masahiko M, Mitsuo O, Yuji U, et al. Effects of basic fibroblast growth factor on proliferation and phenotype expression of chondrocytes embedded in collagen gel[J]. Gen Pharmac, 1998, 31(5): 759-764.
[11]Lee JN, Jiang X, Ryan D, et al. Compatibility of mammalian cells on surfaces of poly(dimethylsiloxane)[J]. Langmuir, 2004, 20(26): 11684-11691.
[12]Charati SG, Stern SA. Diffusion of gases in silicone polymers: Molecular dynamics simulations[J]. Macromolecules, 1998, 31(16): 5529-5538.
Effects of insulin-like growth factor-1 (IGF-1) and basic fibroblast growth factor (bFGF) on the proliferation of rabbit articular chondrocytes embedded in microfluidic chip
LI Yuan-cheng1, ZHANG Wei-guo1*, QIN Jian-hua2, LIN Bing-cheng2
1Department of Orthopedics, First Affiliated Hospital of Dalian Medical University, Dalian, Liaoning 116001, China
2Department of Biotechnology, Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian, Liaoning 116001, China
*
, E-mail: zhxiao_2004@yahoo.com.cn
ObjectiveTo investigate the effects of insulin-like growth factor-1 (IGF-1) and basic fibroblast growth factor (bFGF) on the proliferation of chondrocytes in a 3-dimensional (3D) culture environment of microfluidic chip. Method Rabbit articular chondrocytes embedded in microfluidic chip and 96-well plate were cultured with solitary and component concentrations of IGF-1 and bFGF for 2 weeks, and then the proliferation rates of chondrocytes were calculated and compared. Results The maximal proliferation effect of IGF-1 was found when the concentration reached 57.14ng/ml (up to 2.38-fold), and of bFGF at the concentration of 5.72ng/ml (up to 3.85-fold), while the maximal proliferation effect of combination of IGF-1+bFGF was found at the concentration of 85.71ng/ml IGF-1 plus 1.43ng/ml bFGF (up to 4.76-fold). There was no significant difference between the proliferation rate of chondrocytes cultured in microfluidic chip and 96-well plate. Conclusions A combination of IGF-1 plus bFGF in certain concentration may synergistically increase the proliferation of chondrocytes. Microfluidic chip could be used for efficient cartilage tissue engineering.
chondrocytes; tissue engineering; microfluidic chip; insulin-like growth factor i; fibroblast growth factor 2
R394.26
A
0577-7402(2013)06-0476-05
2013-01-14;
2013-05-08)
(责任编辑:胡全兵)
李元城,医学博士,主治医师。主要从事骨与关节损伤方面的基础与临床研究
116001 辽宁大连 大连医科大学附属第一医院骨科(李元城、张卫国);116001 辽宁大连 中国科学院大连化学物理研究所(秦建华、林炳承)
张卫国,E-mail:zhxiao_2004@yahoo.com.cn
