2 型糖尿病一级亲属血清leptin、TNF-α、IL-6 表达与胰岛素抵抗的相关性研究
2013-07-29李秀丽章琳梁春联李妙羡
李秀丽 章琳 梁春联 李妙羡
2 型糖尿病(T2DM)发病机制关键是进行性的胰岛B 细胞功能障碍及胰岛素抵抗[1]。近年来认为糖尿病的发展过程是一种慢性炎症过程,炎症反应在糖尿病的发生、发展及并发症的发病机制中起到重要作用,炎症因子在此发病机制中起媒介作用[2],并可以预测糖尿病的发生[3],本研究旨在探讨T2DM 家系正常糖耐量一级亲属胰岛素抵抗与瘦素(leptin)、肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)的相关性,为预防和治疗糖尿病提供科学的临床依据。
1 对象及方法
1.1 研究对象 所有研究对象来源于我院的门诊及住院病人中新诊断的T2DM 病人及其一级亲属,所有研究对象均无明显器质性病变,如心、肝、肾疾病、高血压及肿瘤,无使用影响糖脂代谢的药物史。按WHO 1999 年T2DM 的诊断标准;糖耐量正常的诊断标准:进行口服75 g 葡萄糖耐量试验(OGTT),空腹血糖(FBG)<6.1 mmol/L,餐后2 h 血糖<7.8 mmol/L。将研究对象分为3 组:(1)T2DM 组(134例):T2DM 患者,且其家族中有血缘关系的T2DM 患者≥2 人,其中男82 例,女52 例,年龄39 ~75 岁,平均(57.06 ± 12.22)岁;(2)一级亲属糖耐量正常(NFDR)组(128 例):为T2DM 组一级亲属中糖耐量正常者,其中男74 例,女54 例,年龄31 ~69 岁,平均(40.53 ±13.48)岁;(3)正常对照(NC)组(120例):来源于我院健康体检中心,与T2DM 患者无血缘关系,且经OGTT 排除糖尿病、空腹血糖受损(IFG)及糖耐量减低(IGT)者,其中男65 例,女55例,年龄30 ~70 岁,平均(41.06 ±13.40)岁。每组按体质量指数(BMI)再分为2 个小组,即肥胖(BMI≥25)组和非肥胖(BMI <25)组。
1.2 方法
1.2.1 生化指标测定:所用研究对象禁食12 h,晨起空腹测FBG、胰岛素(FINS)、三酰甘油(TG)、总胆固
醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C),并分离出血清,-70 ℃冰箱保存。口服75g 葡萄糖,行OGTT 检查,血糖测定采用葡萄糖氧化酶法,胰岛素测定采用放免法,血脂测定采用酶法,胰岛素抵抗指数(IR)用HOMA 法计算=(FINS ×FBG/22.5)。所有研究对象测量身高、体质量、腰围、臀围。计算BMI 和腰臀比。
1.2.2 leptin、TNF-α、IL-6 水平测定:采用ELISA 法,试剂盒购自上海森雄科技有限公司。
1.2.3 统计学处理:采用SPSS11.0 软件进行统计学处理,计量资料均值以(±s)表示,经正态检验后发现leptin、TNF-α、IL-6、HOMA-IR 不呈正态分布,故采用经自然对数转换后再进行统计分析,3 组之间指标比较采用协方差分析,校正年龄、BMI 协变量,相关分析采用多元线性逐步回归分析,均以P <0.05 为差异具有统计学意义。
2 结果
2.1 各组基本资料比较 T2DM 组年龄、BMI 较NFDR 及NC 组大,差异有统计学意义(P <0.05);以年龄和BMI 作协变量,对3 组年龄和BMI 进行校正后,腰围、腰臀比、FINS 在T2DM、NFDR、NC 组差异无统计学意义(P >0.05);FBG 及HOMA-IR 在T2DM、NFDR、NC 组中依次减少,且3 组差异有统计学意义(P <0.05)。见表1。
表1 T2DM 组、NFDR 组、NC 组临床指标比较(±s)

表1 T2DM 组、NFDR 组、NC 组临床指标比较(±s)
注:与NC 组比较,* P <0.05;与NFDR 组比较,△P <0.05
组别nBMI年龄(岁)腰围(cm) 臀围(cm) 腰臀比FBG(mmol/L) FINS(mU/L)HOMA-IR T2DM 组134 24.98 ±2.21 57.06 ±12.22*△91.06 ±8.19 93.49 ±9.36 0.88 ±0.10 8.76 ±3.14*△15.33 ±9.41 5.71 ±3.01*△NFDR 组128 22.38 ±4.22 40.53 ±13.4885.24 ±11.30 92.35 ±9.21 0.84 ±0.09 5.20 ±0.93* 19.20 ±29.15 4.22 ±2.78*NC 组 120 23.33 ±3.11 41.06 ±13.4086.51 ±8.13 89.42 ±8.94 0.82 ±0.08 4.69 ±0.9213.18 ±5.72 3.12 ±0.79
2.2 3 组血脂比较 校正年龄和BMI 协变量后,TG在NC、NFDR、T2DM 组中差异有统计学意义(P <0.05);T2DM、NFDR 组HDL-C 较NC 组明显降低,差异有统计学意义(P <0.05);TC、LDL-C 各组间差异无统计学意义(P >0.05)。见表2。
表2 3 组血脂水平比较(±s)

表2 3 组血脂水平比较(±s)
注:与NC 组比较,* P <0.05;与NFDR 组比较,△P <0.05
组别nTC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)T2DM 组1345.40 ±1.181.88 ±1.31*△1.17 ±0.15*3.23 ±1.24 NFDR 组1284.86 ±1.121.60 ±0.85*1.26 ±0.34*2.88 ±1.12 NC 组1204.69 ±1.041.29 ±0.481.39 ±0.552.82 ±0.95
2.3 3 组leptin、TNF-α、IL-6 比较 校正年龄和BMI,leptin、TNF-α、IL-6 在3 组中差异有统计学意义(P <0.05)。见表3。
表3 3 组leptin、TNF-α、IL-6 水平比较(±s)
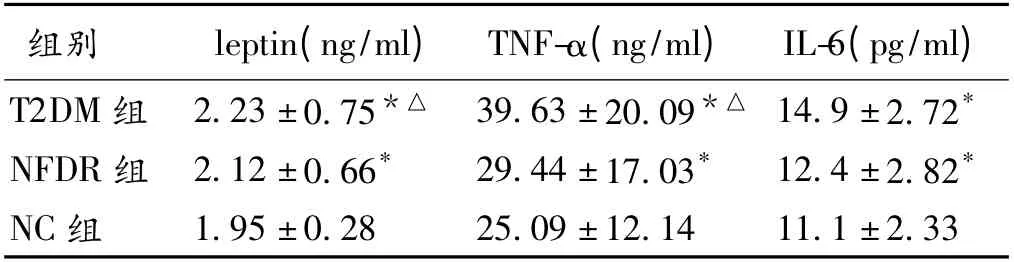
表3 3 组leptin、TNF-α、IL-6 水平比较(±s)
注:与NC 组比较,* P <0.05;与NFDR 组比较,△P <0.05
组别leptin(ng/ml) TNF-α(ng/ml) IL-6(pg/ml)T2DM 组 2.23 ±0.75*△ 39.63 ±20.09*△ 14.9 ±2.72*NFDR 组 2.12 ±0.66*29.44 ±17.03*12.4 ±2.82*NC 组1.95 ±0.2825.09 ±12.1411.1 ±2.33
2.4 按照BMI 分层后leptin、TNF-α、IL-6 水平比较T2DM、NFDR、NC 3 组中肥胖组leptin、TNF-α、IL-6 高于非肥胖组,差异有统计学意义(P <0.05)。T2DM组中肥胖组leptin、TNF-α、IL-6 高于NFDR、NC 组中肥胖组,差异有统计学意义(P <0.05)。NFDR 组中肥胖组leptin、TNF-α、IL-6 高于NC 组中肥胖组,差异有统计学意义(P <0.05)。而各非肥胖组间差异无统计学意义(P >0.05)。见表4。
表4 3 组按照BMI 分层后leptin、TNF-α、IL-6 水平比较(±s)
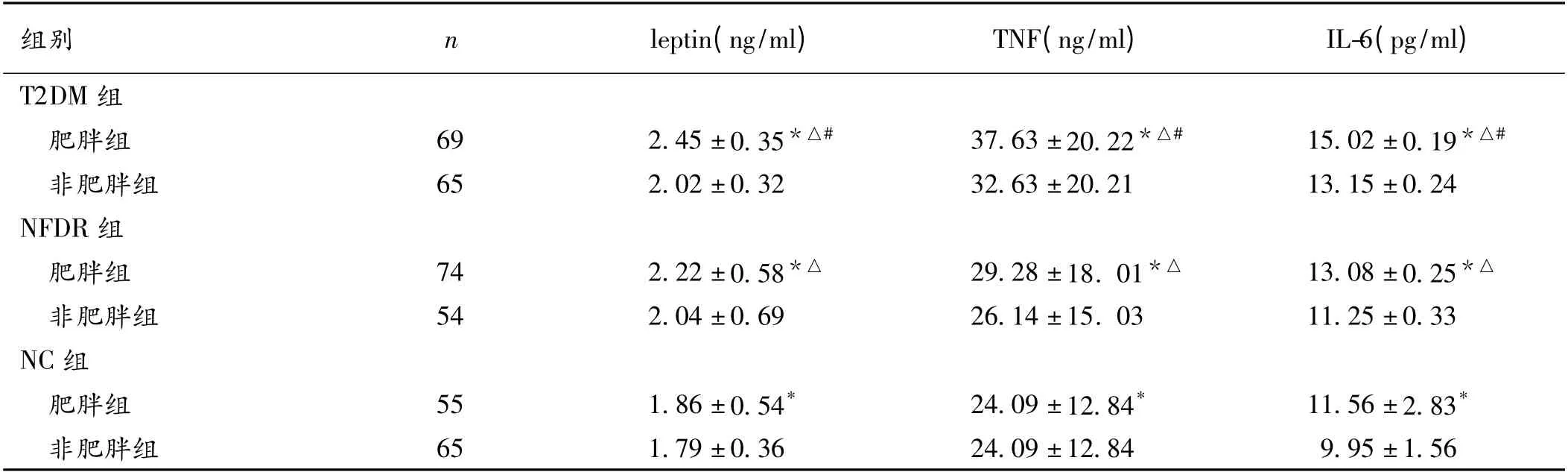
表4 3 组按照BMI 分层后leptin、TNF-α、IL-6 水平比较(±s)
注:与非肥胖组比较,* P <0.05;与NC 组比较,△P <0.05;与NFDR 组比较,#P <0.05
组别nleptin(ng/ml)TNF(ng/ml)IL-6(pg/ml)T2DM 组肥胖组692.45 ±0.35*△#37.63 ±20.22*△#15.02 ±0.19*△#非肥胖组652.02 ±0.3232.63 ±20.2113.15 ±0.24 NFDR 组肥胖组742.22 ±0.58*△29.28 ±18. 01*△13.08 ±0.25*△非肥胖组542.04 ±0.6926.14 ±15. 0311.25 ±0.33 NC 组肥胖组551.86 ±0.54*24.09 ±12.84*11.56 ±2.83*非肥胖组651.79 ±0.3624.09 ±12.849.95 ±1.56
2.5 NFDR 组IR 影响因素的多元线性逐步回归分析以HOMA-IR 为应变量,年龄、性别、BMI、腰臀比、leptin、TNF-α、IL-6 为自变量,对NFDR 组进行多元线性逐步回归分析,进入方程的因素为BMI、TG、leptin、TNF-α、IL-6,且与BMI、TG、leptin、TNF-α、IL-6 呈正相关(β 分别为0.235、0.342、0.324、0.310、0.165,P <0.05)。
3 讨论
T2DM 正常糖耐量一级亲属是糖尿病的高危人群,与T2DM 人群具有相似的遗传背景,是研究T2DM发病机制的最佳人选[4]。HOMA 模型在例数较大情况时可以很好评价胰岛素抵抗[5],本研究采用HOMAIR 评价T2DM 家系中一级亲属的胰岛素抵抗。由于糖尿病具有家族聚集性,且随年龄增大,发病率高。本研究中NFDR 组及NC 组年龄较T2DM 组低,在相关数据处理中采用以年龄为协变量的协方差分析,扣除年龄因素的影响。
本研究显示NC、NFDR、T2DM 组的HOMA-IR、TG依次增高;T2DM、NFDR 组HDL-C 较NC 组差异有统计学意义,即T2DM 正常糖耐量一级亲属存在胰岛素抵抗及脂代谢异常,和我们既往的研究一致[6-7]。
近年来炎症反应在2 型糖尿病病因和发病机制中的作用受到广泛关注,leptin、TNF-α、IL-6 是3 种慢性炎症因子。leptin 是由脂肪组织分泌的一种激素,能降低食欲,减轻肥胖,抑制胰岛素分泌,并调整胰岛素在外周的敏感性[8],血清leptin 升高可出现体内氧化应激增强,促炎症反应,体内炎症因子增多,加重胰岛素抵抗。TNF-α 是单核巨噬细胞及脂肪细胞分泌的一种细胞因子,可干扰周围组织胰岛素作用引起胰岛素抵抗,肥胖者TNF-α 在脂肪组织中的mRNA 和蛋白质水平、循环浓度均有所增加,造成脂肪组织尤其是内脏脂肪组织的胰岛素抵抗,使脂肪分解增多,引发包括肝脏及肌肉在内的大范围胰岛素抵抗。其可能机制为:(1)降低葡萄糖运载体4(Glut4)表达及葡萄糖运载体3 (Glut3)蛋白总量,而降低了胰岛素介导的葡萄糖摄取,引起周围组织尤其脂肪组织的胰岛素抵抗。(2)抑制参与胰岛素介导的葡萄糖摄取的2 个组织(肌肉、脂肪)中胰岛素受体酪氨酸激酶的活性,参与了与肥胖相关的胰岛素抵抗。(3)可致高脂血症,血清TG、极低密度脂蛋白和游离脂肪酸升高,从而诱导胰岛素抵抗。(4)通过对其他激素的影响而诱导胰岛素抵抗。IL-6 是具有内分泌特性的细胞因子,引起胰岛素抵抗的可能机制:(1)与leptin 竞争STAT 结合位点,发生leptin 抵抗,对胰岛素分泌抑制作用减弱,出现高胰岛素血症,产生胰岛素抵抗。(2)降低Glut4 表达,而降低了胰岛素介导的葡萄糖摄取,引起周围组织尤其脂肪组织的胰岛素抵抗。以上3 种因子均可引起胰岛素抵抗,推测在糖尿病发生前已产生作用,参与了糖尿病的发生、发展机制。
本研究显示leptin、TNF-α、IL-6 在T2DM、NFDR、NC 组中依次下降,T2DM、NFDR、NC 组肥胖组leptin、TNF-α、IL-6 高于非肥胖组,T2DM 正常糖耐量一级亲属HOMA-IR 与BMI、TG、leptin、TNF-α、IL-6 呈正相关。提示leptin、TNF-α、IL-6 异常出现在T2DM 发生之前,可能参与胰岛素抵抗及糖尿病的发生,且在肥胖个体中更明显。这与既往国内研究相似[9-10]。那么在正常糖耐量一级亲属的肥胖人群、高脂血症人群除生活干预预防糖尿病外,应重视尽早给予抗炎(如降脂药、阿司匹林等)治疗,改善胰岛素抵抗,减少或延缓T2DM 的发生。
[1] 李娜,李显文,李思成,等.患糖尿病的代谢综合征患者血清抵抗素水平的研究[J]. 中国现代医学杂志,2009,19(8):1249-1252.
[2] Li ZZ,Liu JB,Li L,et al. Intensive therapy for diabetes through influence on innate immune system[J]. Med Hypotheses,2009,72(6):675-676.
[3] Bertoni AG,Burke GL,Owusu JA,et al. Inflammation and the incidence of type 2 diabetes:the MuIti-Ethnic Study of Atherosclerosis(MESA)[J].Diabetes Care,2010,33(4):804-810.
[4] Rosenba UM,Nonas C,Horlick M,et al. Beta-cell function and insulin sensitivity in early adolescence:association with body fatness and family history of type 2 diabetes mellitus[J].Clin Endocrinol Metab,2004,89(11):5469-5476.
[5] 李小平,袁国华,高兴玉,等.糖耐量减低患者血清抵抗素和脂联素水平的变化[J]. 中华高血压杂志,2011,19(2):179-181.
[6] 李秀丽,章琳,王妮,等.糖耐量正常的2 型糖尿病一级亲属血脂分析[J].陕西医学杂志,2007,36(1):105-107.
[7] 荆爱玉,李秀丽,谢璇,等.2 型糖尿病一级亲属正常糖代谢人群胰岛素抵抗分析[J]. 西安医科大学学报:医学版,2008,29(5):545-548.
[8] Ahima RS,Qi Y,Singhal NS. Adipokines that link obesity and diabetes to the hypothalamus[J].Prog Brain Res,2006,153:155-174.
[9] 任艳,李秀钧,田浩明,等.2 型糖尿病家系正常糖耐量一级亲属血清瘦素、肿瘤坏死因子-α、神经肽Y 水平与胰岛素抵抗、β 细胞分泌功能相关性的研究[J]. 生物医学工程杂志,2010,27(6):1341-1345.
[10]高珊,黎明,陆菊明,等.2 型糖尿病一级亲属血清脂联素、瘦素及其比值与胰岛素抵抗的相关性研究[J].中国糖尿病杂志,2007,15(3):149-153.
