大蒜茎盘不定芽离体培养的研究
2013-07-26王云云徐浩然宋淑敏
王云云,高 宇,肖 宇,孙 力,徐浩然,聂 迪,张 兴,宋淑敏
(黑龙江省科学院大庆分院,黑龙江大庆 163319)
大蒜(Allium sativum L.)栽培历史悠久,是一种药、菜兼用的世界性蔬菜。大蒜主要靠鳞茎进行无性繁殖。大蒜在长期无性繁殖过程中,易感染多种病毒,造成种性退化。利用组织培养技术进行大蒜脱毒种苗繁育,不仅能脱除病毒,还可以提高大蒜繁殖效率,改进繁殖方法,提高鳞茎产量和品质。利用组织培养技术脱除大蒜病毒有两种途径:器官发生途径和体细胞胚胎发生途径[1]。其中器官发生途径已有大量研究,目前已建立了以茎尖、根尖[2]、真叶、贮藏叶、茎盘切块、花序轴顶端分生组织[3]、花药和花原始体[4]等为外植体的多种大蒜组织培养再生体系。茎尖分生组织研究最多,从培养基的筛选到移栽驯化以及工厂化生产具有研究,但其增殖系数一般在3~5[5,6],并且试验操作要求较高,培养难度大,需要较多的人力物力,使得其规模化生产受到限制。继而更多的研究转向提高增殖率和保障脱毒率的研究中。熊正琴[7],以花序轴为外植体,采用直接成苗途径,研究了花序轴培养条件,结果表明,取未熟花茎的花序轴为外植体,其繁殖系数可高达76;王洪隆[8]取生殖期大蒜花梗,通过愈伤组织间接诱导丛生芽获得大量的再生植株。唐巧玲[9]以国内4个大蒜栽培品种为材料,建立了以根为外植体的再生体系。马雯[10],以茎尖分生组织培养结合热处理的方法脱除大蒜病毒,建立大蒜茎尖脱毒培养体系,并以新鲜的或低温贮藏的蒜薹为外植体,研究了贮藏时间和植物生长激素对花苞培养诱导形成气生鳞茎的影响,以及气生鳞茎大小、处理温度和植物激素配比对气生鳞茎的萌发率的影响,建立了茎尖脱毒培养体系和大蒜花苞诱导形成气生鳞茎的技术条件。曾建军[11]以大蒜茎盘为外植体进行脱毒快繁,获得芽诱导培养基和生根培养基。张素芝[12]研究了植物激素对大蒜茎盘组织培养指出,高浓度生长素有利于大蒜愈伤组织诱导,但不利于分化,通过茎盘培养的增殖系数可达到7.5,但继代次数的增加严重影响了染色体变异率。龙玉娟[13]以大蒜品种‘三月黄’花序轴为外植体进行离体培养,对其器官发生过程进行了形态学和解剖学观察;以‘二水早蒜’、‘徐州白蒜’和‘金乡大蒜’4个品种大蒜的胚性与非胚性愈伤组织为材料,进行了形态学及解剖学的观察,并通过器官直接发生、愈伤组织和体胚发生3种再生方式,对4个品种大蒜的再生试管苗及试管鳞茎形成过程及植株生长发育进行了比较。结果表明,大蒜花序轴离体培养不经过愈伤组织,通过器官直接发生途径形成不定芽,其不定芽起源于大蒜花序轴维管组织韧皮部一侧周围的皮层薄壁细胞,属于外起源,不定芽通过壮苗、生根培养可正常生根形成植株,如果转接培养周期超过21d,鳞茎形成率可达90.56%。大蒜胚性愈伤组织表面光滑且有易分散的椭圆形颗粒,拥有多个连续分生中心;而非胚性愈伤组织表面有瘤状突起,没有多个连续的分生中心。愈伤组织途径和体胚途径的增殖系数较高,达9.27~20.11;器官直接发生途径的试管鳞茎形成率较高,为20.11% ~43.55%;愈伤组织途径和体胚途径的试管鳞茎形成率在15%以下。张恩让[14]在大蒜芽直接再生途径和愈伤组织途径再生植株的过程中体细胞无性系变异的发生规律的研究中指出,大蒜体细胞无性系变异主要发生在愈伤组织形成阶段和愈伤组织继代增殖过程中。供试的5个品种茎尖生长点直接生芽培养时,由于没有经历愈伤组织阶段,所以,在再生植株中,几乎没有检测到染色体变异发生;而经历愈伤组织诱导培养,再分化形成的再生植株均出现了高频率的染色体变异,且染色体变异频率随着培养时间的延长而增加,说明变异是在愈伤组织培养过程中依次出现并累加的。孟新亚[15]以中牟5号大蒜根尖为外植体,筛选出愈伤诱导培养基和胚性愈伤诱导培养基,获得胚性愈伤悬浮系的培养条件。梁艳[16]对不同蔗糖浓度对阿城紫皮大蒜试管微鳞茎的形成和膨大的影响进行研究,结果表明,随着蔗糖浓度的提高,大蒜试管微鳞茎形成被促进,而鳞茎发生数呈下降趋势。栾非时在1995年[17],以黑龙江省阿城脱毒紫皮种蒜为试材,应用植物组织培养技术,探讨利用花原始体进行培养增殖的技术,其繁殖系数为3.1848,并且经幼苗根尖染色体压片、镜检,未发现有任何染色体变异。
综上所述,通过茎尖分生组织直接诱导出芽的途径,成苗速度较快,变异率低,有利于保持品种种性,脱毒率较高,但增殖系数小,操作要求高,不利于工厂化生产;而通过诱导愈伤组织再生途径,增殖系数高,但染色体变异率大,不利于保持品种种性;而体细胞胚再生途径,增殖率高,但其鳞茎形成率低。因此,仍需探寻一种高增殖率,高脱毒率,低变异率,短繁殖周期的高效大蒜脱毒快繁的技术体系。
M.Ayabe[18,19]在利用大蒜茎盘脱毒的研究中指出,在茎盘培养过程中,茎盘表面会形成圆形突起,组织观察发现,这些圆形突起在内部细胞组织和结构形成过程与大蒜蒜瓣芽尖形成过程相似,同时,在不定芽幼芽阶段(<1mm)是脱毒的。因此,本项目以茎盘诱导出的不定芽为外植体进行快繁,以我国北方主栽大蒜品种为试验材料,解决我国北方省份大蒜快繁中增殖系数低,操作难度大等影响大蒜快繁产业化的技术瓶颈,为大蒜脱毒快繁的规模化生产提供技术基础。
1 试验材料
阿城大蒜,从哈尔滨市阿城区购买的当年新蒜。
2 试验内容与方法
2.1 试验材料的处理
将阿城大蒜剥掉蒜皮,将蒜瓣清洗干净,除去多余的鳞茎,留有茎盘和5mm厚的鳞茎,用75%的酒精灭菌5min。在无菌条件下,去除多余的鳞茎,将茎盘切割成1mm厚的4个小块,分别接种到诱导培养基中。
2.2 培养条件
基本培养基为 LS 培养基(Linsmaier E,Skoog F)[20]或MS培养基,含蔗糖30g/L,琼脂6g/L,pH 值5.8,培养于光照12h/d,光照度1 400lx,温度25±2℃。
2.3 茎盘不定芽诱导培养
茎盘的繁殖系数的计算均以每个蒜瓣的茎盘为单位。以LS为基本培养基,探讨不同NAA和6-BA浓度对茎盘不定芽诱导的影响,试验设计二因素三水平全部组合试验,NAA 和6 -BA 的浓度梯度为 0,0.1,0.5,每瓶培养基接种3块茎盘,每个处理10瓶,培养15d后,统计不定芽数。
2.4 继代培养
取茎盘上长出的不定芽(1mm左右),基部要带一部分茎盘,接种到继代培养基上。
基本培养基种类、6-BA和NAA组合对不定芽生长和增殖的影响试验:在MS和LS培养基中,保持6-BA和NAA 的浓度比例为 10∶1,设置 0.5∶0.05,1.0∶0.1,2.0∶0.2,3.0∶0.3,4 个水平。保持NAA 浓度为0.1 mg/L ,设置6 -BA 与 NAA 的浓度比为 2∶1,5∶1,10∶1 ,20∶1 ,30∶1 等 5 个水平,共28个处理,重复2次。每个处理30个不定芽,培养15d后测量苗高和统计苗数,计算增殖系数。
2.5 生根和试管微鳞茎培养
以茎盘不定芽为外植体的试管苗易于生根,因此,以1/2MS为基本培养基,探讨不同NAA、IAA和温度对试管微鳞茎形成的影响,试验采用L9(33)正交试验设计,各因素水平设置见表1,共9个处理,重复3次。培养15d后统计生根率和鳞茎形成率。
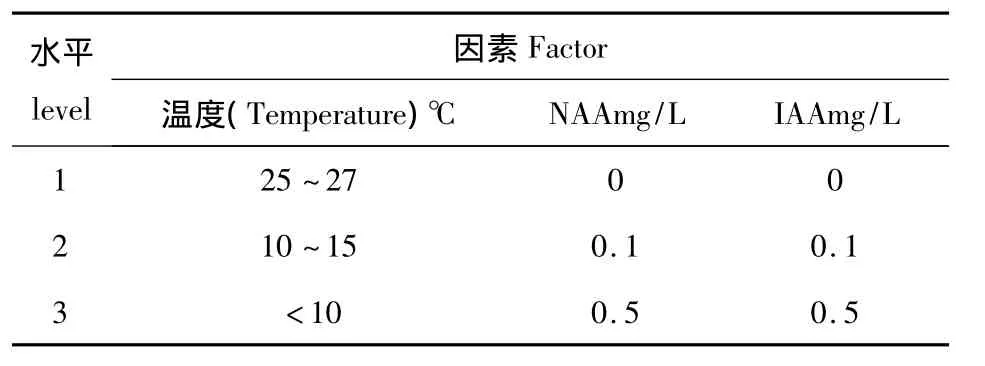
表1 因素和水平Tab.1 Factors and levels
3 结果与讨论
3.1 不同激素配比对茎盘不定芽诱导的影响
接种7d后,茎盘表呈现出疣状突起,培养15d逐渐可观察到生长出来的不定芽(图1),通过不同生长素和细胞分裂素的配比试验可以看出(图2),高浓度的NAA和6-BA对不定芽的产生都有一定的抑制作用,通过对不定芽数的统计,LS+NAA0.0+6-BA0.1培养基的不定芽诱导率最高,平均每块茎盘可产生5.7个不定芽(图2),按每个茎盘分成4个小块计算,增殖系数为22.8。

图1 茎盘不定芽诱导Fig.1 Development of vitro shoots from a stem disc
双因素方差分析表明6-BA浓度的增加对不定芽诱导率的影响不显著(F<Fcrit,P -value>0.05),而 NAA 浓度的增加则明显抑制不定芽的产生(F>Fcrit,P-value<0.05),这与 M.Ayabe[18]等的研究一致。
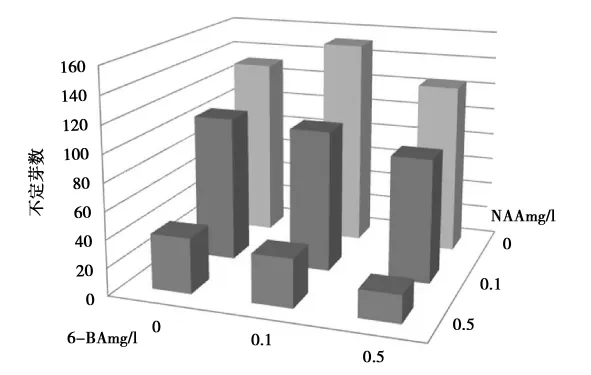
图2 激素对茎盘不定芽诱导的影响Fig.2 Effect of phytohormone on development of in vitro shoots from a stem disc
3.2 不同激素水平对不定芽生长的影响
由图3可以看出,对不定芽生长和增殖来看,在不同的激素浓度和配比下,均以LS培养基最宜,经过方差分析表明,在6-BA和NAA的浓度比值不变的情况下,浓度的变化对不定芽的生长和增殖没有显著影响(表3,F<Fcrit,P-value>0.05),而不同培养基类型对不定芽的生长和分化有显著影响(表3,F>Fcrit,P -value<0.05)。从6-BA和NAA不同浓度配比试验中可以看出(图3c,d),随着6-BA和NAA的浓度比值增大,不定芽的生长和分化得到不同程度的促进,增殖系数最高达到了4.56,但在试验中观察以及后续的生根驯化中来看,增殖系数大于4和株高超过6cm的幼苗,往往生长细弱,不利于后续的生根和微鳞茎的形成(图4),同时还需要进行壮苗才能达到较高的驯化成活率,这样虽然提高了增殖系数,但是延长了快繁时间,降低了快繁效率。因而,综合考虑从不定芽的生长和增殖效果以及繁殖效率来看,LS培养基+6-BA2.0+NAA0.2组合最适合不定芽的继代培养。
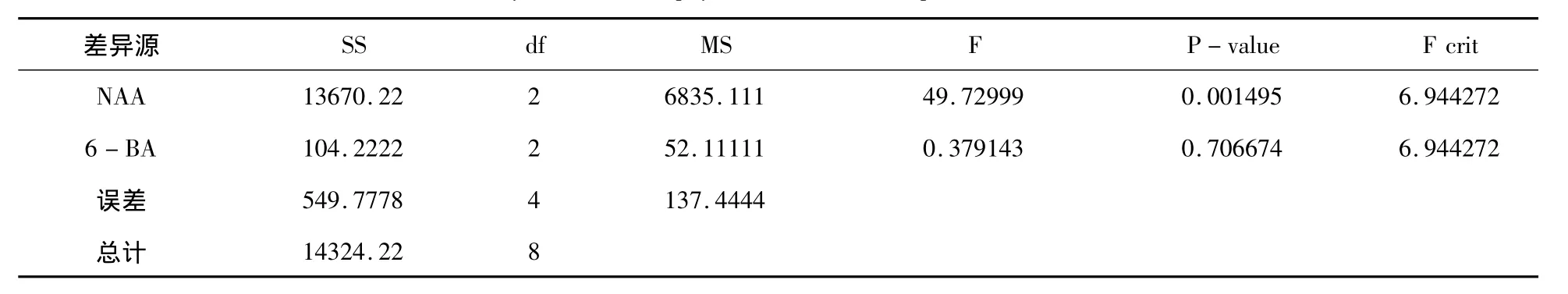
表2 激素水平对不定芽诱导的方差分析表Tab.2 Variance analysis of effect of phytohormone on development of shoots from a stem disc
3.3 不同温度和激素水平对大蒜微鳞茎形成和生根的影响
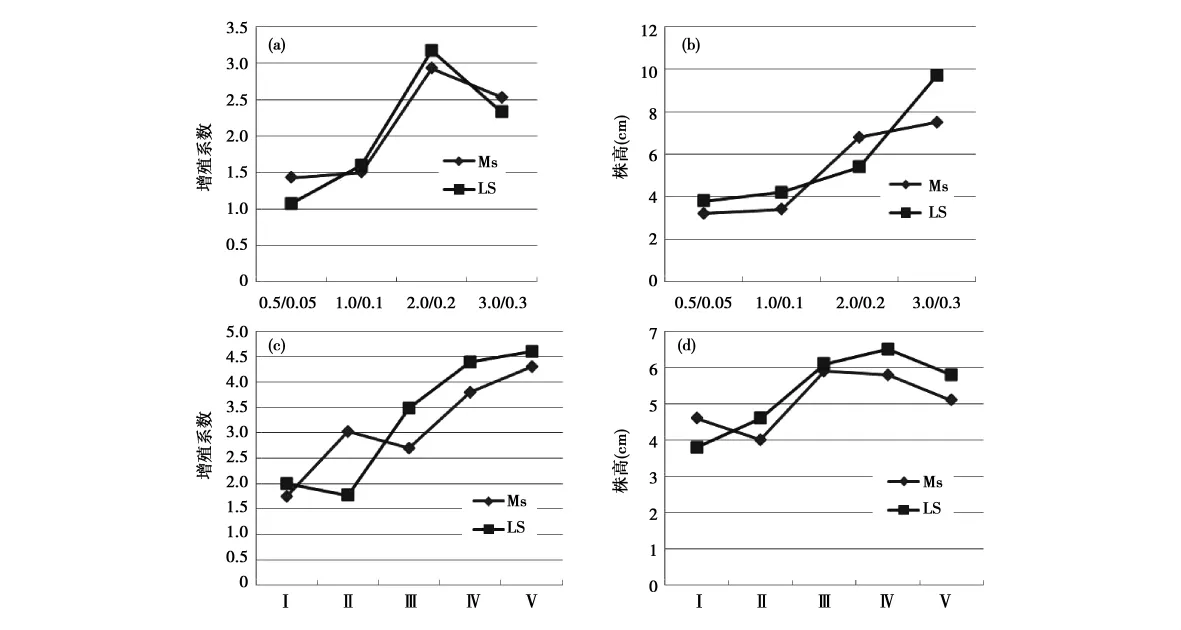
图3 不同培养基和6-BA、NAA组合对不定芽生长和增殖的影响Fig.3 Effects of medium and combinations of 6 - BA and NAA on garlic plantlet growth and proliferation
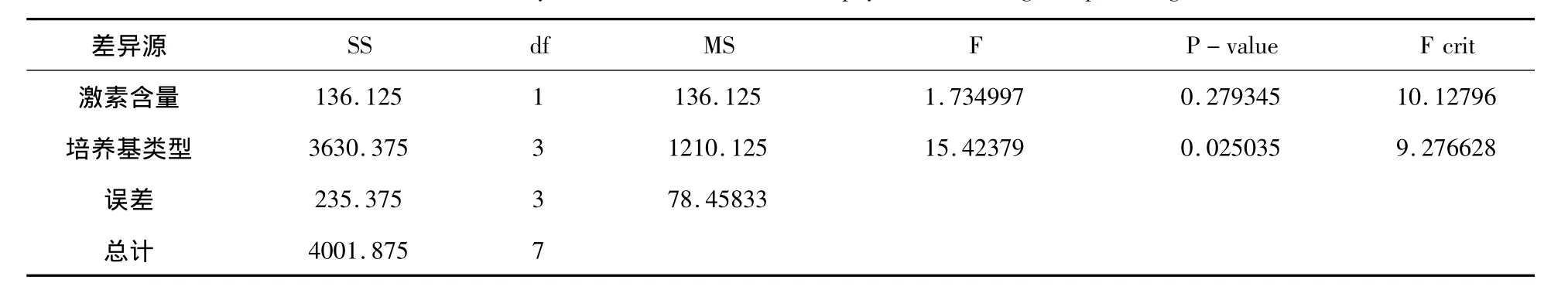
表3 不同培养基类型和激素含量对不定芽的影响的方差分析Tab.3 Variance analysis of effects of medium and phytohormone on garlic plantlet growth

图4 不定芽的继代培养Fig.4 Successive transfer culture of garlic plantlet
经过不同培养温度和激素水平的处理,结果通过表4可以看出,相对于不添加激素的1/2MS培养基,添加一定量的激素均有促进大蒜生根和微鳞茎形成的作用。由处理3、5、6、7和9可以看出,较高浓度的IAA可以促进生根和微鳞茎的形成,而较高浓度的NAA则起不到促进作用,因此,较高浓度的IAA和较低浓度的NAA组合利于生根和微鳞茎的形成。从大蒜微鳞茎的形成和生根效果来看,不同处理温度对形成微鳞茎的影响要大于对生根的影响。在较高温度下,有较高的生根率却有较低的鳞茎形成率,随着温度的降低,生根率显著下降,而鳞茎形成率显著增高。培养过程中发现,温度较高时25℃ ~27℃,根更倾向于伸长生长,而温度较低时10℃ ~15℃,幼苗基部可形成大量丛生、短而壮的根,根的伸长生长受到抑制,转向形成微鳞茎(图5),而当温度小于10℃生根率有所下降,从而影响微鳞茎的形成,因此,综合考虑温度和激素的相互作用,以培养温度10℃ ~15℃,NAA0.1+IAA0.5 处理为生根和诱导微鳞茎形成的最佳培养基。
4 结论
大蒜茎盘分生能力强,可诱导产生大量不定芽,是大蒜快繁的绝佳外植体。通过试验研究茎盘不定芽诱导最适培养基为LS+6BA0.1,不定芽继代的最佳培养基为LS培养基+6-BA2.0+NAA0.2,不定芽继代过程中,要控制增殖系数和株高,将继代和壮苗结合成在一起完成,这样不但提高了成活率还能大大缩短快繁时间。生根和诱导微鳞茎的培养基为1/2MS+NAA0.1+IAA0.5,适当的低温有利于微鳞茎的形成,但温度过低会影响根的生长,试验表明10℃ ~15℃的培养温度,有利于试管微鳞茎的形成和生根。本研究综合考虑快增殖系数、驯化成活率和快繁周期等快繁过程中的关键因素,从控制分化和徒长的角度筛选最佳组合的培养基,有利于大蒜茎盘不定芽快繁技术的推广应用。

表4 不同激素水平处理对鳞茎形成和生根的影响Tab.4 Effect of phytohormone on rooting and bulb form
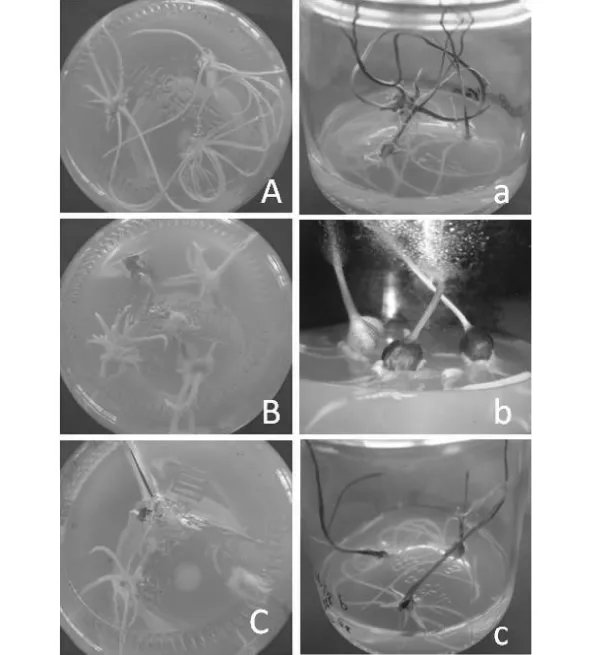
图5 不同培养温度处理下大蒜幼苗生根和微鳞茎的形成Fig.5 The rooting and bulb forming of garlic plantlet in different culture temperature
[1]孙晓波.大蒜微繁的一种新技术体系的构建[D].南京:南京农业大学,2002.
[2]ALEJANDRINA.Efficient plant regeneration of garlic(Allium Sativum L.)by root - tip culture[J].In Vitro Cell.Dev.Biol,2000,(36):416 -419.
[3]MA Y,HONG -LONG WG,CUN -JIN Z,et al.High rate of virus- free plantlet regeneration via garlic scape - tip culture[J].Plant Cell Rep,1994,(14):65 -68.
[4]EBI M,KASAI N,MASUDA K.Small inflorescence bulbils are best for micropropagation and virus elimination in garlic[J].Hort Science,2000,(35):735 -737.
[5]胡小京.大蒜组织培养快繁技术的研究[J].长江蔬菜(学术版),2011,(20):13 -15.
[6]赵俊丽.大蒜茎尖培养研究初报[J].河北农业科学,2003,7(4):67-68.
[7]熊正琴.大蒜花序轴离体培养的研究[J].南京农业大学学报,2000,23(3):25 -28.
[8]王洪隆.大蒜花梗组织培养再生植株[J].华北农学报,1992,(3):12-15.
[9]唐巧玲.以根为外植体建立大蒜的组织培养体系[J].生物技术进展,2011,(2):140 -145.
[10]马雯.大蒜茎尖脱毒体系的建立与病毒电镜检测分析[D].兰州:甘肃农业大学,2011.
[11]曾建军.江西省名优地方品种螺田大蒜脱毒快繁研究[J].安徽农业科学,2009,37(13):5870 -5871.
[12]张素芝.植物激素对大蒜茎盘组织培养的影响[J].西南农业大学学报,2006,5(28):805 -808.
[13]龙玉娟.大蒜花序轴离体培养器官发生途径的解剖学研究[J].西北植物学报,2008,3(1):56 -59.
[14]张恩让.大蒜体细胞无性系的染色体变异研究[J].西北农林科技大学学报,2004,(9):58 -60.
[15]孟新亚.大蒜胚性细胞悬浮系的建立[J].河南农业科学,2002,(6):102 -105.
[16]梁艳.蔗糖浓度对阿城紫皮大蒜试管微鳞茎形成和膨大的影响[J].中国农学通报,2005,4(21):185-187.
[17]栾非时.脱毒大蒜花原始体培养增殖技术的研究[J].中国蔬菜,1995,(3):4 -6.
[18]M.AYABE.A novel and efficient tissue culture method-“stem-disc dome culture”-for producing virus-free garlic(Allium sativum L.)[J].Plant Cell Rep,2001,(20):503 -507.
[19]M.AYABE.Establishment of a novel tissue culture method,stem-disc culture and its practical application to micropropagation of garlic(Allium sativum L.)[J].Plant Cell Reports,1998,(17):773-779.
[20]LINSMAIER E,SKOOG F.Organic growth factor requirements for tobacco tissue cultures[J].Physiol Plant,1965,(18):100 -127.
