经腹和腹膜后途径肾上腺肿瘤切除术临床观察
2013-07-26韩毅力罗勇陈玉成杨建标姜永光
韩毅力 罗勇 陈玉成 杨建标 姜永光
1首都医科大学附属北京安贞医院泌尿外科100029 北京
2北京市怀柔区医院泌尿外科
3内蒙古临河医院泌尿外科
Gagner首次将腹腔镜技术应用于肾上腺肿瘤的治疗以来[1],腹腔镜技术给泌尿外科手术治疗带来革命性的变化。尤其在在肾上腺肿瘤治疗中,由于这项技术自身的优势,已经成为肾上腺手术的“金标准”[2]。我院开展腹腔镜技术较早,并由于我院自身特点,已经应用腹腔镜技术治疗大量肾上腺肿瘤患者,现根据我们的临床观察,对经腹和经腹膜后两种入路进行比较,总结如下。
1 资料与方法
1.1 临床资料
收集我院自2010年6月~2013年4月因各种原因到我院住院手术的肾上腺肿瘤病例合计180例,患者详细资料见表1。临床诊断依赖于影像学诊断、生化检查和最终的病理学诊断。以手术时间、出血量、并发症、住院时间和中转开放手术率作为判断标准,比较两种术式的手术效果。
1.2 麻醉和围手术期处理
醛固酮增多症患者术前用药控制血压及低钾,酸碱平衡紊乱;皮质醇增多症患者术中术后使用氢化可的松;嗜铬细胞瘤患者术前降压、扩容、控制心率。
均采用气管插管全麻,术中Trocar位置如下:腹膜后组3个Trocar,第1个Trocar(10mm)位置在腋后线与肋骨交界下方,第2个Trocar(10mm)在腋中线,骼棘上2横指;第3个Trocar(5mm)在腋前线与肋骨交界处下方。经腹组3个Trocar,第1个Trocar(10mm)位置平脐腹直肌外侧,第2个(5mm)在同侧骼前上棘内上方约2cm,第3个(10 mm)在腹直肌外侧缘与肋骨交界处下方,如为右侧病变,可以在第2和第3个Trocar之间置入第4个Trocar来牵拉肝脏。
腹膜后组:CO2压力为13mm Hg(1mm Hg=0.133kPa)。切开Gerota筋膜后沿肾脂肪囊后缘往肾上极方向游离。切开肾脂肪囊显露肾上极。再沿肾脏内侧缘切开肾周脂肪分离出肾前间隙;最后游离肾上腺与肾上极之间的间隙。Hem-o-lok控制血管后切断肾上腺血管,最后切除肾上腺肿瘤。经腹组:腹腔充气后沿Todlt线切开腹膜,向上延长经过脾肾韧带(左)和肝肾韧带(右),切断上述韧带后将结肠向侧分离,显露肾上腺区域,需要注意下腔静脉(右)、胰尾(左)。切开肾脂肪囊,显露肾上腺。分离肾上腺中央静脉,Hem-o-lok 处理血管后切除肾上腺肿瘤。
术后24h内拔除尿管。平均2天拔除引流管。抗生素使用1~3d。激素补充和血压控制与传统开放手术相同。
1.3 统计学分析
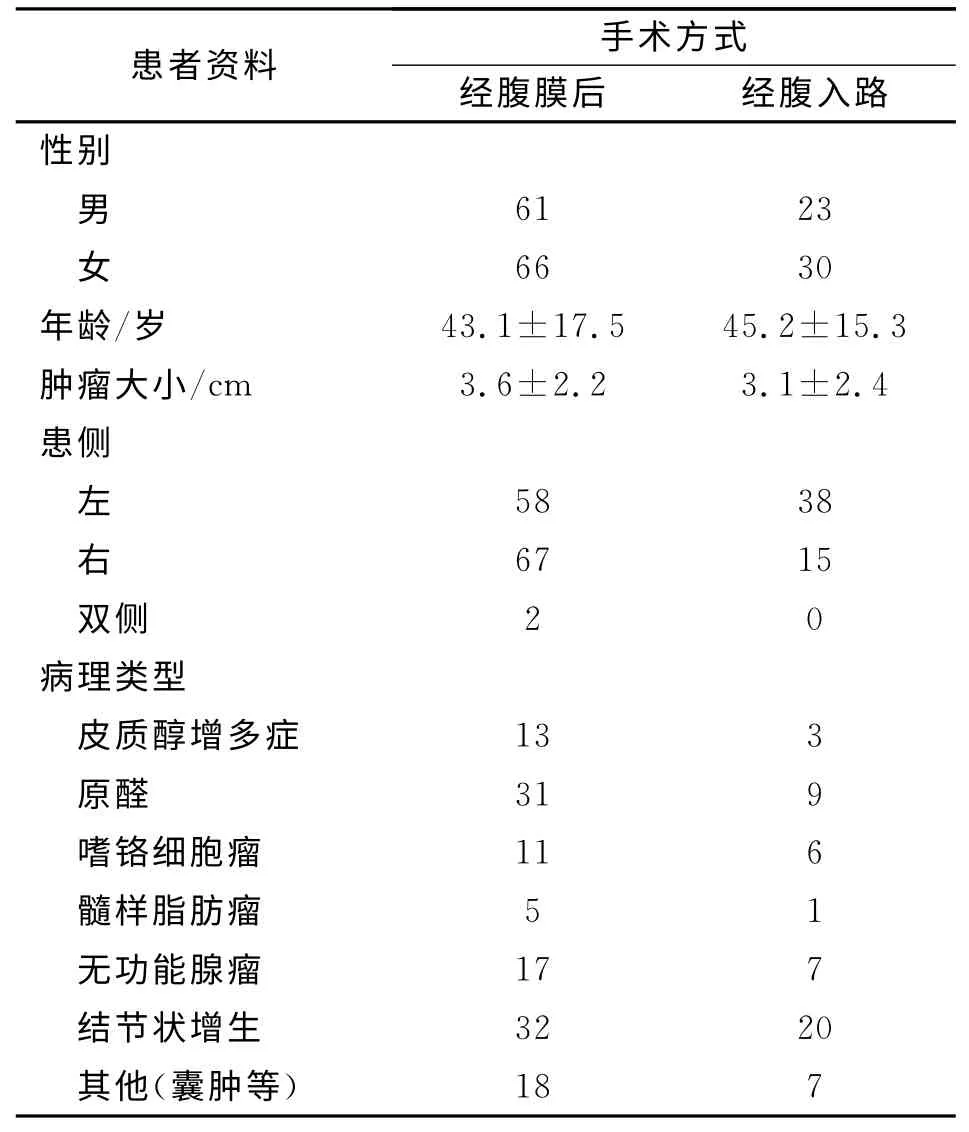
表1 患者临床资料 例
2 结果
所有患者手术顺利,无死亡病例。手术时间、出血量、并发症和中转开放手术率见表2。
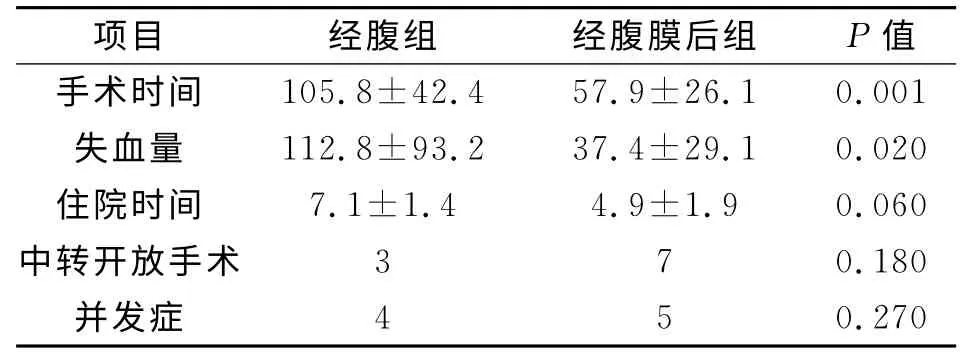
表2 经腹和经腹膜后入路手术比较
在两组患者当中,经腹组和经腹膜后组在手术时间、失血量显示差异有统计学意义,尽管在住院时间上显示经腹组长于经腹膜后组,但差异无统计学意义。中转开放手术和并发症差异无统计学意义。在两组患者中,中转开放手术的原因为发生较明显的出血,经腔镜下处理效果不佳;术中肿瘤较小,寻找病变困难;术中肿瘤周围粘连紧密,难以分离。并发症的发生多为腹膜后血肿形成,伤口感染,高碳酸血症等。所有患者顺利恢复出院,随访无明显不适。
3 讨论
在肾上腺肿瘤的腹腔镜治疗当中,经腹腹腔镜手术开展时间最长。Gaur在1992年提出了腹膜后腔的技术[3]。就目前两种技术应用的现状而言,国外应用经腹途径较多,而国人应用经腹膜后途径较多。我们的临床观察立足比较两种治疗手段的临床疗效。
我们的研究结果显示了同经腹组相比,经腹膜后组在手术时间和失血量方面占有优势,而在中转开放手术、并发症方面,二者没有明显差异。尽管住院时间上,经腹组平均住院时间稍长,但同经腹膜后组相比较,二者差异无统计学意义。这也与他人的研究结果类似。Dickson等人的研究显示,在23例行经腹和23例行经腹膜后途径腹腔镜下肾上腺切除患者当中,二组间在手术时间、失血量和住院时间上,经腹膜后组较经腹组为优,而在其他方面,二者没有明显的差别。
之所以出现这样的结果,我们认为首先与两种手术途径的优缺点相关。经腹腹腔镜手术具有手术空间大、解剖标志清楚、视野清晰、可同时处理双侧病变等优点,缺点在于干扰腹腔脏器,甚至有损伤腹腔脏器的可能;术后肠道功能恢复相对慢,对有腹腔手术史或感染史的患者而言,腹腔内粘连会大大增加手术难度,延长手术时间,并发症的发生概率也会相应增加。在我们的手术过程当中,考虑到腹腔脏器损伤的可能,因此手术操作相对保守谨慎,从而延长了手术时间和增加了失血量。而经腹膜后腹腔镜手术减少了对腹腔脏器的干扰,手术入路直接,术后患者康复快。但同时经腹膜后入路存在暴露相对困难、操作空间相对狭小、解剖标识不易辨认等问题。其次,术者的手术熟练程度也决定的临床效果。我们在腹腔镜开始阶段采用经腹膜后入路,因此,相对经腹腔手术更加熟练,这对研究结果也是有影响的。事实上,很多研究显示二者并没有明显差异。在一项Meta 分析当中,结果显示在手术时间、出血量、并发症、住院时间等方面差异无统计学意义[4];而另外一项Meta分析当中,经腹膜后入路也仅在住院时间上优于经腹组[5]。这可能与研究者对两种术式均比较熟练有关。
我们的研究显示了经腹膜后途径优于经腹组。但由于经腹膜后途径操作空间相对狭小等缺点,因此在大肾上腺肿瘤(>5cm)主张经腹途径。但随着技术的熟练,部分大体积肾上腺肿瘤也可以通过经腹膜后途径解决。在我们的研究过程当中,多次应用经腹膜后途径切除超过5cm的肿瘤。其他学者也有通过腹膜后途径切除18cm 肿瘤的报道[6]。
根据我们的经验,尽管经腹膜后入路优于经腹组,但是对于腹膜后途径术后复发行二次手术和既往有腰部手术史的患者,经腹入路仍然作为手术的首选。从而尽可能的避开上次手术所造成的粘连。此外,对于双侧病变,经腹途径是有优势的。
在术中术后并发症方面,Bergamini等[7]总结833例腹腔镜肾上腺切除术的临床资料,总体并发症发生率8.5%,并发症主要有出血、周围脏器损伤、腹膜后血肿等。其中,嗜铬细胞瘤是发生并发症的显著危险因素。国内学者研究显示,在110例直径>5cm的肾上腺肿瘤患者行解剖性腹膜后腹腔镜切除术,术中并发症发生率为10%,包括下腔静脉损伤、术中严重血流动力学紊乱等[8]。在我们的研究当中,中转开放手术的原因是发生难以保守处理的出血、寻找病变困难;肿瘤周围粘连紧密。术后并发症包括腹膜后血肿形成,切口感染等。
本研究表明,目前肾上腺肿瘤的治疗经腹膜后途径优于经腹途径。但随着腹腔镜技术不断成熟和器械的改进,这种差异可能会逐渐缩小。
[1]Gagner M,Lacroix A,BoltéE.Laparoscopic adrena-lectomy in Cushing's syndrome and pheochromocytoma.N Engl J Med,1992,327(14):1033.
[2]Gill IS.The case for laparosopic adrenalectomy.J Urol,2001,166(2):429-436.
[3]Gaur DD.laparosopic operative retroperitoneoscopy:use of a new deviee.J Urol,1992,148(4):1137-1139.
[4]Nigri G,Rosman AS,Petrucciani N,et al.Meta-analysis of trials comparing laparoscopic transperitoneal andretroperitoneal adrenalectomy.Surgery,2013,153(1):111-119.
[5]Constantinides VA,Christakis I,Touska P,et al.Systematic review and meta-analysis of retroperitoneoscopic versus laparoscopic adrenalectomy.Br J Surg,2012,99(12):1639-1648.
[6]周利群,何睿.腹腔镜技术在肾上腺肿瘤中的应用.腹腔镜外科杂志,2012,17(2):86-89.
[7]Bergamini C,Martellucci J,Tozzi F,et al.Complications in laparoscopic adrenalectomy:the value of experience.Surg Endosc,2011,25(12):3845-3851.
[8]Wang B,Ma X,Li H,et al.Anatomic retroperitoneoscopic adrenalectomy for selected adrenal tumors >5 cm:our technique and experience.Urology,2011,78(2):348-352.
