蓝藻水华堆积处理池中微囊藻毒素降解细菌的分离及降解特性
2013-07-24贾云璐郑凌凌左艳霞宋立荣
赵 爽 陈 伟 贾云璐 郑凌凌左艳霞 宋立荣
(1.中国科学院水生生物研究所, 武汉430072; 2.中国科学院大学, 北京 100049)
囊藻毒素(Microcystins, MCs)是一类由某些淡水蓝藻(如: 微囊藻)产生的环状七肽, 具有肝脏毒性效应。随着蓝藻水华在世界范围内频繁暴发, MCs的环境归趋相关研究成为该领域的热点之一[1,2]。我国的太湖、滇池和巢湖, 每年都会发生不同程度的蓝藻水华。以太湖为例, 在水华严重暴发时期, 机械打捞蓝藻水华并集中堆积于处理池中, 是我国目前较为有效的高生物量蓝藻水华处理的应急措施之一[3]。
生物降解被认为是 MCs环境归趋的主要途径之一[4]。针对 MCs的生物降解, 目前国内外已开展了大量研究, 分离出多株MCs降解细菌, 并对其降解过程和机理作了较为深入的研究[5]。也有研究主要集中在自然水体和水净化处理工艺及过程方面[6,7],但在大量蓝藻水华收获处理的条件下, MCs将如何归趋、生物降解能否起到主导作用等科学问题, 目前鲜有研究报道。本研究拟从太湖蓝藻水华堆积处理池中分离MCs降解细菌并研究其降解特性, 从理论上揭示蓝藻水华生物量堆积处理条件下 MCs的归趋机制, 为发展有毒蓝藻脱毒和资源化利用提供理论和技术指导。
1 材料与方法
1.1 试剂和MCs提取
MC-LR和MC-RR标准样品购自瑞士Alexis公司。实验用MC-LR和MC-RR从实验室培养的产毒微囊藻经提取纯化获得[8,9], 并经高效液相色谱(HPLC)检测其色谱纯度>90%, 实验前经0.22 μm无菌滤器过滤除菌。实验所用试剂除甲醇为色谱纯外,其余均为分析纯。
1.2 MCs测定
以高效液相色谱(HPLC, LC 10A, Shimadzu)测定MCs, 条件为: 流动相100%甲醇: 磷酸盐缓冲液(0.05 mol/L, pH 3.0)=58: 42 (v/v), 流速1 mL/min,色谱柱Kromasil 100-5 C18(150 mm×4.6 mm), 进样体积10 μL, 紫外检测波长238 nm。
1.3 MCs降解细菌的分离
表层藻水混合物和底部沉积物采集于2010年9月太湖北部蓝藻水华堆积处理池, 梯度稀释后涂布于R2A培养基[7], 28℃培养3—5d, 随机挑取不同特征的单菌落于蛋白胨酵母膏液体培养基(PY培养基:蛋白胨10 g/L, 酵母膏5 g/L, pH 7.0)培养。取对数期生物量4380 r/min离心5min, 去上清, 无菌水悬溶洗涤2次, 以无菌磷酸钠盐缓冲液(PBS, 0.1 mol/L,pH 7.0)悬溶并调A600=0.5, 分别加入MC-LR和MCR, 使其终浓度分别约2 μg/mL, 28℃避光120 r/min振荡培养。间隔6h取样, 11000 r/min离心10min后,取上清HPLC测定MCs浓度。
1.4 菌株的16S rDNA鉴定和MCs降解基因
分离得到46个细菌单菌落, 采用基因组提取试剂盒提取细菌基因组DNA, 采用细菌16S rDNA通用引物27F-1492R[10], 于PCR仪(MJ mini, BIO-RAD)中进行PCR反应, 反应条件: 95℃ 5min, 95℃ 30s,55℃ 30s, 72℃ 90s, 32 个循环, 72℃ 10min, 产物纯化回收测序。
为研究菌株SW1的MCs降解基因mlrA的同源序列, 及环境样品中是否含有mlrA基因, 进行如下实验: 处理池表层藻水混合物样品和同期内太湖梅梁湾表层水, 经 0.2 μm (GTTP, Millipore)过滤, 对滤膜和处理池藻泥沉积物提取总DNA (PowerSoil DNA Isolation Kit, MOBIO)。MCs降解基因mlrA的PCR引物和反应条件等参考Bourne,et al.和Saito,et al.的研究[11,12]。PCR产物经琼脂糖凝胶电泳, EB染色成像。另回收SW1的PCR产物并测序。
1.5 pH对SW1生长的影响
在水华严重暴发时期及蓝藻水华堆积处理池中,水体常呈碱性, 为研究 pH对SW1生长的影响, 于PY培养基中预培养SW1至对数期, 接种于不同pH的培养基并考察SW1的增殖。以0.1 mol/L PBS配制PY培养基, 并以0.1 mol/L 磷酸和4 mol/L NaOH调pH, pH梯度范围为5.91—11.97。培养条件同降解实验, 间隔取样测定A600值。
1.6 SW1对MCs的降解
为考察温度和pH对SW1降解MCs的影响, 以PBS(0.1 mol/L, pH 7.0)悬溶SW1并调A600=0.5, 取2 mL该菌液于玻璃试管, 加入MC-LR或MC-RR使其终浓度为 1.8 μg/mL。温度梯度为 4、15、22、28和37℃; pH梯度范围为5.91—7.86 (0.1 mol/L PBS),7.93—10.02 (0.1 mol/L 硼酸钠盐)。避光150 r/minm振荡培养(pH实验时温度为 28℃), 每 6h取样测定反应体系中MCs的变化。
根据上述实验结果并参考已有研究报道[13,14],结合蓝藻水华堆积处理池现场数据, 设置温度28℃、pH 7.0, 其他条件同上, 研究了SW1对MCs的降解动力学特征。
1.7 数据分析
采用SPSS 14.0统计分析软件和Origin 8软件。
2 结果
2.1 细菌鉴定
SW1在R2A固体培养基中菌落呈圆形, 直径一般<1 mm, 白色半透明有光泽。SW1革兰氏染色呈阴性, 杆状。将16S rDNA基因序列提交至GenBank数据库BLAST, 并以MEGA5软件采用邻位连接法(Neighbor Joining, 1000 bootstrap replicates)绘制系统发育树(图1, 加下划线标注为目前已报道的MCs降解菌株), 结果表明该菌株可定属于Sphingopyxissp.。
2.2 pH对SW1生长的影响
对不同pH的增殖响应表明, SW1对中性和弱碱性具有良好的适应性(图2)。在pH 6—9的条件下培养24h后, 生物量增加了10倍以上; 在pH 10—11的强碱性条件下, SW1则生长变缓甚至几乎不能生长。
2.3 温度和pH对SW1的MCs降解活性影响
SW1在 28—37℃具有很强的降解活性, 能在6h内降解超过80%的MC-LR和70%的MC-RR (图3)。SW1对MC-LR和MC-RR的降解最适温度约在30℃, 在同一温度下对 MC-LR的降解速率高于MC-RR。在中性和弱碱性(pH 7—8)条件下, SW1具有高的MCs降解活性, 能够在6h内降解80%以上的MC-LR和MC-RR(图4); 在强碱性条件下活性显著下降, 在 pH 10时, SW1仅能降解大约 20%的MC-LR和MC-RR。SW1对MC-RR和MC-LR降解的pH响应是不同的。在pH 6.5—9, SW1对MC-LR的降解超过 80%, 而对 MC-RR的最适 pH范围是7—8。

图1 基于16S rDNA基因序列的SW1系统发育树Fig.1 Phylogenetic tree of microcystin degrading bacterium SW1 based on 16S rDNA gene sequence
2.4 降解动力学
拟合降解动力学曲线表明(图 5), SW1对MC-LR和MC-RR的降解具有一级反应的动力学特征, 其对MC-LR和MC-RR的降解速率方程、降解反应速率常数k、降解半衰期t1/2和相关系数R2(表1)。对 MC-LR和 MC-RR的降解速率常数分别为0.35/h、0.28/h, 平均降解速率为分别为 0.20 μg/(mL·h)、0.12 μg/(mL·h) (MC-RR初始浓度各为1.8 μg/mL, 初始细菌浓度A600=0.5)。
2.5 降解基因mlrA的鉴定
PCR结果显示, 菌株 SW1、处理池表层藻水混合物和太湖北部表层水的mlrA基因 PCR反应呈阳性(图6), 表明SW1和蓝藻水华堆积处理池的细菌中含有mlrA的同源基因,说明蓝藻水华堆积处理池中存在MCs的生物降解。SW1和已报道的其他MCs降解菌的mlrA同源基因相似度很高(84%—99%, 表2)。而堆积池沉积物中未检测出mlrA基因。
3 讨论
SW1对MC-LR和MC-RR的降解具有一级反应动力学特征, 降解速率高于目前已报道的几株毒素降解细菌, 如: ACM-3692、7CY、LH21、EMS和THN1等, 但小于Y2、MD-1、B9、J10 和 C1 (表 3)。造成降解速率和降解反应速率常数不同的原因除了细菌菌株本身的特性,还与MCs和细菌的初始浓度、培养条件有关, 前培养处理也是影响降解活性的要素[13,15,21]。研究表明SW1对不同MCs的异构体降解速率不同, 对 MC-LR降解速率高于MC-RR (图 3、4), 这与 ACM-3692、J10相似, 但不同于MD-1、7CY, 其原因除了可能跟菌株自身特性(如MCs降解酶对相似底物不同的亲和力), 还与不同MCs异构体本身的性质(如相同pH下不同的带电性质)有关。然而, Park,et al.的研究发现,MCs降解细菌 Y2在同一条件下对不同浓度的MCs异构体降解速率是变化的, 即高浓度的 MC-RR降解速率高于 MC-LR, 低浓度则反之[15]。而在自然水体中是否存在相似现象, 仍有待进一步研究。
温度是影响SW1降解活性的重要因素, 不同温度下 SW1表现出不同的 MCs降解活性, 其最适降解温度约在30℃, 这与另一株MCs降解菌LH21相似[7]。夏秋季节太湖的平均水温一般约在26—32℃,在此期间由蓝藻水华暴发产生的 MCs也会被更快速地降解; 而对于蓝藻水华堆积处理池由于本身较浅且处于露天环境, 池内温度一般高于太湖水温,MCs的降解速率很可能更高。

图2 pH对SW1生长的影响Fig.2 Effect of pH on the growth of SW1
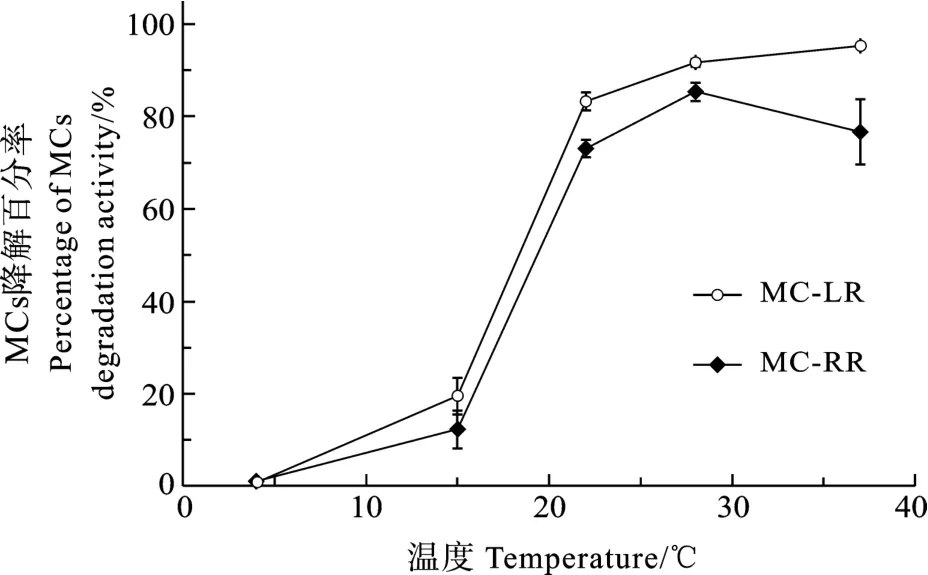
图3 温度对SW1的MCs降解活性影响Fig.3 Effect of temperature on the degradation activity of SW1
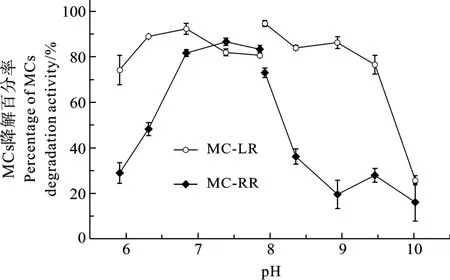
图4 pH对SW1降解活性的影响Fig.4 Effect of pH on the degradation activity of SW1

图5 MC-LR和MC-RR降解曲线Fig.5 Degradation curve of MC-LR and MC-RR
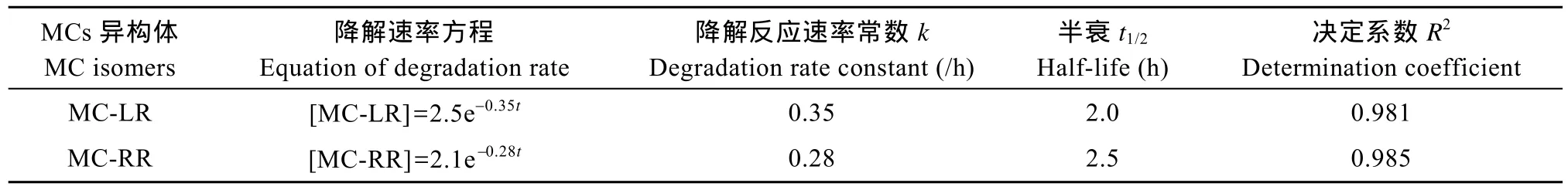
表1 降解速率方程Tab.1 Equation of degradation rate
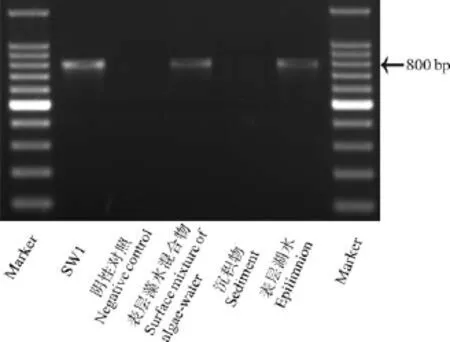
图6 SW1、蓝藻水华堆积处理池和太湖湖水中 mlrA基因的PCR检测Fig.6 PCR detection of mlrA gene in SW1, treatment ponds and lake water of Lake Taihu
pH也是影响SW1的MCs降解活性, 在中性和偏碱性条件下能对MC-LR和MC-RR快速降解, 这和已报道的几株MCs降解细菌相似[14,16,18]。研究表明MC-LR的高降解活性pH区间范围大于MC-RR,其可能原因除了SW1对MCs异构体降解的选择性差异, 以及细胞代谢功能因体系 pH改变细胞质膜电荷而受到影响的可能原因外, 还可能与MCs异构体自身的结构和电荷特性有关。
同时 SW1生长的碱性耐受研究表明其能在中性和偏碱性条件下生长, 但不适于强碱性环境, 这也与之前的研究结果相似[14,18]。蓝藻水华发生的水体上层因蓝藻的光合活性 pH呈较强碱性[22,23], 而在处理池中藻水混合物pH相对较低, 一般在6.9至8.8, 这与SW1对MCs高降解活性的pH区间大致是相吻合的, 因此蓝藻死亡裂解后释放的MCs可以被更快速降解, 所以处理池的pH并不是SW1类降解菌的降解活性限制因子。MC-LR的高降解活性pH区间范围大于MC-RR, 除了SW1对MCs异构体降解的选择性差异, 以及细胞代谢功能因体系 pH改变细胞质膜电荷而受到影响的可能原因外, 还可能与MCs异构体自身的结构和电荷特性有关。
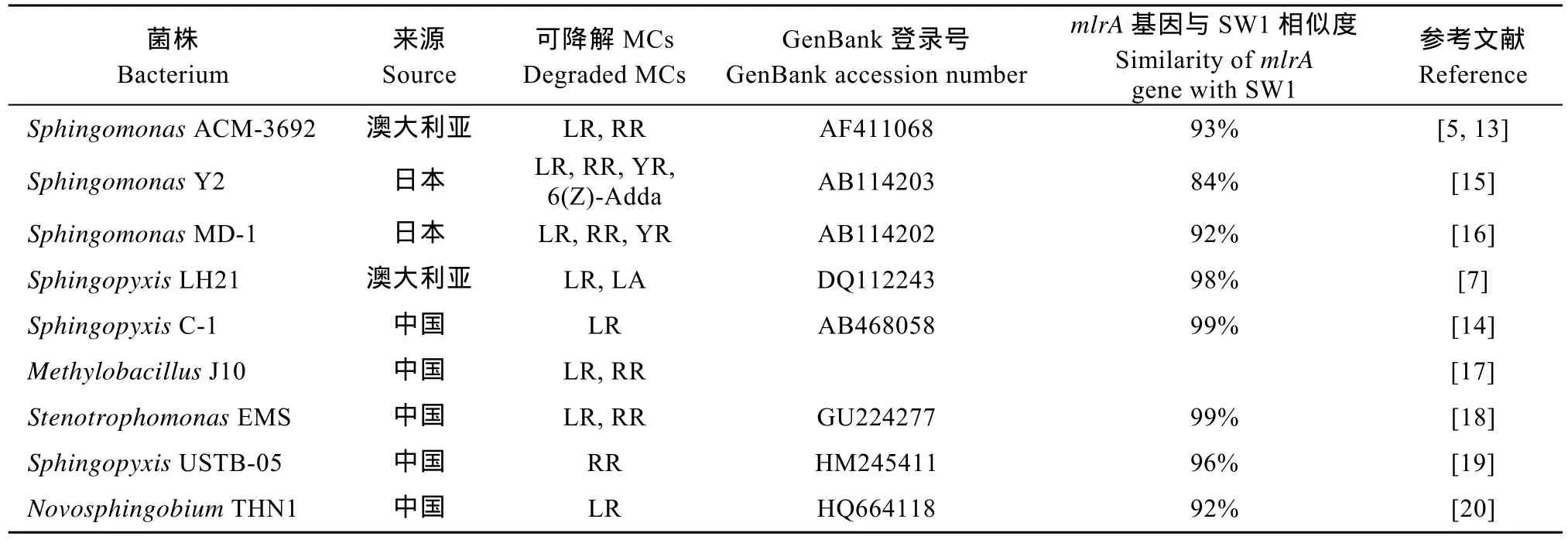
表2 SW1和已报道MCs降解细菌的mlrA基因相似性比较Tab.2 Similarities of mlrA gene between SW1 and reported MCs-degrading bacteria
蓝藻水华水体及藻的胶被中存在有大量细菌[24,25], 能够代谢降解包括蓝藻毒素在内的生物有机质并促进水体的自我净化[26—28], 即使受自然环境因素影响, 生物降解仍为水体中大多数微囊藻毒素的主要归宿[4]。所有具有mlrA同源基因的 MCs降解菌并不只降解 MCs, 对蓝藻合成的其他一些环多肽也具有降解活性[29]。一般研究认为MCs降解细菌能够有效地对MCs进行脱毒[30,31], 但蓝藻水华堆积处理池不同于一般的藻华水体和水处理工艺, 有其不同之处(如高有机质、高浓度毒素释放等), 这会促使其中土著和外源(蓝藻水华)进入的微生物群落结构和种群数量发生变化, 同时大量可降解的有机质也会与MCs发生代谢竞争, 进而对MCs的生物降解造成影响[32—34]。以 PCR对蓝藻水华堆积处理池和水华暴发区域mlrA基因检测呈阳性表明, 处理池很可能存在与已报道相似的MCs降解途径[29,31,35]。处理池沉积物样品中mlrA基因 PCR检测呈阴性, 是否具有与一般湖泊沉积物对MCs的降解作用[36], 仍需进一步研究。SW1所表现出的 MCs降解特性可能与在蓝藻水华堆积处理池特殊环境下的驯化有关,一些细菌(如SW1)在一定环境下(如高水温和弱碱性)很可能在MCs快速降解过程中起到了关键作用。在自然环境下, Jones,et al.观察到双相降解动力学(Bi-phasic degradation kinetics), 即快速降解相(包括之前的延滞期)和迟缓降解相, 并将这种现象的原因归纳为两个独立的细菌类群: 一类能利用 MC-LR作为碳源和能源, 另一类共代谢低含量的MC-LR[2]。在对蓝藻水华堆积处理池MCs降解模拟实验研究中也发现了类似的双相降解动力学现象(结果未发表), 从这一角度讲, SW1很可能属于快速代谢MCs的细菌种类。SW1的分离来源——蓝藻水华堆积处理池中的生物量来源于太湖, 也有关于太湖MCs降解细菌的研究报道[17,18,20], 但目前为止并未能从处理池中分离到已报道的MCs降解菌株, 这是否与处理池的非自然条件有关, 与其他MCs降解细菌相比SW1是否具有特殊之处, 有待进一步的研究。处理高通量的蓝藻水华能否有效去除 MCs, 与藻华水体中MCs的降解有怎样的异同[37], 目前尚缺乏相关研究和结论。从蓝藻水华堆积处理池中分离MCs降解细菌并进行特性研究对于回答和解决上述问题非常关键, 对于进一步研究蓝藻水华脱毒和资源化利用也具有重要价值[30,38]。
4 结论

从蓝藻水华堆积处理池中分离获得具有 MCs高降解活性的菌株SW1, 经16S rDNA鉴定为鞘氨醇单胞菌(Sphingopyxissp.); 在实验条件下SW1能分别在 9h、15h完全降解 1.8 μg/mL的 MC-LR和MC-RR, 并具有一级反应动力学特征, 其反应速率常数分别为0.35/h和0.28/h; 温度和pH是影响SW1对MCs降解活性的因素, 温度约30℃, pH中性和弱碱性, 具有高降解活性; 在中性及偏碱性条件下(pH 6—9)SW1能快速增殖; SW1具有mlrA的同源基因,在蓝藻水华堆积处理池的上层藻水混合物中也含有具有mlrA同源基因的细菌。
[1] Lahti K, Rapala J, Färdig M,et al.Persistence of cyanobacterial hepatotoxin, microcystin-LR in particulate material and dissolved in lake water [J].Water Research,1997, 31(5): 1005—1012
[2] Wang H, Xu L H.The current developments and future directions in microcystins study [J].Acta Hydrobiologica Sinica, 2011, 35(3): 504—515 [王昊, 徐立红.微囊藻毒素研究的当前进展和未来方向.水生生物学报, 2011, 35(3):504—515]
[3] Chen W, Song L, Gan N,et al.Sorption, degradation and mobility of microcystins in Chinese agriculture soils: risk assessment for groundwater protection [J].Environmental Pollution, 2006, 144(3): 752—758
[4] Edwards C, Lawton L A.Bioremediation of cyanotoxins [J].Advances in Applied Microbiology, 2009, 67: 109—129
[5] Bourne D G, Jones G J, Blakeley R L,et al.Enzymatic pathway for the bacterial degradation of the cyanobacterial cyclic peptide toxin microcystin LR [J].Applied and Environmental Microbiology, 1996, 62(11): 4086
[6] Song L, Chen W, Peng L,et al.Distribution and bioaccumulation of microcystins in water columns: a systematic investigation into the environmental fate and the risks associated with microcystins in Meiliang Bay, Lake Taihu [J].Water Research, 2007, 41(13): 2853—2864
[7] Ho L, Hoefel D, Saint C P,et al.Isolation and identification of a novel microcystin-degrading bacterium from a biological sand filter [J].Water Research, 2007, 41(20): 4685—4695
[8] Chen W, Li L, Gan N,et al.Optimization of an effective extraction procedure for the analysis of microcystins in soils and lake sediments [J].Environmental Pollution, 2006,143(2): 241—246
[9] Peng L, Chen W, Song L R.Study on extraction methods of intracellular microcystins [J].Acta Hydrobiogica Sinica,2011, 35(4): 708—712 [彭亮, 陈伟, 宋立荣.微囊藻胞内毒素的提取方法.水生生物学报, 2011, 35(4): 708—712]
[10] Suzuki M T, Giovannoni S J.Bias caused by template annealing in the amplification of mixtures of 16S rRNA genes by PCR [J].Applied and Environmental Microbiology,1996, 62(2): 625—630
[11] Bourne D G, Riddles P, Jones G J,et al.Characterisation of a gene cluster involved in bacterial degradation of the cyanobacterial toxin microcystin LR [J].Environmental Toxicology,2001, 16(6): 523—534
[12] Saito T, Okano K, Park H D,et al.Detection and sequencing of the microcystin LR degrading gene,mlrA, from new bacteria isolated from Japanese lakes [J].FEMS Microbiology Letters, 2003, 229(2): 271—276
[13] Jones G J, Bourne D G, Blakeley R L,et al.Degradation of the cyanobacterial hepatotoxin microcystin by aquatic bacteria [J].Natural Toxins, 1994, 2(4): 228—235
[14] Okano K, Shimizu K, Kawauchi Y,et al.Characteristics of a microcystin-degrading bacterium under alkaline environmental conditions [J].Journal of Toxicology, 2009: 954291
[15] Park H D, Sasaki Y, Maruyama T,et al.Degradation of the cyanobacterial hepatotoxin microcystin by a new bacterium isolated from a hypertrophic lake [J].Environmental Toxicology, 2001, 16(4): 337—343
[16] Saitou T, Sugiura N, Itayama T,et al.Degradation characteristics of microcystins by isolated bacteria from Lake Kasumigaura [J].Journal of Water Supply Research and Technology-Aqua, 2003, 52(1): 13—18
[17] Hu L B, Yang J D, Zhou W,et al.Isolation of aMethylobacillussp that degrades microcystin toxins associated with cyanobacteria [J].New Biotechnology, 2009, 26(3—4): 205—211
[18] Chen J, Hu L B, Zhou W,et al.Degradation of microcystin-LR and RR by aStenotrophomonassp.strain EMS isolated from Lake Taihu, China [J].International Journal of Molecular Sciences, 2010, 11(3): 896—911
[19] Wang J, Wu P, Chen J,et al.Biodegradation of microcystin-RR by a new isolatedSphingopyxissp.USTB-05 [J].Chinese Journal of Chemical Engineering, 2010, 18(1): 108—112
[20] Jiang Y, Shao J, Wu X,et al.Active and silent members in themlrgene cluster of a microcystin-degrading bacterium isolated from Lake Taihu, China [J].FEMS Microbiology Letters, 2011, 322(2): 108—114
[21] Alamri S A.Biodegradation of microcystin by a newBacillussp.isolated from a Saudi freshwater lake [J].African Journal of Biotechnology, 2010, 9(39): 6552—6559
[22] López-Archilla A I, Moreira D, Lopez-Garcia P,et al.Phytoplankton diversity and cyanobacterial dominance in a hypereutrophic shallow lake with biologically produced alkaline pH [J].Extremophiles, 2004, 8(2): 109—115
[23] El Herry S, Fathalli A, Rejeb A J-B,et al.Seasonal occurrence and toxicity ofMicrocystisspp.and Oscillatoria tenuis in the Lebna Dam, Tunisia [J].Water Research, 2008,42(4—5): 1263—1273
[24] Maruyama T, Kato K, Yokoyama A,et al.Dynamics of microcystin-degrading bacteria in mucilage ofMicrocystis[J].Microbial Ecology, 2003, 46(2): 279—288
[25] Berg K A, Lyra C, Sivonen K,et al.High diversity of cultivable heterotrophic bacteria in association with cyanobacterial water blooms [J].ISME Journal, 2009, 3(3):314—325
[26] Fedorak P M, Huck P M.Microbial-metabolism of cyanobacterial products - batch culture studies with applications to drinking-water treatment [J].Water Research,1988, 22(10): 1267—1277
[27] Watanabe M F, Tsuji K, Watanabe Y,et al.Release of heptapeptide toxin (microcystin) during the decomposition process ofMicrocystis aeruginosa[J].Natural Toxins, 1992,1(1): 48—53
[28] Ho L, Sawade E, Newcombe G.Biological treatment options for cyanobacteria metabolite removal - A review [J].Water Research, 2012, 46(5): 1536—1548
[29] Kato H, Imanishi S Y, Tsuji K,et al.Microbial degradation of cyanobacterial cyclic peptides [J].Water Research, 2007,41(8): 1754—1762
[30] Tsuji K, Asakawa M, Anzai Y,et al.Degradation of microcystins using immobilized microorganism isolated in an eutrophic lake [J].Chemosphere, 2006, 65(1): 117—124
[31] Imanishi S, Kato H, Mizuno M,et al.Bacterial degradation of microcystins and nodularin [J].Chemical Research in Toxicology, 2005, 18(3): 591—598
[32] Eleuterio L, Batista J R.Biodegradation studies and sequencing of microcystin-LR degrading bacteria isolated from a drinking water biofilter and a fresh water lake [J].Toxicon, 2010, 55(8): 1434—1442
[33] Ho L, Hoefel D, Palazot S,et al.Investigations into the biodegradation of microcystin-LR in wastewaters [J].Journal of Hazardous Materials, 2010, 180(1—3): 628—633
[34] Li J, Shimizu K, Sakharkar M K,et al.Comparative study for the effects of variable nutrient conditions on the biodegradation of microcystin-LR and concurrent dynamics in microcystin-degrading gene abundance [J].Bioresource Technology, 2011, 102(20): 9509—9517
[35] Bourne D G, Jones G J, Blakeley R L,et al.Enzymatic pathway for the bacterial degradation of the cyanobacterial cyclic peptide toxin microcystin LR [J].Appl Environ Microbiol, 1996, 62(11): 4086—4094
[36] Chen X, Yang X, Yang L,et al.An effective pathway for the removal of microcystin LR via anoxic biodegradation in lake sediments [J].Water Research, 2010, 44(6): 1884—1892
[37] Cousins I T, Bealing D J, James H A,et al.Biodegradation of microcystin-LR by indigenous mixed bacterial populations[J].Water Research, 1996, 30(2): 481—485
[38] Zeng S, Yuan X, Shi X,et al.Effect of inoculum/substrate ratio on methane yield and orthophosphate release from anaerobic digestion ofMicrocystisspp.[J].Journal of Hazardous Materials, 2010, 178(1—3): 89—93
[39] Harada K, Imanishi S, Kato H,et al.Isolation of Adda from microcystin-LR by microbial degradation [J].Toxicon, 2004,44(1): 107—109
[40] Ishii H, Nishijima M, Abe T.Characterization of degradation process of cyanobacterial hepatotoxins by a gram-negative aerobic bacterium [J].Water Research, 2004, 38(11): 2667—2676
