微囊藻毒素缓解过氧化氢胁迫下铜绿微囊藻损伤的初步研究
2013-07-24甘南琴郑凌凌宋立荣
丁 奕 甘南琴 郑凌凌 宋立荣
(1.中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072;2.中国科学院大学, 北京 100049)
随着工农业生产和人们生活所产生的污水排放量的增加, 湖泊富营养化和蓝藻水华暴发已成为国内外普遍关注的环境问题[1—4]。从20世纪60年代开始, 人们一直致力于研究控制蓝藻水华的技术, 一般来说物理法和化学法是除藻的最直接手段。物理法主要包括机械或人工打捞、黏土絮凝和遮光技术等方法, 不会产生二次污染, 但是由于昂贵的费用,该方法只能局限于小水体或大水体的局部水域。化学法的时间效应比较快, 如硫酸铜、氯化物、高锰酸钾、重金属制剂等, 但由于其对除蓝藻外的其他生物的副作用造成环境污染或破坏生态平衡等缺点而受到限制[5]。过氧化氢(H2O2)氧化性强, 安全易得,且其分解产物是水和氧气, 不会产生新的污染物,因此, 过氧化氢被称为绿色氧化剂, 常作为一种环保有效的杀藻剂[6]。Qian,et al.报道H2O2通过阻断光合作用相关基因的转录或破坏光合色素来抑制藻类的生长[7]。Barrington 和 Ghadouani利用 H2O2方法诱导蓝藻和其他浮游植物死亡, 发现H2O2去除蓝藻效果比去除绿藻和硅藻更好[8]。
蓝藻水华污染所带来的主要危害之一是藻毒素。在已发现的各种藻毒素中, 微囊藻毒素(Microcystins,MCs)是一类出现频率最高、产生量最大和造成危害最严重的藻毒素[9]。目前所检测到的微囊藻毒素异构体已超过80种[10], MC-LR是毒性最大并且存在最广泛的一类。长期以来, 微囊藻毒素产生的生物学意义和功能一直受到科学研究者的关注, 但进展甚微。Babica,et al.[11]提出化感作用假说, 认为MCs对浮游藻类的光合作用、生长、诱导氧化应激等有抑制作用。Schatz,et al.[12]的研究发现, 无论是程序性死亡还是受到各种胁迫所引起的微囊藻细胞裂解,其后释放的MCs能诱导生存下来的微囊藻McyB的大量积累, 从而促进其微囊藻 MCs的产生, 提高对环境的适应性。Sedmak,et al.[13]的研究发现,500 µg/L的MCs能使微囊藻的形态和生理特征发生改变, 促进单细胞微囊藻积聚成群体。甘南琴等[14]研究表明微囊藻毒素 MCs能促进微囊藻群体尺寸增大, MCs浓度越高, 群体尺寸越大。Utkilen和Gjølme[15]的研究表明 MCs可作为胞内金属离子螯合剂而减轻金属离子对微囊藻的毒性。之前我们的研究结果表明, H2O2可依剂量诱导微囊藻细胞产生类细胞凋亡[6], 同时H2O2胁迫会导致微囊藻毒素的释放, 且胞外毒素的释放可能刺激胞内毒素的产生。我们推测MCs可能也参与了微囊藻响应H2O2胁迫的生理生化过程。它对H2O2胁迫下藻细胞的某些生理改变能否施加影响?有关这方面的信息还未见报道, 本文对此作了初步的探讨。本实验通过使用外源MC-LR, 研究MC-LR对H2O2胁迫下铜绿微囊藻生理生化变化的影响有利于阐明 H2O2胁迫影响产毒蓝藻的生长代谢的信号途径和 MCs生物学意义。
1 材料与方法
1.1 藻种和藻种培养
实验所用产毒铜绿微囊藻 FACHB-905取自中国科学院水生生物研究所淡水藻种库(FACHB-collection)。本实验以 BG11培养基为培养介质, 正常培养条件下, 温度 25℃, 光强为 25 µE/(m2·S), 光暗周期为12∶12。初始浓度A680=0.15接入250 mL三角瓶7—12d的培养物视为处于健康生长状态。
1.2 H2O2和MC-LR处理
离心收集健康生长的藻细胞, 无菌水清洗 3遍后, 置于BG11培养基中, 计算接种所需用量, 等待接入50 mL三角瓶中。正常生长条件(培养基未添加其他物质)作为对照组(Control)。实验设置4个处理组: (1)250 µmol/L H2O2处理, (2)250 µmol/L H2O2+200 ng/mL MC-LR 处理, (3) 350 µmol/L H2O2处理,(4) 350 µmol/L H2O2+200 ng/mL MC-LR 处理。接种终浓度A680控制在0.4左右, 终体系为30 mL, 每组设3个平行。本研究所用的微囊藻毒素MC-LR购自于台湾藻类研究公司(Taiwan Algal Science Inc,≥95% HPLC)。
1.3 样品微囊藻毒素检测
为了检测本实验H2O2浓度对MC-LR是否有降解作用, 采用HPLC方法分别在24h和48h检测毒素含量, 参考 Kaya和 Sano[16]。所用色谱柱为岛津ODS柱(4.6 mm×150 mm), 检测波长238 nm, 流动相为60%甲醇, 40%磷酸缓冲液(0.05 mol/L KH2PO4,20%H3PO4调节 pH=3.0), 流速为 1.0 mL/min, 进样量 10 µL。
1.4 MTT染色
藻细胞活性检测采用MTT染色法, 参考Li,et al.[17]的方法。其染色原理是水溶性无色或浅色的四唑类化合物, 在活细胞体内被还原成水不溶性蓝紫色的甲化合物(Formazan), 而死细胞体内不能生成甲。MTT溶于0.05 mol/L PBS(pH 6.8)中, 浓度为0.5 g/L, 同时加入0.1 mol/L琥珀酸钠, 保存于4℃。取250 µL样品, 1/2 BG11清洗后悬浮于250 µL 1/2 BG11中开始染色。将250 µL样品与100 µL MTT储存液混合, 染色在(35±1)℃的光照培养箱中进行,染色1h。染色后, 8000 r/min 3min离心去掉染色液,将藻细胞悬浮于250 µL蒸馏水中, 取8 µL于血球计数板中在光学显微镜下计数, 计算染色后阳性细胞占总细胞的比例。
1.5 光合系统活性测定
参考吴忠兴[18], 用 Phyto-PAM(Heinz Walz,Effeltrich, Germany)测定其光系统Ⅱ活性Fv/Fm和最大光电子传递速率ETRmax。取活体藻样2 mL, 暗适应15min以保证电子传递链氧化。
1.6 类胡萝卜素(Carotenoids)和叶绿素含量(Chl.a)的测定
测得方法参考吴忠兴[18]。取3 mL藻样, 7000 r/min转速离心3min, 弃上清液, 加入3 mL 80%的丙酮,低温暗处静置 24h提取脂溶性色素。24h后 10000 r/min离心5min, 取上清液分别测定663 nm和450 nm的光吸收值。根据下式分别计算色素的含量:
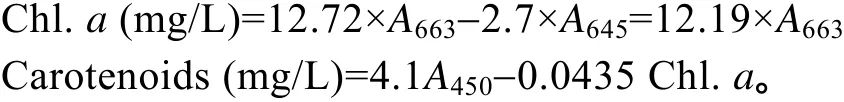
1.7 活性氧(ROS)含量测定
铜绿微囊藻细胞内 ROS 用二氯二氢荧光素双醋酸盐(DCFH-DA)检测。DCFH-DA 能进入细胞内,被酯酶分解为 DCFH, DCFH 与 H2O2等小分子过氧化物结合而被氧化成具有荧光性的DCF。其激发光波长为485 nm, 发射光为525 nm。分别在接种后第 24h 和第 48h 取样, 离心, 重悬于 100 mmol/L PBS (pH 7.2)缓冲液中, 再用PBS 缓冲液洗涤细胞2 次, 再重悬于PBS 缓冲液, 向其中加入DCFH-DA使其终浓度为10 μmol/L, 37℃避光温育1h, 以PBS洗涤 2 次, 再重悬于的 PBS 缓冲液用酶标仪(Molecular Device, M2, CA, USA)检测荧光强度。
1.8 超氧化物歧化酶(Superoxide Dismutase, SOD)活性测定
取适量藻样 7000 r/min, 离心 3min 后, 将藻泥悬浮于3 mL 50 mmol/L 磷酸盐缓冲液(PBS, pH 7.8)中, 超声波破碎共 3min, 每超声 20s, 停 10s,8000 r/min冷冻离心15min, 取上清液用于蛋白含量与酶活测定。超氧化物歧化酶(SOD)的测定采用改良的NBT光化还原法[19]。以抑制NBT光化还原50%作为一个酶活力单位计算比活。蛋白质浓度的测定采用考马斯亮蓝-G250 染色法[20]。
1.9 数据分析
本实验各组均设三个平行, 实验数据分析和图的绘制采用统计软件Origin 8.0(Origin Lab, USA)。
2 结果
2.1 H2O2对MC-LR的降解
当微囊藻毒素MC-LR暴露于250 µmol/L H2O2时, H2O2很难氧化MC-LR, 在 24h和48h处理后, MCLR浓度和初始浓度值相差不大(图1)。当微囊藻毒素MC-LR暴露于350µmol/L H2O2时,处理48h后才有轻微的降解, MC-LR浓度为初始浓度的86.4%。
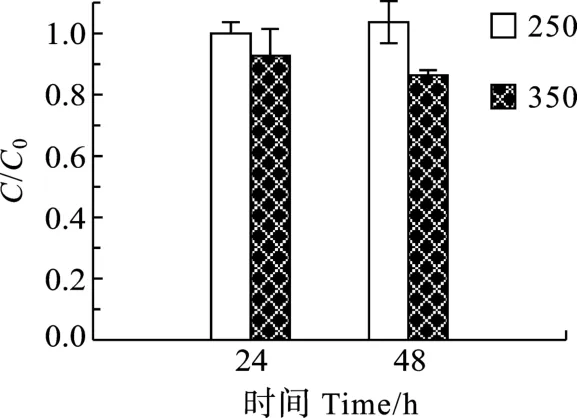
图1 250 和 350 µmol/L H2O2对 200 ng/mL MC-LR降解的影响Fig.1 Effect of 250 and 350 µmol/L H2O2 treatments on degradation of MCLR
2.2 MC-LR对H2O2胁迫下微囊藻生长的影响
在H2O2胁迫下, 加入或未加入MC-LR的微囊藻的生长都受到显著抑制(图2)。在250和 350 µmol/L H2O2处理9h后, 加入MC- LR的微囊藻存活率明显高于未加入MC-LR的微囊藻(图3)。随着时间的变化, 250 µmol/L H2O2处理微囊藻在加入MC-LR的情况下存活率一直高于未加入 MC-LR的微囊藻。但是350 µmol/L H2O2处理24h和48h后加入了MC-LR和未加入MC-LR的微囊藻存活率差异不大。
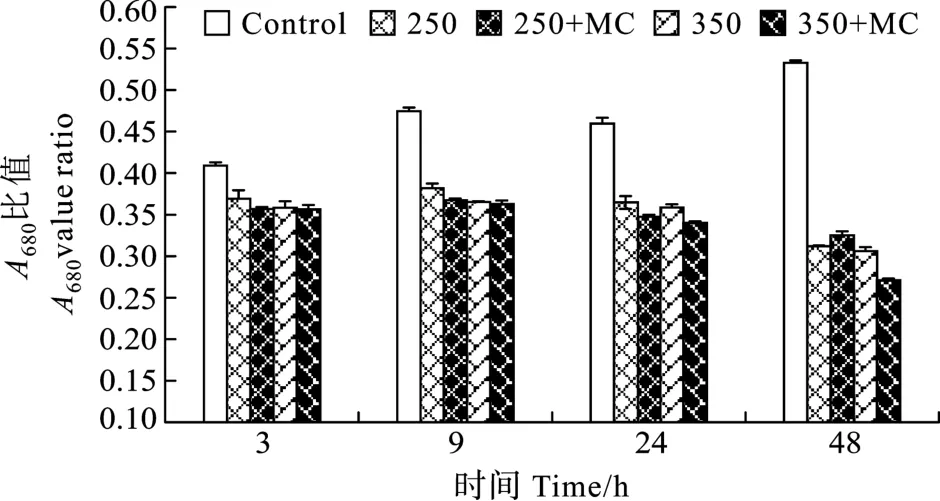
图2 培养基中加入和未加入外源MC-LR分别对H2O2胁迫下微囊藻生长的影响Fig.2 Effect of MC-LR on the growth of M.aeruginosa cells under 250 and 350 µmol/L H2O2 treatments.Control represents untreated cells
2.3 MC-LR对 H2O2胁迫下微囊藻光合系统Ⅱ活性的影响
在 H2O2胁迫下, MC-LR对微囊藻Fv/Fm和ETRmax的影响作用相同, 且受微囊藻细胞所处的H2O2浓度影响(图 4)。250 和 350 µmol/L H2O2都会使微囊藻的 PSⅡ活性降低, 其抑制作用在 3h后就可以检测到, 而此时 MC-LR的作用尚不明显。24h和48h后, 在培养基中加入的MC-LR可以缓解250µmol/L H2O2对微囊藻Fv/Fm和ETRmax的抑制作用。但是随着 H2O2浓度的增加, H2O2对微囊藻的 PSⅡ活性的抑制作用也越强,Fv/Fm和ETRmax已降到PAM 检测线以下, 加入的 MC-LR不能够减轻 350µmol/L H2O2对微囊藻Fv/Fm和ETRmax抑制作用。
2.4 MC-LR在 H2O2胁迫下对微囊藻类胡萝卜素/叶绿素含量的影响
从图5可以看出, 250 µmol/L H2O2处理24h后和同浓度并加入 MC-LR处理组的类胡萝卜素/叶绿素含量的比值没有显著变化, 分别为0.389和0.363。而 250 µmol/L H2O2处理48h后, 加入MC-LR比未加入 MC-LR的比值高(P<0.05), 说明 MC-LR使类胡萝卜素所占比例得到提高。350 µmol/L H2O2处理48h后类胡萝卜素和叶绿素含量比值明显下降, 加入的MC-LR不能够减轻350 µmol/L H2O2对光合色素的破坏作用。
2.5 MC-LR在 H2O2胁迫下对微囊藻细胞内 ROS含量和SOD活性的影响
在 250 和 350 µmol/L H2O2处理后, 微囊藻细胞内 ROS含量急剧上升, 在处理后的第 48h, 微囊藻细胞内ROS含量分别为对照的3.3和8.7倍(图6)。但是 48h后, 当微囊藻暴露于250 µmol/L H2O2环境中时, 添加了 MC-LR使细胞中的ROS含量明显减少(P<0.05), 但仍高于正常条件下微囊藻的ROS含量。从图 7可知, 与对照相比, 24h后H2O2处理组和250 µmol/L H2O2+MC-LR处理的SOD活性都有上升, 表明微囊藻对处理有一定的应激反应。同时,添加了 MC-LR的藻细胞SOD活性低于没有加入MC-LR的藻细胞活性。随着时间的推移, 在相同浓度 H2O2且加入了外源MC-LR后的48h, SOD活性急剧下降(P<0.05)。
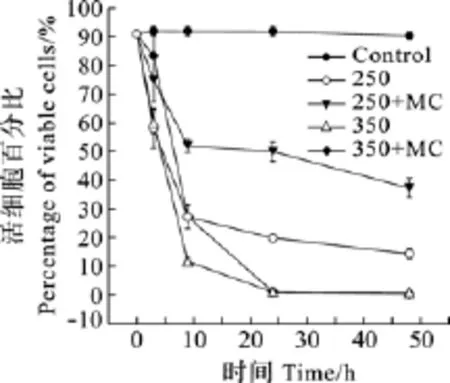
图3 培养基中加入和未加入外源MC-LR分别对 H2O2胁迫下微囊藻细胞存活率的影响Fig.3 Effect of MC-LR on cell viability of M.aeruginosa under 250 and 350µmol/L H2O2 treatments Control represents untreated cells
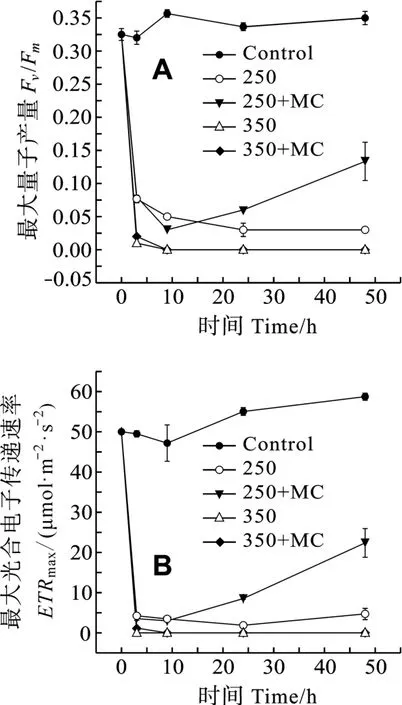
图4 培养基中加入和未加入外源MC-LR分别对 H2O2胁迫下微囊藻光合系统Ⅱ活性(Fv/Fm, ETRmax)的影响Fig.4 Effect of MC-LR on PSⅡ activity of M.aeruginosa under 250 and 350µmol/L H2O2 treatments
3 讨论
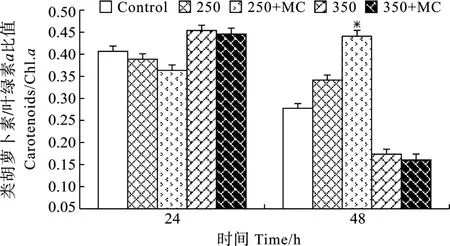
图5 培养基中加入和未加入外源MC-LR分别对H2O2胁迫下微囊藻细胞内类胡萝卜素/叶绿素比值的影响(“* ” 代表 P < 0.05)Fig.5 Effect of MC-LR on carotenoid and chla contents of M.aeruginosa under 250 and 350 µmol/L H2O2 treatments(“* ” is P <0.05)
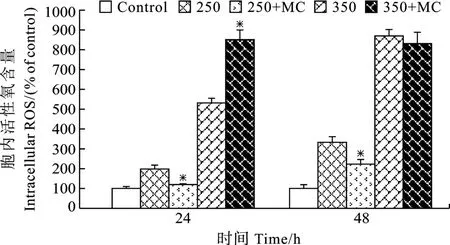
图6 培养基中加入和未加入外源MC-LR分别对H2O2胁迫下微囊藻细胞中 ROS 含量的影响 (“* ” 代表 P < 0.05)Fig.6 Effect of MC-LR on intracellular ROS of M.aeruginosa under 250 and 350 µmol/L H2O2 treatments Measured ROS is expressed as Fluorescence Intensity.The value represent mean ± SE of three replicate (“* ” is P < 0.05)
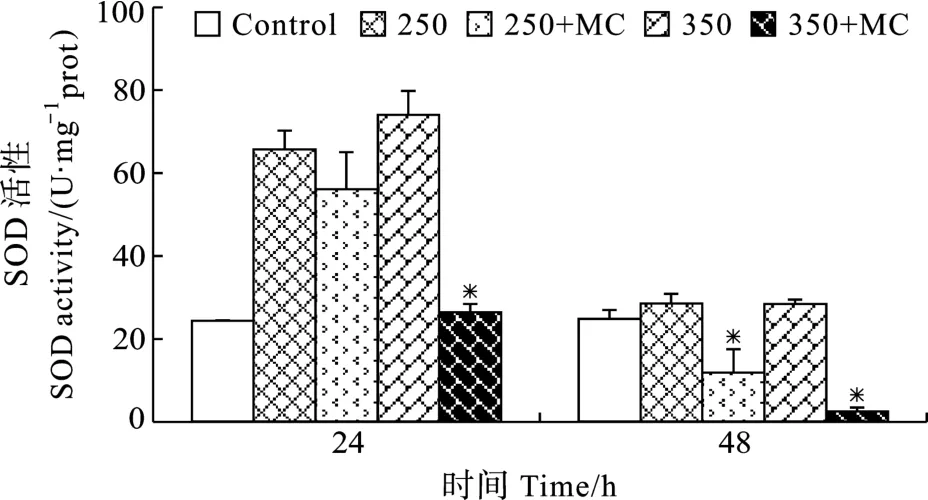
图7 培养基中加入和未加入外源MC-LR分别对H2O2胁迫下微囊藻细胞 SOD 活性的影响(“* ” 代表 P < 0.05)Fig.7 Effect of MC-LR on SOD activities of M.aeruginosa under 250 and 350 µmol/L H2O2 treatments(“* ” is P < 0.05)
微囊藻是世界各地最常发生水华的蓝藻, 且对于饮用水的危害也是各国瞩目的重点。在高光强下水体表面会形成自然光化学产物H2O2, 且在淡水中其浓度能达到10−5mol/L[21]。一方面, 由于经常暴露于变化的环境中, 蓝藻自身也经常产生H2O2以应对各种胁迫包括光强和温度的剧烈波动等等。另一方面, 由于过氧化氢可以迅速分解成氧和水, 经常作为一种杀藻剂[6]。大部分的蓝藻毒素都存在于细胞中, 只有当细胞死亡裂解时, 毒素才会被释放出来到水体中[22]。微囊藻毒素的大量产生可能有助于提高微囊藻群体的适应性以及与其他浮游植物的竞争力[11,23]。我们的实验结果表明, 与单独的 250 µmol/L H2O2处理相比,外源MC-LR的添加增加了H2O2胁迫下微囊藻细胞的存活率, 缓解由H2O2毒害造成光系统PSII活性的减少。但是350 µmol/L H2O2处理24h和48h后加入了MC-LR和未加入MC-LR的微囊藻细胞存活率差异不大, 说明高浓度350 µmol/LH2O2胁迫对藻细胞的伤害程度超过了其抵御能力, 从而不能减轻H2O2的负面影响。究其根本原因, 可能跟 MC是否参与程序性细胞死亡(PCD)信号传递途径有关。微囊藻虽然是单细胞生物, 但在自然条件下主要以群体形式存在。之前我们研究发现250 µmol/L H2O2可诱导微囊藻细胞产生类细胞凋亡(AL-PCD), 且导致微囊藻毒素的释放[3], 而高浓度的350 µmol/L H2O2可造成微囊藻细胞坏死。PCD从种群中移除受损的或者破坏了的细胞, 为同种群其他细胞提供生存机会[24]。有研究表明UV-C处理过的Chlamydomonas reinhardtii培养物中获得培养基可以改善C.reinhardtii再次受到UV-C胁迫时的生存能力, 使UV-C所致的死亡减少20%[25]。Schatz,et al.[9]的研究发现, 微囊藻细胞裂解释放的 MCs能被存活下来的微囊藻细胞感知并导致胞内 McyB大量积累, 从而促进其微囊藻MCs的产生, 提高对环境的适应性。Dittmann,et al.[26]发现两种微囊藻毒素相关蛋白质MrpA和MrpB与豌豆根瘤菌Rhizobium leguminosarum中的群体感应蛋白RhiA和RhiB显示出相似性, 认为毒素的存在是蓝光影响微囊藻 MrpAB表达的先决条件。Zilliges,et al.[27]发现微囊藻毒素与胞内一些蛋白绑定, 并且这种绑定在高光强和氧化应激条件下得到显著增强。据此推测外源MC-LR可能参与了微囊藻响应H2O2胁迫的AL-PCD过程, 从而提高微囊藻的生存力。当然要证明这一观点还需要更多的数据支持, 微囊藻毒素的信号传递途径还需要深入研究,其中胞内与胞外毒素之间的协同作用值得重视。
ROS是外源性氧化剂或细胞内有氧代谢过程所产生的具有很高生物活性的含氧化合物的总称, 包括超氧阴离子(O2-) 、羟自由基(OH-) 、过氧化氢(H2O2) 等[28]。在正常情况下, 植物细胞内ROS 的产生和清除是平衡的。但是, 当植物体遭受外来胁迫时, ROS的产生和清除则失去平衡, 会产生过量的 ROS, 导致氧胁迫, 并进而使得细胞膜结构损伤和生理代谢紊乱[29]。近期的研究发现微囊藻毒素的释放可能与过氧化压力或细胞的程序性死亡有关,外源H2O2使得微囊藻细胞内ROS增加且伴随着微囊藻毒素的释放[30,31]。在本研究中, 250 和 350 µmol/L H2O2处理后, 微囊藻细胞内 ROS含量急剧上升;48h后, 当微囊藻暴露于250 µmol/L H2O2环境中时,添加了MC-LR处理组细胞中的ROS含量明显减少(P<0.05)。这表明H2O2确实对微囊藻细胞产生了氧化胁迫, 而适当外源MC-LR可减少ROS的积累, 缓解 H2O2诱导的氧化胁迫。SOD是植物体主要的内源酶系自由基清除剂, 可以清除细胞内过多的ROS,从而保护膜和大分子物质[28]。本研究表明, H2O2处理组和250 µmol/L H2O2+MC-LR处理24h后的SOD活性都有上升, 但是添加了 MC-LR的藻细胞 SOD活性低于没有加入 MC-LR的藻细胞活性。推测在H2O2胁迫下, ROS积累, 细胞膜透性增强, 细胞膜损伤加剧; 外源MC-LR可能通过调控胞内ROS的积累进而影响SOD等抗氧化系统酶活性, 从而减轻藻细胞的氧化压力并减弱细胞的氧化应激反应。
综上所述, 目前获得的结果表明 MC-LR对H2O2胁迫下微囊藻的光合活性、色素 含量、酶活性等代谢过程有一定的影响, 并且其作用效果在不同的H2O2浓度和不同时间下是不同的。我们发现微囊藻毒素MC-LR可缓解250 µmol/L H2O2引起的藻细胞损伤并增强微囊藻自身的生存能力。
[1] Hu Z Q, Li D H, Liu Y D,et al.Ecotoxicology study of microcystin on aquatic organism.[J].Progress in Natural Science, 2006, 16(1): 14—20 [胡智泉, 李敦海, 刘永定, 等.微囊藻毒素对水生生物的生态毒理学研究进展.自然科学进展, 2006, 16(1): 14—20]
[2] Kang L J.Research on chlorophyllacriteria establishment in Dianshan Lake [J].Acta Hydrobiologica Sinica, 2012, 36(3):509—514 [康丽娟.淀山湖富营养化控制叶绿素a基准研究初探.水生生物学报, 2012, 36(3): 509—514]
[3] Zhou Q, Han S Q, Yan S H,et al.The mutual effect between phytoplankton and water hyacinth planted on a large scale in the eutrophic lake [J].Acta Hydrobiologica Sinica, 2012,36(4): 783—791 [周庆, 韩士群, 严少华, 等.富营养化湖泊规模化种养的水葫芦与浮游藻类的相互影响.水生生物学报, 2012, 36(4): 783—791]
[4] Xiang W Y, Wang X F.Remediation of different aquatic animals and plants on eutrophic water body [J].Acta Hydrobiologica Sinica, 2012, 36(4): 792—797 [向文英, 王晓菲.不同水生动植物组合对富营养化水体的净化效应.水生生物学报, 2012, 36(4): 792—797]
[5] Guo L G.Algae removal and control technologies [J].China Water Resources, 2006, 17(1): 34—36 [过龙根.除藻与控藻技术.中国水资源公报, 2006,17(1): 34—36]
[6] Ding Y, Gan N Q, Li J,et al.Hydrogen peroxide induces apoptotic-like cell death inMicrocystis aeruginosa(Chroococcales, Cyanobacteria) in a dose-dependent manner [J].Phycologia, 2012, 51(5): 567—575
[7] Qian H F, Yu S Q, Sun Z Q,et al.Effects of copper sulfate,hydrogen peroxide and N-phenyl-2-naphthylamine on oxidative stress and the expression of genes involved photosynthesis and microcystin disposition inMicrocystis aeruginosa[J].Aquatic Toxicology, 2010, 99(3): 405—412
[8] Barrington D, Ghadouani A.Application of hydrogen peroxide for the removal of toxic cyanobacteria and other phytoplankton from wastewater [J].Environmental Science and Technology,2008, 42(23): 8916—8921
[9] Li X Y, Song L R, Liu Y D.The production, detection and toxicology of microcystins [J].Acta Hydrobiologica Sinica,1999, 23(5): 517—522 [李效宇, 宋立荣, 刘永定.微囊藻毒素的产生、检测和毒理学研究.水生生物学报,1999,23(5): 517—522]
[10] Codd G A, Morrison L F, Metcalf J S.Cyanobacterial toxins:risk management for health protection [J].Toxicology and Applied Pharmacology, 2005, 203(3): 264—272
[11] Babica P, Blaha L, Marsalek B.Exploring the natural role of microcystins—a review of effects on photoautotrophic organisms [J].Journal of Phycology, 2006, 42(1): 9—20
[12] Schatz D,Keren Y, Vardi A,et al.Towards clarification of the biological role of microcystins, a family of cyanobacterial toxins [J].Environmental Microbiology, 2007, 9(4): 965—970
[13] Sedmak B, Eleršek T.Microcystins induce morphological and physiological changes in selected representative phytoplanktons [J].Microbial Ecology, 2006, 51(4): 508—515
[14] Gan N Q, Xiao Y, Zhu L,et al.The role of microcystins in maintaining colonies of bloom-formingMicrocystisspp [J].EnvironmentalMicrobiology, 2012, 14(3): 730—742
[15] Utkilen H, Gjølme N.Iron-stimulated toxin production inMicrocystis Aeruginosa[J].Applied and Environmental Microbiology, 1995, 61(2):797—800
[16] Kaya K, Sano T.Total microcystin determination usingerythro-2-methyl-3-(methoxy-d3)-4-phenylbutyric acid(MMPB-d3) as the internal Standard [J].Analytica Chimica Acta,1999, 386(1): 107—112
[17] Li J, Song L R.Applicability of the MTT assay for measuring viability of cyanobacteria and algae, specifically forM.aeruginosa(Chroococcales, Cyanobacteria) [J].Phycologia, 2007, 46(5): 593—599
[18] Wu Z X.Studies on the Genetic Diversity and Morphological and Physiological Adaptation of Microcystis [D].Thesis for Doctor of Science.Institute of Hydrobiology, Chinese Academy of Sciences,Wuhan.2006 [吴忠兴.我国微囊藻多样性分析及其种群优势的生理学机制研究.博士学位论文,中国科学院水生生物研究所, 武汉.2006]
[19] Giannopotitis C N, Ries S K.Superoxide dismutase in higher Plants [J].Plant Physiology, 1997, 59(2): 309—314
[20] Bradford M.A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding [J].Analytical Biochemistry, 1976,72(1): 248—254
[21] Cooper W J, Zika R G.Photochemical formation of hydrogen peroxide in surface and ground waters exposed to sunlight [J].Science, 1983, 220(4598): 711—712
[22] White S H, Duivenvoorden L J, Fabbro L D.A decision-making framework for ecological impacts associated with the accumulation of cyanotoxins (cylindrospermopsin and microcystin) [J].Lake and Reservoir Management,2005,10(1): 25—37
[23] Pflugmacher S.Possible allelo- pathic effects of cyanotoxins,with reference to microcystin-LR, in aquatic ecosystems [J].Environmental Toxicology,2002,17(4): 407—413
[24] Li J, Ding Y, Xiang R,et al.Programmed cell death in phytoplankton [J].Ecology and Environmental Sciences,2010, 19(11): 2743—2748 [李杰, 丁奕, 项荣, 等.浮游植物程序性细胞死亡研究进展.生态环境学报, 2010, 19(11):2743—2748]
[25] Moharikar S, D'Souza J S, Kulkarni A B,et al.Apoptotic-like cell death pathway is induced in unicellular ChlorophyteChlamydomonas reinhardtii(Chlorophyceae)cells following UV irradiation:detection and functional analyses [J].Journal of Phycology, 2006, 42(2): 423—433
[26] Dittmann E, Erhard M, Kaebernick M,et al.Altered expression of two light-dependent genes in a microcystin-lacking mutant ofMicrocystis aeruginosaPCC7806 [J].Microbiology, 2001, 147(11): 3113—3119
[27] Zilliges Y, Kehr J C, Meissner S,et al.The cyanobacterial hepatotoxin microcystin binds to proteins and increases the fitness ofMicrocystisunder oxidative stress conditions [J].PLOS ONE, 2011, 6(3): doi:10.1371/journal.pone.0017615
[28] Latifi A, Ruiz M, Zhang C C.Oxidative stress in cyanobacteria [J].FEMSMicrobiology Reviews, 2009, 33(2): 258—278
[29] Luo Y L, Song S Q.Plant mitochondria, reactive oxygen species and signaling transduction [J].Acta Botanica Boreali-Occidentalia Sinica, 2004, 24(4): 737—747[罗银玲, 宋松泉.植物线粒体、活性氧与信号转导.西北植物学报,2004, 24(4): 737—747]
[30] Ross C, Santiago-Vazquez L, Paul V.Toxin release in response to oxidative stress and programmed cell death in the cyanobacteriumMicrocystis aeruginosa[J].Aquatic Toxicology, 2006, 78(1): 66—73
[31] Bouchard J N, Purdie D A.Effect of elevated temperature,darkness and hydrogen peroxide treatment on oxidative stress and cell death in the bloom-forming toxic cyanobacteriumMicrocystis aeruginosa[J].Journal of Phycology, 2011,47(6): 1316—1325
