热带淡水产油微藻的分离筛选与鉴定
2013-07-24郝宗娣刘平怀
郝宗娣 刘平怀 杨 勋 张 森
(海南大学热带作物种质资源保护与开发利用教育部重点实验室, 海口570228)
化石燃料极大地促进了近代工业的发展, 其影响一直延续至今。然而, 化石燃料储量有限, 并且已引发生态环境的破坏, 严重威胁人类的生存[1]。因此寻找可持续发展的环境友好型能源是当今社会亟待解决的问题。生物质能源具有环保和可再生性, 发展生物质能源被认为是全球能源危机的最理想途径之一。生物柴油在能量密度、燃烧性能等方面同石化柴油相似性极高, 是石化柴油的最佳替代品。微藻是一类光合自养的低等植物, 是自然界中起源最早、分布最广、种类和数量庞大的生物种质资源库。在适当条件下, 很多微藻可积累大量的油脂, 其单位面积油产量可高达油料植物产量的数十倍[2]。另外微藻的生长周期短, 可使用工业废水培养, 固定大量的 CO2, 这些优点无疑可用于解决当下温室效应加剧、空气及水体污染和石化能源危机等重大问题[3]。
获得性能优越的产油能源微藻是从事基础研究和规模化生产的关键, 其中微藻培养过程中生物量的积累量和油脂含量是体现产油能源微藻应用价值的两个重要指标。一直以来, 富油藻种筛选方面的诸多研究仍然集中于一些藻种库或实验室保藏的现有藻种, 限制了在藻种资源方面的拓展。近年来国内外开始注重自然界中优势显著藻种的筛选, 如Thi,et al.[4]自泰国海域分离得到的一株微拟球藻(Nannochloropsissp.)油脂含量高达(44.8±1.7)%,Reda,et al.[5]自淡水河水体中分离出的一株斜生栅藻(Scenedesmus obliquus)的油脂含量高达(58±1.5)%。据估计,自然界中存在约 40000种微藻, 但被人类开发利用的数量不多[6]。因此, 继续开发自然界的微藻资源, 从中筛选高产油微藻并利用其生产生物柴油, 可起到充分利用资源的作用, 具有良好的应用前景。
本研究自海南热带自然水体中分离出藻株, 利用一套高效的微藻筛选及产油性能评价的方法对其进行筛选,目的是获得生长速度快、油脂产量高的藻株, 以期为微藻生物柴油的研究开发提供实验基础。
1 材料与方法
1.1 藻种的分离纯化
野外水样采自海口市河流、水库、小池塘等水体, 浮游微藻采用浮游生物网拖采, 底栖微藻采用刀片轻轻刮取水体中的石块、树枝、腐叶等物体表面。采集到的水样用装有已灭菌培养基的透明塑料瓶保存, 带回实验室待处理。
水样中微藻的分离纯化使用平板涂布法[7]: 配制BG11液体培养基, 加入 15—20 g/L的琼脂粉加热融化,制作平板。吸取少量的水样接种于固体平板上, 置于光照培养箱中培养 2—3周待藻落长出后, 用接种环挑出单藻落接种于24孔板中进行纯化培养10d后镜检, 将纯种藻株转入试管中培养并保种[8]。
1.2 富油微藻的筛选
初筛使用尼罗红染色法进行: 取纯化后的藻液100 μL置于96孔板中, 加入50 μL的尼罗红染液(尼罗红-DMSO,10 μg/mL), 漩涡震荡混合后于黑暗中孵育 10min, 利用荧光倒置显微镜进行观察[3]。选出黄色荧光较强的藻株,以进行复筛。复筛时微藻的生长、产油性能的评价试验采用φ8 cm的玻璃柱状光生物反应器培养, 培养基选用BG11。接种密度在A6800.08, 单侧日光灯24h连续光照, 光强约为40 μmol/(m2·s), 通入无菌压缩空气, 培养温度为(28±2)℃。
1.3 生长参数测定
在培养期间, 每天取样在显微镜下观察其变化, 以保证藻液的纯度; 隔日采用 TU-1810紫外-可见分光光度计测定藻液的A680; 培养结束时, 取20 mL藻液, 使用已烘干称重的滤膜抽滤, 80℃烘干后测定总重, 计算生物量。干重测定重复三次, 取平均值。
1.4 粗脂含量测定
培养结束后, 收集藻液离心(8000 r/min, 15min), 藻泥收集于保鲜盒中真空冷冻干燥后稍加研磨获得藻粉。粗脂提取步骤参照许瑾等[8]等的方法。实验重复3次, 取平均值。
1.5 富油微藻的脂肪酸成分分析
皂化: 取50 mg粗脂置于螺口玻璃瓶中, 加入5 mL的2%硫酸甲醇溶液, 充入氮气后封闭, 100℃烘箱中加热1h, 冷却至室温。甲酯化: 加入5 mL 5%的三氟化硼甲醇溶液, 80℃加热30min冷却至室温后加入3 mL蒸馏水和2 mL正己烷, 漩涡震荡后静置分层, 取上层置于2 mL的微量离心管中, 封口待测。
GC-MS色谱条件[9]: 石英毛细管柱 HP-FFAP (30 m×0.25 mm, 0.25 m), 程序升温: 从160℃开始, 以6℃/min升到250℃, 保持5min; 载气为 He, 柱流量1.0 mL/min,进样口温度 250℃, 分流比 50∶1。质谱条件: EI 源; 电离电压70 eV, 离子源温度230℃, 扫描范围10—500 amu,进样量 1.0 μL。
1.6 富油微藻的分子鉴定
取处于对数生长期的藻液离心后弃去上清, 藻泥置于微量离心管中, 使用PlantGen DNA Kit (北京康为世纪生物科技有限公司)按照说明书提取并纯化藻株基因组DNA。
PCR扩增: 藻株1C4参考文献[5]的方法扩增LSU序列, 引物序列为: Forward 5′-AGCGGAGGAAAAGAAAC TA-3′; Reverse 5′-TACTAGAAGGTTCGATTAGTC-3′; 藻株11B7参考文献[10]的方法扩增其ITS1、5.8S rDNA及ITS2 全序列, 引物序列为: Forward 5′-GAAGTCGTAACAA GGTTTCC-3′; Reverse 5′-TCCTGGTTAGTTTCTTTTCC-3′。PCR 反应体积为 25 μL, 包括 DNA 模板 1 μL, TaKaRaTaq酶 0.2 μL (1U), 引物(浓度为 10 μmol/L)各 1 μL、dNTP(浓度为 2.5 mmol/L)2 μL、10×buffer (Mg2+Plus)2.5 μL,ddH2O 17.3 μL。扩增反应在Takara-TP600型PCR仪上进行, PCR扩增产物以0.8%琼脂糖凝胶电泳检测, 进一步纯化后送至上海生工生物工程技术服务有限公司测序, 所获得的基因序列在 NCBI 服务器上 (http://www.ncbi.nih.gov) 用BLAST 进行同源检测。
进化树的构建: 根据同源检测结果, 从NCBI上下载相关的序列, 应用 ClustalX1.83 软件进行多序列比对;通过MEGA5以邻接法(Neighbor-Joining Method, NJ)构建系统发育树。
2 结果
2.1 水样采集及微藻分离
于海口周边采集淡水水样约60份, 经涂布分离法初步得到藻种 300株, 通过细胞形态及尼罗红染色的情况从中初步筛选出15株具有产油潜力的藻株, 进行复筛。
2.2 藻株的复筛及产油潜力评价
对通过初筛后的藻株进行复筛(表 1), 可见, 有些微藻的油脂含量较高, 但生物量不高, 如 10C7, 油脂含量高达45.09%, 但生物量仅有0.67 g/L; 反之, 一些生物量较高的藻含油量却比较低, 如10F6, 生物量高达1.58 g/L,但油脂含量仅为 18.02%。因此, 应该综合生物量和油脂含量来考察藻株产油性能, 该指标称为总脂收获量, 即微藻总脂含量与生物量的乘积, 表示实际收获的油脂量。复筛过程中总脂收获量超过0.45 g/L的藻株有1C4、2H4、1H8、11B7, 它们分别高达0.66、0.49、0.45和0.59 g/L。
2.3 富油微藻的脂肪酸成分分析
1C4、2H4、1H8、11B7四种富油微藻的脂肪酸成分及其相对含量(表2)。
目前的高速柴油机燃料的十六烷值约为 40—56,大多数的柴油机可采用的十六烷值 40—45。棕榈酸(C16:0)甲酯、棕榈油酸(C16:1)甲酯、硬脂酸(C18:0)甲酯和油酸(C18:1)甲酯的十六烷值分别为 85.9、51.0—59.59、101和56.55—59.3[11], 均高于国内及国际上主要国家现行的生物柴油标准十六烷值(>45—51)[12]。由表3可知, 4种富油微藻中以上4种脂肪酸含量达到了43.52%—77.56%, 其中以1H8最高。在4株富油微藻中, 总脂收获量最大的 1C4, 但其脂肪酸的总体不饱和程度较高(二烯酸和三烯酸的含量超过了总脂的46%)。适量的不饱和脂肪酸会增加生物柴油低温下的流动性, 但过量又会降低生物柴油的稳定性[13], 因此选择该藻作为生物柴油来源时, 需加入抗氧化剂以提升其抗氧化性能。另外11B7和1H8的总脂收获量虽次于1C4, 但二者脂肪酸不饱和程度低(C18:1的含量均远远高于1C4), 因此抗氧化性能更好。值得注意的是, 2H4中还含有一定量的 EPA(二十碳五烯酸), 在生产生物柴油的同时还可开发高价值副产物。
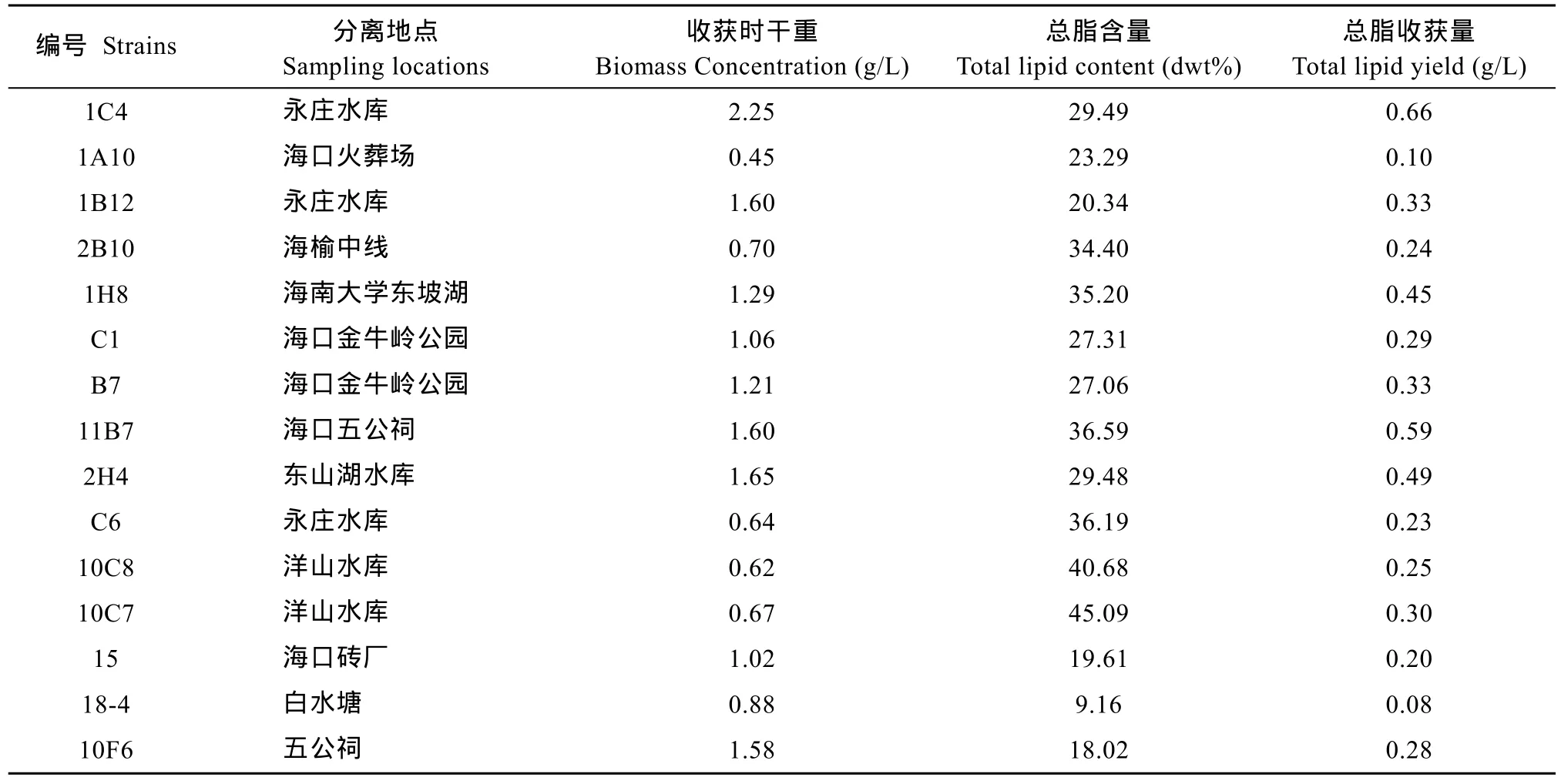
表1 15株微藻的收获时干重与总脂收获量比较Tab.1 Biomass concentration, lipid content and lipid yield of 15 microalgal strains
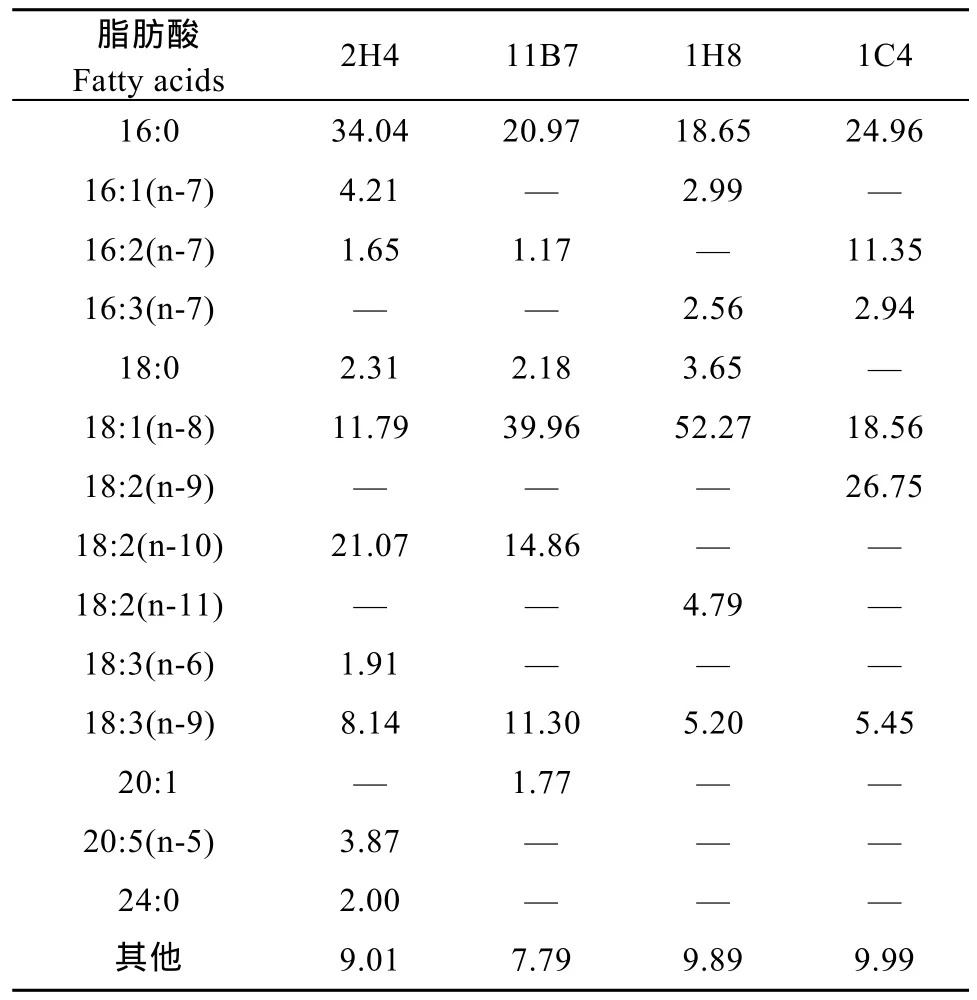
表2 四种富油微藻的脂肪酸成分Tab.2 Fatty acid composition of several microalgal strains
2.4 两株富油微藻的鉴定
富油微藻1C4和11B7的基因组DNA经提取纯化后,PCR分别得到 1C4的 LSU片段和 11B7的 ITS1、5.8S rDNA、ITS2的部分片段, 其大小分别约为 850和 1500 bp。经BLAST分析结果表明, 1C4的LSU片段DNA序列分别同 EU410621.1Chlamydomonas reinhardtii、DQ373067.1C.incerta的部分片段相似度高达 98%和99%, 11B7的ITS1、5.8S rDNA及ITS2序列片段同GQ 375101.1Hariotina reticulata、JN703736.1pectinatus的部分片段相似度高达97%和91%。综合序列比对、系统进化树(图1、图2)、二者显微形态(图3)等结果, 初步确定1C4和11B7分别属于衣藻属和空星藻属。
3 讨论
3.1 富油微藻的筛选
在自然界中存在大量性能优越的微藻可作为生物柴油、饵料或高价值活性成分的来源。如雨生红球藻可积累较高含量的虾青素, 硅藻中富含多不饱和脂肪酸, 螺旋藻中富含藻胆蛋白[14]等。在能源危机的推动下, 目前各国大力发展的生物柴油已成为国际上发展最快、应用最广的环保型可再生能源。微藻作为生物柴油的一种理想来源,重点是选择一种合适的藻种作为生物柴油原材料[15]。本试验最终筛选出4株富油微藻, 总脂收获量均在0.45 g/L以上, 具有较高的产油潜力。
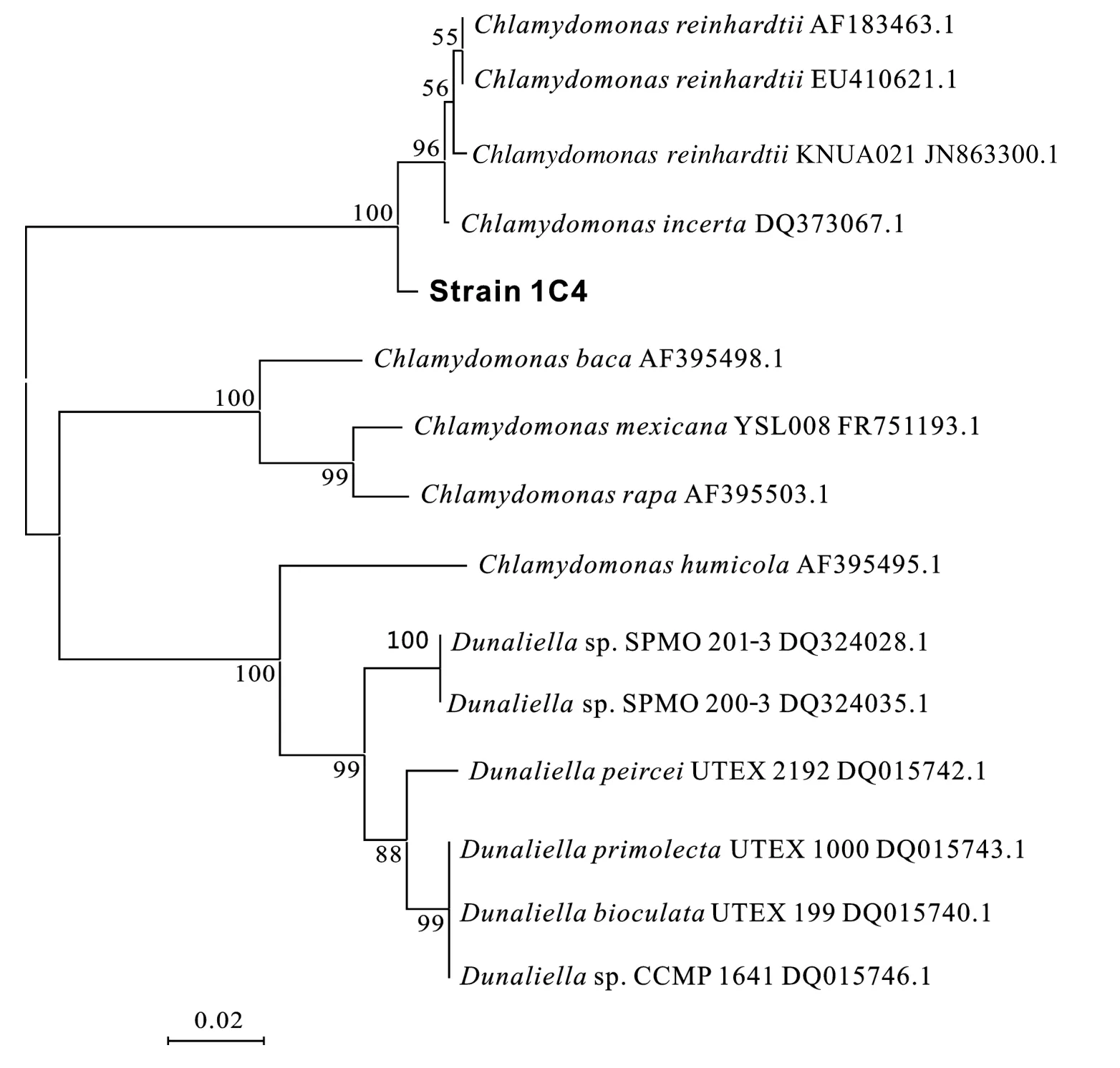
图1 藻株1C4系统发育树Fig.1 Phylogenetic tree of strain 1C4
目前, 微藻油脂的生产中存在较多限制, 这就导致了目前微藻生物柴油成本偏高。如何降低生产成本, 实现其商业化运作是解决微藻生物柴油产业化的重要问题。提高藻种油脂收获量或生产高价值副产物是降低微藻生物柴油成本较为理想的途径。本文自热带淡水水体中分离出约 300株微藻并通过尼罗红染色法初筛, 再以初筛所得15株具有产油潜力的藻株作为研究对象, 设置相同的培养条件, 比较它们的生长状况及最终油脂收获量, 筛选具有高效产油潜力的藻株。最终得到4株生长状况较好并且含油量在25%以上的藻种, 通过对其中1C4和11B7两株油脂收获量高于0.5 g/L的藻种进行分子鉴定, 初步确定二者分别属衣藻属和空星藻属。在培养过程中, 笔者还观察到11B7培养后期易沉降, 可充分利用这一点对其进行采收, 大大减少设备投入和能源消耗, 从而进一步降低微藻生物柴油的生产成本。
3.2 微藻的鉴定
传统的微藻鉴定方法主要依赖于光学显微镜, 即在显微镜下对微藻形态结构的观察和一些藻体所固有的生理生化特性。但是由于微藻细胞微小, 加之近缘种之间的形态差异非常不明显, 即使在显微镜下也很难确定其准确的分类地位[16]。近年来兴起的分子生物学方法通过选择有代表性的序列片段作为分类标准来区分不同生物、同种生物种内株系之间的遗传差异, 具有操作容易、结果可靠等优点, 被广泛用于赤潮藻类及其他微藻的鉴定和系统进化研究中[17]。核糖体RNA(rRNA)基因片段是在微生物的分子鉴定中常用的序列[18,19], 其中小亚基 rRNA(Small subunit rRNA, SSU rRNA)基因序列比大亚基rRNA(Large subunit, LSU rRNA)基因序列更为保守, 因此更适于分析亲缘关系较远的藻株, 相应地, LSU rRNA基因序列就更适用于分析亲缘关系较近的藻株, 如同属的不同株系。此外还有线粒体DNA(mitochondria DNA)序列、质体DNA(plastid DNA, rbcL)序列、ITS(Internal Transcribed Sequences)序列及微卫星DNA(microsatellite DNA)序列等也可用于分子鉴定。本实验分别扩增出1C4的LSU序列及11B7的ITS1、5.8S rDNA及ITS2序列并在NCBI服务器上进行BLAST比对分析, 同时结合二者细胞形态对其进行鉴定, 具有较高的准确度和可信度。
4 结论
在自然界中微藻种质资源丰富, 其中以绿藻最易分离获得, 并能够快速生长。油脂含量测定及脂肪酸GC-MS分析结果显示本研究中所分离的富油绿藻中脂肪酸成分也富含适宜作为生物柴油来源的脂肪酸。基因片段序列BLAST分析、系统进化树构建并结合细胞形态分析两株高产油微藻, 初步确定二者分别属衣藻属和空星藻属。其中11B7培养后期易沉降, 因此可实现低成本采收。对于二者产油生理与生化机制、生长及产油条件的优化有待进一步研究, 以期微藻生物柴油产业化奠定良好的基础。
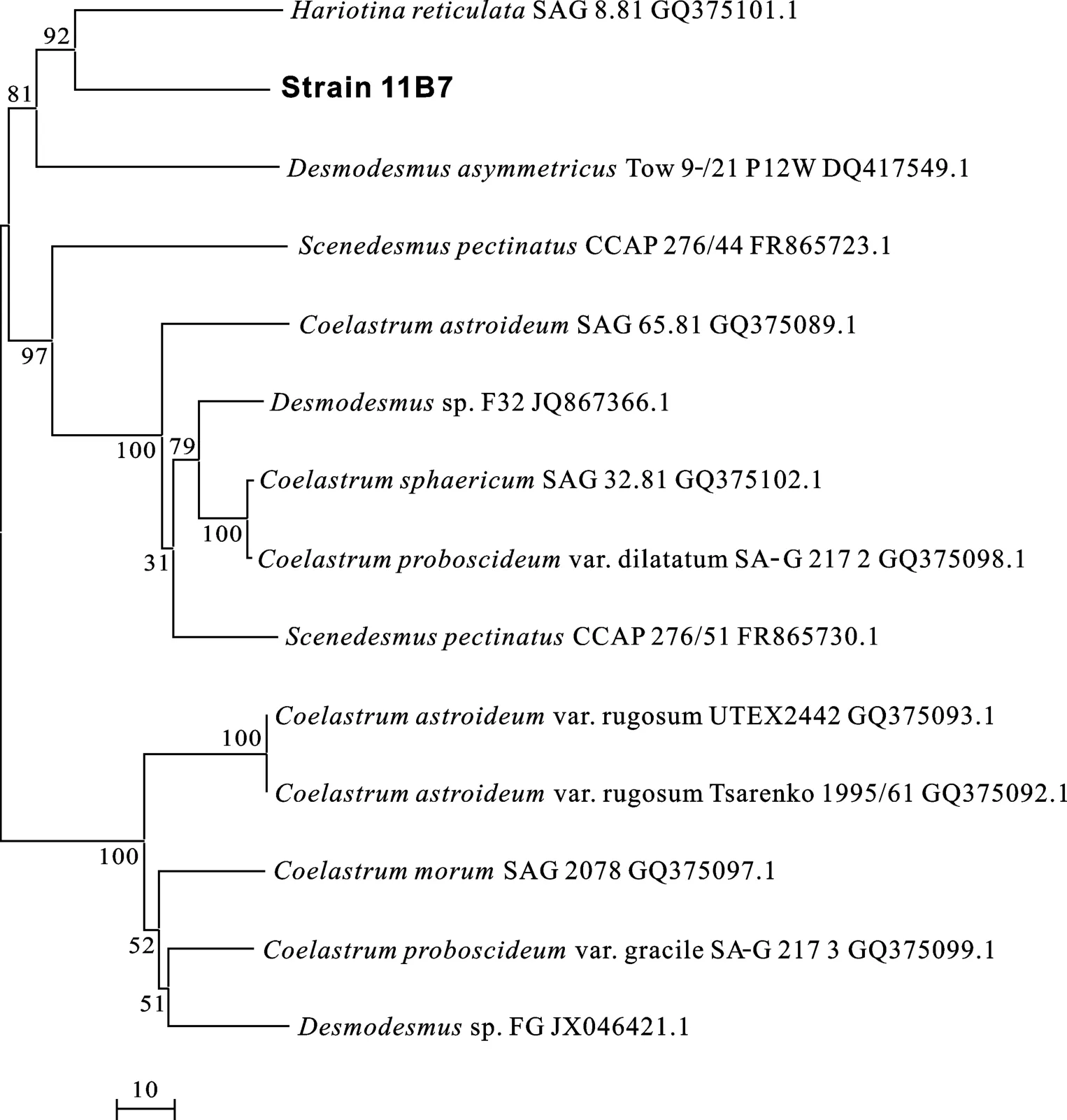
图2 藻株11B7系统进化树Fig.2 Phylogenetic tree of strain 11B7

图3 1C4(A) 和11B7的显微照片(400×)Fig.3 Microscopic photo of 1C4 (A) and 11B7(B)
[1] Brennan L, Owende P.Biofuels from microalgae—A review of technologies for production, processing, and extractions of biofuels and co-products [J].Renewable and Sustainable Energy Reviews, 2010, 14(2): 557—577
[2] Xu J, Xu X D, Fang X T,et al.Screening and lipid analyses of high oleaginousChlorellaspecies [J].Acta Hydrobiologica Sinica, 2012, 36(3): 426—432 [徐进, 徐旭东, 方仙桃, 等.高产油小球藻的筛选及其油脂分析.水生生物学报, 2012, 36(3): 426—432]
[3] Rodolf i L, Zittelli G C, Bassi N,et al.Microalgae for oil:strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor [J].Biotechnology and Bioengineering, 2009, 102(1): 100—112
[4] Thi T Y D, Sivaloganathan B, Obbard J P.Screening of marine microalgae for biodiesel feedstock [J].Biomass and Bioenergy, 2011, 35(7): 2534—2544
[5] Abou-Shanab R A I, Hwang J H, Cho Y,et al.Characterization of microalgal species isolated from fresh water bodies as a potential source for biodiesel production [J].Applied Energy, 2011, 88(10): 3300—3306
[6] He G Q, Deng Z P, Tao L,et al.Screen and fermentation optimization of microalgaes with high lipid productivity [J].Journal of Agricultural Biotechnology, 2010, 18(6): 1046—1053 [贺国强, 邓志平, 陶丽, 等.高油脂产率微藻的筛选及发酵条件的优化.农业生物技术学报, 2010, 18(6):1046—1053]
[7] Robert A.Andersen.Algae Culturing Techniques [M].Elsevier Academic Press.USA.2005, 92—94.
[8] Xu J, Zhang C W, Li A F,et al.Isolation and selection of freshwater microalgae for oil production in south China [J].Renewable Energy Resources, 2011, 29(1): 66—71 [许瑾,张成武, 李爱芬, 等.华南地区淡水产油微藻藻株的分离与筛选.可再生能源, 2011, 29(1): 66—71]
[9] Wang C N, Liu P H, Liang Z Y,et al.Optimization of oil Extraction fromGonocaryum lobbianum(Merr.) Kurz fruit and analysis of its fatty acids [J].Fine Chemicals, 2011,28(9): 861—865, 908 [汪春牛, 刘平怀, 梁振益, 等.琼榄果实油提取工艺优化及其脂肪酸成分分析.精细化工,2011, 28(9): 861—865, 908]
[10] Timmins M, Thomas-Hall S R, Darling A,et al.Phylogenetic and molecular analysis of hydrogen-producing green algae [J].Journal of Experimental Botany, 2009, 60(6): 1691—1702
[11] Knothe G.“Designer” biodiesel: optimizing fatty ester composition to improve fuel properties [J].Energy and Fuels,2008, 22: 1358—1364
[12] Luo W, Yuan Z H, Liao C P.Biodiesel standard and quality assessment [J].Renewable Energy, 2006, 128(4): 33—37 [罗文, 袁振宏, 廖翠萍.生物柴油标准及质量评价.可再生能源, 2006, 128(4): 33—37]
[13] Li X B, Xu X D, Kong R Q.Studies on the production of oil and polyunsaturated fatty acidsinfive species of Nannochloropsis [J].Acta Hydrobiologica Sinica, 2010, 34(5):893—897 [李秀波, 徐旭东, 孔任秋.五种微绿球藻产油和产多不饱和脂肪酸的研究.水生生物学报, 2010, 34(5):893—897]
[14] Grima E M, Belarbi E H, Acién Fernández F G,et al.Recovery of microalgal biomass and metabolites: process options and economics [J].Biotechnology Advances, 2003, 20(7-8):491—515
[15] Zheng H L, Zhang Q, Ma X C,et al.Research progress on biodiesel-producing microalgae cultivation [J].China Biotechnology, 2009, 29(3): 110—116 [郑洪立, 张齐, 马小琛,等.产生物柴油微藻培养研究进展.中国生物工程杂志,2009, 29(3): 110—116]
[16] Shen X.Preliminary study on the isolation and identification of marine microalgae [D].Thesis for Master of Science,Ocean University of China.2011 [沈雄.海洋微藻的分离及鉴定方法的初步研究.硕士学位论文, 中国海洋大学, 青岛.2011]
[17] Zheng J B, Zhang F Y, Ma L B,et al.PCR identification of two alien invasive species of red tide algae [J].Marine Fisheries, 2009, 31(3): 325—329 [郑俊斌, 张凤英, 马凌波, 等.两种常见外来入侵赤潮藻的 PCR鉴定.海洋渔业, 2009,31(3): 325—329]
[18] Mutanda T, Ramesh D, Karthikeyan S,et al.Bioprospecting for hyper-lipid producing microalgal strains for sustainable biofuel production [J].Bioresource Technology, 2011, 102(1):57—70
[19] Rasoul-Amini S, Ghasemi Y, Morowvat M H,et al.PCR amplif i cation of 18S rRNA, single cell protein production and fatty acid evaluation of some naturally isolated microalgae [J].Food Chemistry, 2009, 116(1): 129—136
