牛蛙变态发育前后消化道内分泌细胞的变化
2013-07-24周乃珍朱红年张盛周
郭 慧 周乃珍 赵 帅 王 琛 朱红年 张盛周
(安徽师范大学生命科学学院, 芜湖 241000)
消化道内分泌细胞散在分布于消化道黏膜中, 其分泌的多种胃肠激素具有调节消化吸收过程、保护胃肠黏膜和控制动物摄食行为等多项生理作用[1,2]。目前, 对脊椎动物消化道内分泌细胞已进行了广泛而深入的研究, 发现了 30多种类型的内分泌细胞[1]。应用免疫组织化学方法对两栖动物消化道内分泌细胞进行研究, 也有不少报道, 共检测到了 10多种内分泌细胞[3—8]。研究表明[9—12],动物消化道内分泌细胞的种类和分布型是长期进化过程中对特殊食性适应的结果, 同时受诸如食物成分、环境条件和病理变化等多种因素的影响。
无尾两栖动物变态前后食性和消化机能发生了较大的变化, 消化器官亦发生复杂的重塑[13,14], 有关这一重塑过程中消化道的组织学和细胞学变化有不少报道, 但这些研究主要集中在对消化道上皮细胞的凋亡和消化道各组织层的变化方面[13,14], 对消化道内分泌细胞的变化研究较少[15—18]。牛蛙(Rana catesbeiana)隶属两栖纲无尾目, 是一种大型蛙, 营养价值较高, 自 1959年我国从古巴引进牛蛙以来, 已在 20多个省(区)进行人工养殖或野生放养。我们曾对其成体消化道内分泌细胞的分布进行了研究[3], 其变态发育前后消化道内分泌细胞的变化尚未见报道。本文应用免疫组织化学方法对牛蛙变态发育前后消化道 5-羟色胺(5-HT)、生长抑素(SS)、胃泌素(GAS)、胰高血糖素(GLU)和胰多肽(PP)免疫阳性(IR)细胞的分布密度、组织定位和形态的变化进行了研究, 旨在增进对两栖动物变态发育过程中消化道内分泌细胞演变规律的认识。同时, 为研究不同发育阶段牛蛙的消化机能积累资料。
1 材料与方法
1.1 试验材料
牛蛙蝌蚪取自芜湖市南陵县仙坊镇牛蛙养殖场, 参照L'Hermit,et al.[15]的方法, 根据附肢的发育及尾部的变化情况,分成三个变态发育阶段: (1)变态前期(Prometamorphosis stage, Pro-MS): 后肢发育完全, 前肢芽开始出现; (2)变态高峰期(Metamorphic climax stage, MCS): 四肢发育完全, 尾部开始消退; (3)变态后期(Postmetamorphosis stage, Post-MS): 变态完成, 开始捕食, 胃中有食物。每个发育阶段取材6只。
分别取出变态前期、变态高峰期和变态后期蝌蚪的完整消化道, 按消化道不同部位取材: 食管、贲门、胃体、幽门、肠前段、肠中段、肠后段。生理盐水洗净, 立即放入无冰醋酸的 Bouin’s液固定 24—48h, 常规脱水透明,石蜡包埋, 切片, 厚6 μm, 贴片。
1.2 主要试剂
5种胃肠激素抗血清(表 1)。链霉菌抗生物素蛋白-过氧化物酶(Streptavidin peroxidase, S-P)免疫组织化学试剂盒(SP-9001)购于北京中山生物技术公司。
1.3 免疫组织化学染色方法
常规石蜡切片脱蜡至水, 3% H2O2甲醇溶液孵育15min, 消除内源性过氧化物酶活性。蒸馏水浸洗, PBS浸泡 5min, 滴加正常山羊血清(1∶10)室温孵育 10min, 封闭非特异性反应部位。倾去血清, 滴加一抗, 4℃过夜。PBS浸洗5min×3次, 滴加即用型生物素标记的二抗(均为羊抗兔IgG抗血清), 室温孵育1.5h。PBS浸洗5min×3次,滴加即用型链霉菌抗生物素蛋白-过氧化物酶, 室温孵育1h。PBS浸洗5min×3次, DAB-H2O2显色, 苏木精复染, 自来水洗净。脱水、透明、封片。免疫组织化学阴性对照, 分别用正常山羊血清和PBS代替一抗, 其余步骤同上。
1.4 数据统计与分析
在奥林巴斯 BX61型显微镜下观察拍照, 并对每个部位的切片随即取10个400倍视野进行计数, 取平均值(±SD), 表示内分泌细胞的分布密度, 并用数据处理软件SPSS 11.5对内分泌细胞的密度变化情况进行统计学处理。当P<0.05时差异显著,P<0.01时差异非常显著, 具有统计学意义。
2 结果
在光镜下, 经染色的切片背景呈淡蓝色, 免疫反应阳性细胞呈棕黄色或深棕色, 核淡蓝色或被遮住。阴性对照切片呈淡蓝色, 未见免疫反应阳性细胞。5种内分泌细胞在变态发育前后牛蛙消化道各部位的分布密度及其变化(表2)。
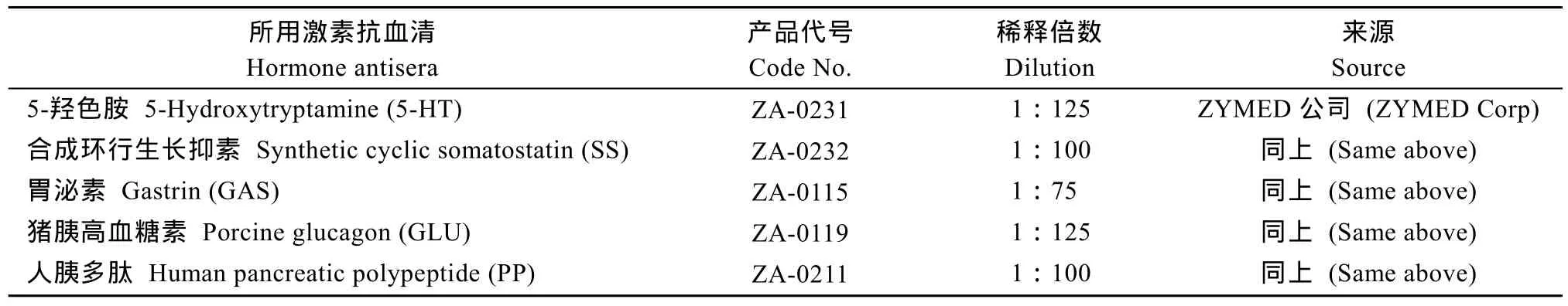
表1 胃肠激素抗血清一览表Tab.1 Details of the gut hormone antisera
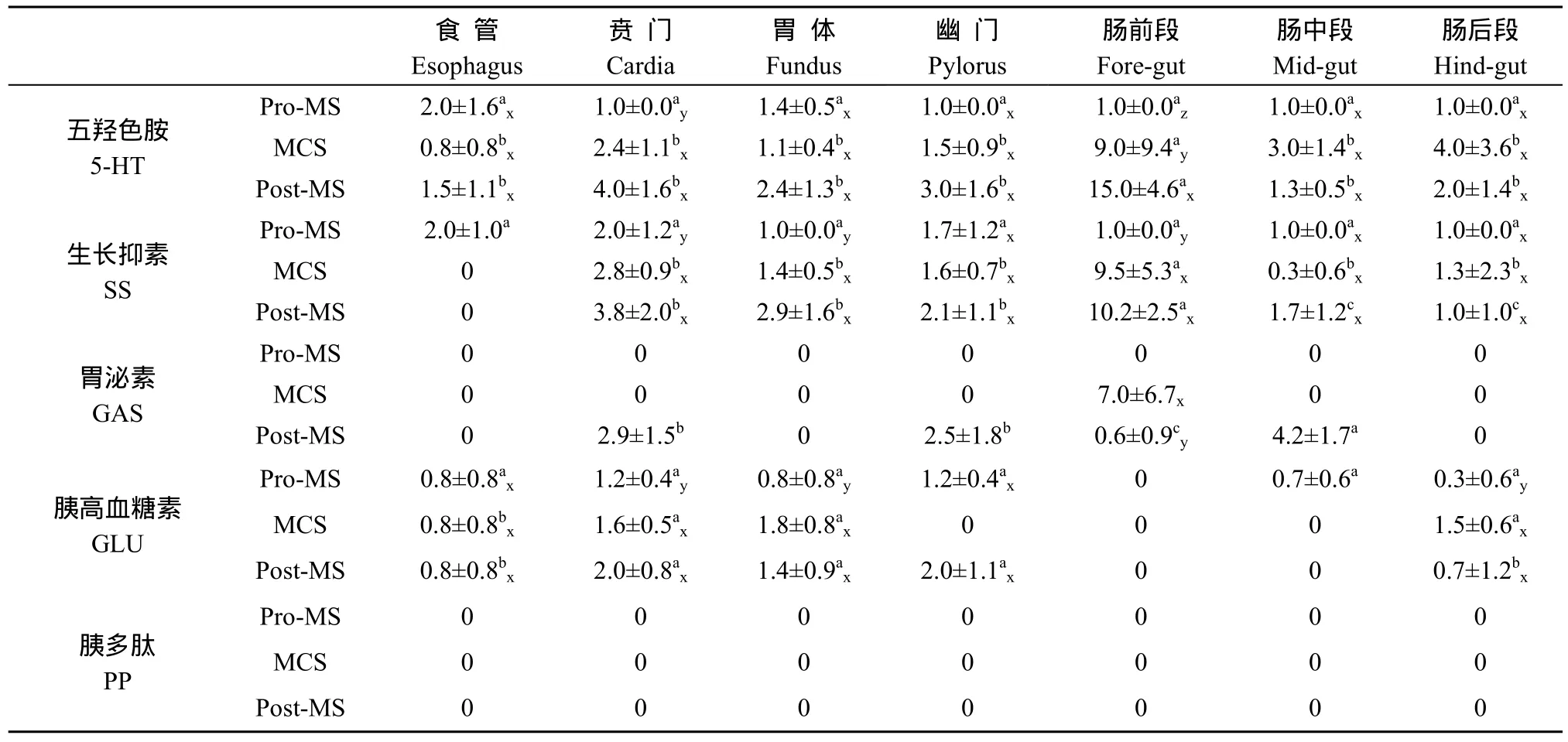
表2 牛蛙变态发育前后消化道内分泌细胞分布密度的变化Tab.2 Distribution density of endocrine cells in the digestive tract in Rana catesbeiana during metamorphosis (cells/400× field, mean±SD)
2.1 5-HT-IR细胞
5-HT-IR细胞在变态前期已出现, 消化道各段均有分布, 且各段分布密度无显著性差异。变态高峰期和变态后期, 5-HT-IR细胞亦在消化道各段均有分布, 但贲门和前肠 5-HT-IR细胞密度显著增加(P<0.01), 变态后期, 前肠 5-HT-IR细胞密度继续显著增加(P<0.01)。变态前期,消化道各段黏膜上皮均为单层柱状上皮, 5-HT-IR细胞主要位于上皮细胞之间, 少数位于上皮基部, 细胞染色深,多数细胞具有胞突, 且胞突较长(图版Ⅰ-1、2)。变态高峰期, 消化道各段黏膜上皮均为单层柱状上皮, 胃 5-HT-IR细胞位于上皮基部或胃腺固有层中, 食管和肠道5-HT-IR细胞主要位于上皮细胞之间。细胞中心的阳性反应明显较弱, 多数细胞没有胞突, 少数细胞有较短的胞突(图版Ⅰ-3、4)。变态后期, 食管黏膜上皮为假复层柱状纤毛上皮, 胃和肠道黏膜上皮为单层柱状上皮, 胃5-HT-IR细胞主要位于胃腺部, 上皮中偶见, 食管和肠道5-HT-IR细胞主要位于黏膜上皮细胞之间, 少数位于上皮基部。细胞染色变深, 多数细胞开始出现胞突, 胞突较变态前期短(图版Ⅰ-5、6)。
2.2 SS-IR细胞
SS-IR细胞在变态前期已出现, 消化道各段均有分布, 且各段分布密度无显著性差异。变态高峰期和变态后期, SS-IR细胞在除食管外的消化道各段均有分布, 且贲门、胃体和肠前段SS-IR细胞密度显著增加(P<0.01)。变态前期, SS-IR细胞主要位于上皮细胞之间, 固有层中偶见, 食管和胃部的 SS-IR细胞几乎都是锥形和梭形结构,有较长胞突(图版Ⅰ-7); 肠道 SS-IR细胞呈圆形和锥形。阳性细胞染色深。变态高峰期, 胃SS-IR细胞位于胃腺部,腺上皮细胞外围; 肠道SS-IR细胞位于上皮基部。阳性细胞胞突消失, 染色较浅(图版Ⅰ-8)。变态后期, 胃 SS-IR细胞位于胃腺部, 多数细胞开始出现较短的胞突, 伸向邻近细胞或细胞间隙(图版Ⅰ-9); 肠道 SS-IR细胞位于上皮基部, 呈圆形。阳性细胞染色较深。
2.3 GAS-IR细胞
GAS-IR细胞从变态高峰期才开始出现, 始于肠前段。变态后期, 分布于贲门、幽门、肠前段和肠中段, 以肠中段密度最高, 且肠前段 GAS-IR细胞密度显著减少(P<0.01)。变态高峰期, GAS-IR细胞位于上皮细胞之间和固有层中, 呈圆形, 细胞染色较浅(图版Ⅰ-10)。变态后期,贲门和幽门的GAS-IR细胞主要位于胃腺固有层中, 呈圆形、椭圆形(图版Ⅰ-11), 肠前段和肠中段的GAS-IR细胞主要位于上皮基部, 呈圆形(图版Ⅰ-12)。阳性细胞染色较深。
2.4 GLU-IR细胞
GLU-IR细胞在变态前期已出现。变态前期, GLU-IR细胞分布于除肠前段以外的消化道各段, 且分布密度无显著性差异。变态高峰期, GLU-IR细胞分布于食管、贲门、胃体和肠后段。变态后期, GLU-IR细胞分布于除肠前段和肠中段以外的消化道各段。变态高峰期, 贲门、胃体和肠后段的GLU-IR细胞密度显著增加(P<0.05)。变态前期, GLU-IR细胞位于上皮细胞之间, 食管和胃GLU-IR细胞呈圆形或梭形, 其一端具有较长的胞突伸向消化道腔(图版Ⅰ-13); 肠道GLU-IR细胞呈圆形。阳性细胞染色较深。变态高峰期, 食管和肠道GLU-IR细胞位于上皮基部, 胃GLU-IR细胞位于胃腺部, 腺泡上皮细胞外围。阳性细胞胞突消失, 染色较浅(图版Ⅰ-14)。变态后期, 食管和肠道GLU-IR细胞位于上皮基部, 呈圆形。胃GLU-IR细胞位于胃腺部, 多数细胞开始出现胞突, 胞突较变态前期短。阳性细胞染色较深(图版Ⅰ-15)。
2.5 PP-IR细胞
PP-IR细胞在牛蛙变态发育的各个时期消化道中均未检测出。
3 讨论
5-HT、SS、GAS、GLU和PP-IR细胞等属脊椎动物消化道内 5种重要胃肠激素内分泌细胞, 我们曾对其在成体牛蛙消化道中的存在与分布作了鉴定和定位[3], 本研究显示这些内分泌细胞的分布密度和形态在变态发育前后发生了明显的变化。
3.1 内分泌细胞分布密度的变化
5-HT、SS、GAS和GLU-IR细胞广泛分布于各类两栖动物成体消化道中[3—8]。Bodegas,et al.[16]和 Villaro,et al.[17]分别在变态前期蛙蝌蚪前肠和胃中检测到了5-HT、SS和GLU-IR细胞。Maake,et al.[18]在非洲爪蟾(Xenopus laeuis)变态发育前期消化道检测到 SS和 GLU-IR细胞,本研究在牛蛙变态发育前期消化道中检测出5-HT、SS和GLU-IR细胞, 可见, 5-HT、SS和GLU-IR细胞在两栖动物消化道发育中出现较早。GAS-IR细胞在牛蛙变态高峰期才出现, 潘红珍等[19]研究中华蟾蜍(Bufo gargarizans)变态发育时发现, GAS-IR细胞在幼蟾期才出现, Villaro,et al.[17]在变态前期时蛙(Rana temporaria)胃中未检测到GAS-IR细胞, 可见, GAS-IR细胞在两栖动物消化道发育中出现较迟且出现的时期存在种间差异。PP-IR细胞在两栖类消化道的分布有较大种间差异, 不同的研究者分别在棘胸蛙(Paa spinosa)[4]、红腹铃蟾(Bombina bombina)[5]和豹蟾(Bufo regularis)[6]消化道中检出了 PP-IR细胞, 而黄徐根等[7]在日本林蛙(Rana japonica japonica)消化道未检测到PP-IR细胞, Buchan[8]在其研究的各类两栖动物消化道中均未发现PP-IR细胞, 张盛周等[3]在牛蛙消化道亦未发现PP-IR细胞。本研究在牛蛙变态发育的各个时期均未检测到PP-IR细胞, 显示PP-IR细胞在牛蛙消化道中可能无组织发生。
Maake,et al.[18]研究发现非洲爪蟾消化道 SS和GLU-IR细胞的分布密度随着变态发育的进行而逐渐增加,本研究表明牛蛙消化道SS和GLU-IR细胞在变态高峰期后显著增多, 与非洲爪蟾相一致。本研究还发现变态前期,5-HT、SS和GLU-IR细胞在消化道各段分布密度无显著性差异, 变态高峰期, 3种内分泌细胞的分布型发生了明显变化, 变态高峰期之后内分泌细胞的分布型与牛蛙成体基本一致[3], GAS-IR细胞在变态高峰期开始出现。可见, 牛蛙消化道内分泌细胞的分布型在变态高峰期发生了重塑。
对哺乳动物的研究表明, 改变食物组成成分可以影响消化道内分泌细胞的分布型[10], 动物消化道内分泌细胞的分布型可能是在长期进化过程中对特殊食性适应的结果[12]。我们通过与文献报道的不同食性动物消化道内分泌细胞的分布型比较发现, 变态前期, 牛蛙消化道5-HT-IR 细胞的分布型与杂食性中国对虾(Penaeus chinensis)[20]和鲻鱼(Mugil cephalus)[21]相似, SS-IR细胞的分布与杂食性的鲻鱼[21]相似, GLU-IR细胞的分布与草食性鱼类相似[22]。变态后期, 牛蛙消化道SS-IR细胞的分布与肉食性的日本鳗鲡(Anguilla japonicus)[23]相似。GAS-IR细胞的分布与肉食性的日本鳗鲡[23]、黑鲷(Sparus macrocephalus)[24]、花鲈(Lateolabrax japonicus)[25]相似。牛蛙变态发育过程中食性会发生明显变化, 变态前期, 蝌蚪以浮游植物和浮游动物为食, 属植食性或杂食性; 变态高峰期, 停止进食; 变态后期, 幼蛙主要以昆虫、蚯蚓、田螺、蟹、小鱼、小虾等为食, 属肉食性。可见, 牛蛙变态发育前后消化道内分泌细胞分布型的变化与其食性改变是相适应的。
3.2 内分泌细胞的形态学变化
根据细胞形态学特征, 现一般将消化道内分泌细胞分为开放型和闭合型两大类[2]。开放型内分泌细胞有较长的细胞质突起伸向消化腔, 可感受消化腔内容物的刺激而分泌; 闭合型内分泌细胞没有胞突, 与消化腔无直接联系, 主要感受局部组织内环境变化的刺激而分泌。本研究显示牛蛙消化道5-HT、SS和GLU-IR细胞多为开放型,GAS-IR细胞则多属闭合型。本研究还发现变态前期内分泌细胞胞突较长, 细胞染色较深; 变态高峰期, 多数细胞没有胞突或有较短的胞突, 细胞染色较浅; 变态后期, 多数细胞开始出现胞突, 细胞染色较深。变态前期, 蝌蚪正常进食, 内分泌细胞可通过胞突感受消化腔内容物刺激而合成较多分泌物; 变态高峰期, 蝌蚪停止进食, 内分泌细胞功能活动降低; 变态后期, 幼蛙恢复进食, 内分泌细胞开始恢复行使其功能。可见, 不同发育时期, 牛蛙消化道内分泌细胞形态变化与其消化生理状态是相适应的。
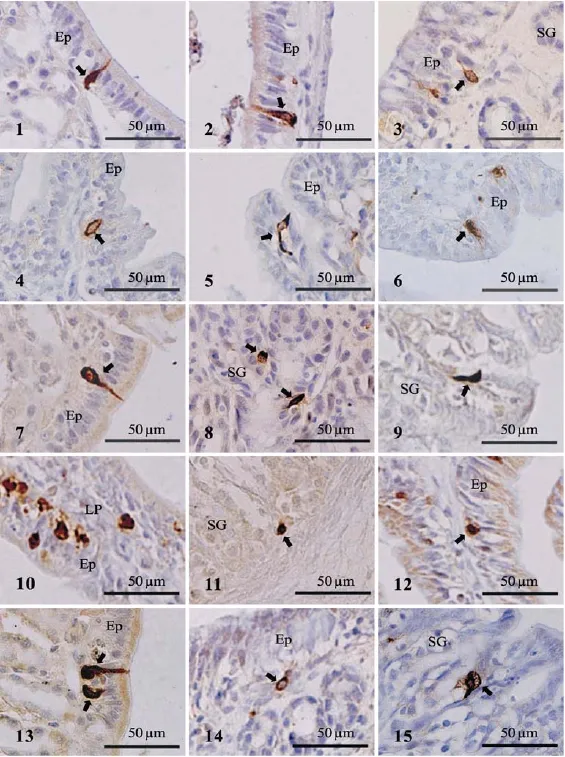
图版Ⅰ PlateⅠ
[1] Nelson L E, Sheridan M A.Gastroenteropancreatic hormones and metabolism in fish [J].General and Comparative Endocrinology, 2006, 148(2): 116—124
[2] Liu Y, Tytgat G N J, Xiao S D,et al.Gastric endocrine cells[J].Chinese Journal of Digestive Diseases, 2003, 4(4): 160—167
[3] Zhang S Z, Xue L H, Tao S W.Immunohistochemical identification and localization of endocrine cells in the Gastrontero-pancreatic system of bullfrogRana catesbeiana[J].Acta Laser Biology Sinica, 2008, 17(5): 689—694 [张盛周,薛立辉, 陶少武.牛蛙胃肠胰系统内分泌细胞的免疫组织化学鉴定与定位.激光生物学报, 2008, 17(5): 689—694]
[4] Zhang S Z, Huang X G, Wu X B.Immunohistochemistry of endocrine cells in the digestive tract ofPaa spinosa[J].Acta Zoologica Sinica, 2003, 49(6): 858—864 [张盛周, 黄徐根,吴孝兵.棘胸蛙消化道内分泌细胞的免疫组织化学定位.动物学报, 2003, 49(6): 858—864]
[5] Ku S K, Lee H S, Lee J H.An immunohistochemical study of endocrine cells in the alimentary tract of the red bellied frog,Bombina orientalis[J].Journal of Veterinary Medical Science, 2000, 62(6): 589—594
[6] El-Salhy M, Grimelius L, Wilander E,et al.Histological and immunohistochemical studies of the endocrine cells of the gastrointestinal mucosa of the toad (Bufo regularis) [J].Histochemistry, 1981, 71(1): 53—65
[7] Huang X G, Wu X B.Immunohistochemical localization of endocrine cells in the gastrointestinal tract of Mt.Wuyi cascade-frog (Amolops wuyiensis) [J].Acta Hydrobiologica Sinica, 2007, 31(2): 162—168 [黄徐根, 吴孝兵.武夷湍蛙胃肠道内分泌细胞的免疫组织化学定位.水生生物学报,2007, 31(2): 162—168]
[8] Buchan A M J.An Immunocytochemical study of regulatory peptides in the amphibian gastrointestinal tract [J].Canadian Journal of Zoology, 1986, 64(1): 1—7
[9] Ku S K, Lee H S, Byun J S,et al.Changes of the gastric endocrine cells in the C57BL/6 mouse after implantation of murine lung carcinoma: an immunohistochemical quantitative study [J].World Journal of Gastroenterology, 2005,11(9): 1317—1323
[10] Lin X, Lin S G, Wang Q X,et al.Study on the histochemical property of the mast cells in the digestive tract of nile tilapia[J].Acta Hydrobiologica Sinica, 2011, 35(1): 132—137 [林旋, 林树根, 王全溪, 等.尼罗罗非鱼消化道肥大细胞的组化性质.水生生物学报, 2011, 35(1): 132—137]
[11] Zhang X B, Liang X F, Zhu T,et al.The digestive tube development and the activity distribution of three kinds of digestive enzymes ofCtenopharyngodon idellusfed on different diets [J].Acta Hydrobiologica Sinica, 2012, 36(3): 569—572 [张杏波, 梁旭方, 朱滔, 等.食性对草鱼消化道发育及三种消化酶活性的影响.水生生物学报, 2012, 36(3):569—572]
[12] Ruan G L, Yang D Q, Wang W M.Ontogeny of the digestive tracts in grass carp (Ctenopharyngodon idellus), yellowcheck carp (Elopichthys bambusa) and topmouth culter (Culteralburnus) [J].Acta Hydrobiologica Sinica, 2012, 36(6):1164—1170 [阮国良, 杨代勤, 王卫民.草 鱼、鳡 和 翘嘴鲌消化道组织的早期发育.水生生物学报, 2012, 36(6):1164—1170
[13] Amano T.Isolation of genes involved in intestinal remodeling during anuran metamorphosis [J].Wound Repair and Regeneration, 1998, 6(4): 302—313
[14] Schreiber A M, Cai L, Brown D D.Remodeling of the Intestine During Metamorphosis ofXenopus laevis[J].Developmental Biology, 2005, 102(10): 3720—3725
[15] L'Hermite A, Hourdry J, Ferrand R.Investigations of endocrine cells in the gastrointestinal tract and pancreas during the metamorphosis of an anuran (Alytes obstetricansL.):Histochemical detection of APUD cells [J].General and Comparative Endocrinology, 1988, 69(3): 381—390
[16] Bodegas M E, Villaro A C, Burrell M A,et al.An immunocytochemical and ultrastructural of the larval anterior intestine of the frogRana temporaria, with especial reference to endocrine cells [J].Tissue and Cell, 1997, 29(5): 549—559
[17] Villaro A C, Rovira J, Bodegas M E,et al.Immunocytochemical and ultrastructural characterization of endocrine cells in the larval stomach of the frogRana temporariatadpoles: A comparison with adult specimens [J].Tissue and Cell, 2001, 33(5): 462—477
[18] Maake C, Hanke W, Reinecke M.An Immunohistochemical and morphometric analysis of insulin, insulin-like growth factor I, glucagon, somatostatin, and PP in the development of the gastro-entero-pancreatic system ofXenopus laevis[J].General and Comparative Endocrinology, 1998, 110(2):182—195
[19] Pan H Z, Chen H H, Li Y,et al.Developmental changes of endocrine cells in the digestive tract inBufo gargarizansduring metamorphosis [J].Acta Anatomica Sinica, 2010,41(4): 571—577 [潘洪珍, 陈洪洪, 李洋, 等.中华蟾蜍变态发育过程中消化道内分泌细胞的演变.解剖学报, 2010,41(4): 571—577]
[20] Chen H H, Zhu L J, Pan H Z,et al.Identification and comparison of endocrine cells in the gastrointestinal tract ofPenaeus chinensisandMacrobrachium nipponensis[J].Acta Hydrobiologica Sinica, 2010, 34(3): 642—646 [陈洪洪, 朱联九, 潘红珍, 等.中国对虾和日本沼虾胃肠道内分泌细胞的鉴别与比较.水生生物学报, 2010, 34(3): 642—646]
[21] Fang Y Q, Weng Y Z, Hu X X,et al.Immunohistochemical localization of endocrine cells in gastrointestinal tract ofMugil cephalus[J].Journal of Fisheries of China, 2002,26(6): 481—485 [方永强, 翁幼竹, 胡晓霞, 等.鲻鱼胃肠道内分泌细胞免疫组织化学的定位.水产学报, 2002,26(6): 481—485]
[22] Pan Q S, Fang Z P, Zhu B K,et al.Immunohistochemical study on L cells in the gut of four kinds of stomachless teleost [J].Acta Anatomica Sinica, 1995, 26(1): 81—84 [潘黔生, 方之平, 朱邦科, 等.四种无胃真骨鱼肠道 L细胞的免疫组织化学研究.解剖学报, 1995, 26(1): 81—84]
[23] Lin S G, Wu D F, Wang S K.Location and identification of endocrine cells in the Gastro-entero-pancreas ofAnguilla japonicus[J].Journal of Fisheries of China, 2003, 27(6):513—518 [林树根, 吴德峰, 王寿昆.日本鳗鲡胃肠胰内分泌细胞的鉴别与定位.水产学报, 2003, 27(6): 513—518]
[24] Lin S G, Yang Z F, Wang S K.Localization of immunohistochemistry of endocrine cells in the digestive tract ofSparus macrocephalus[J].Journal of Fujian Agriculture and Forestry University, 2006, 35(1): 77—81 [林树根, 杨志峰,王寿昆.黑鲷消化道内分泌细胞免疫组织化学的定位.福建农林大学学报, 2006, 35(1): 77—81]
[25] Lin S G, Huang X H, Wu D F.Localization and identification of endocrine cells in the alimentary canal ofLateolabrax japonicus[J].Acta Hydrobiologica Sinica, 2005, 29(1): 7—12 [林树根, 黄小华, 吴德峰.花鲈消化道内分泌细胞的鉴别和定位.水生生物学报, 2005, 29(1): 7—12]
