环孢菌素A生产菌原生质体转化系统的建立
2013-07-18郑桂珍
戴 梦,刘 静,赵 颖,张 佳,章 丽,郑桂珍
(华北制药集团新药研究开发有限责任公司微生物药物国家工程研究中心,河北石家庄050015)
环孢菌素A生产菌原生质体转化系统的建立
戴 梦,刘 静,赵 颖,张 佳,章 丽,郑桂珍
(华北制药集团新药研究开发有限责任公司微生物药物国家工程研究中心,河北石家庄050015)
以腐草霉素抗性为选择标记,建立了环孢菌素A生产菌株的基因转化体系,成功将外源基因转入环孢菌素A生产菌,并整合到染色体上。传代实验表明,外源基因可以稳定表达。该体系的建立为环孢菌素A生产菌的基因工程育种奠定了基础。
环孢菌素A;多孔木霉;原生质体转化
环孢菌素A是由11个氨基酸组成的环肽,20世纪70年代由瑞士巴塞尔(Basel)的Sandoz公司实验室发现,并由该公司成功上市[1]。1978年,环孢菌素A被应用于第一例肾移植患者。因其具有免疫抑制活性强、对骨髓的毒性低等特点,目前广泛应用于异体器官移植后的排异反应及一些自体免疫缺陷疾病的治疗。除免疫抑制活性外,环孢菌素A还具有抗真菌、抗寄生物及抗炎活性[2]。2005年,环孢菌素A的年销售额已达10亿美元[3]。工业生产中,环孢菌素A由丝状真菌多孔木霉(Tolypocladium inflatum,又名雪白白僵菌Beauveria nivea)深层发酵产生。催化环孢菌素A生物合成的环孢菌素A合成酶,为多功能非核糖体多肽合成酶,分子量约1.6 MDa,由11个模块组成[4],定位于液泡膜上[5]。通过传统的诱变筛选及培养条件的优化,环孢菌素A的产量不断提高[6-8]。但对于产量已较高的生产菌株,再通过常规的诱变育种来提高产量就很困难。基因工程和代谢途径工程技术的发展,为工业生产菌种的改良和改造提供了更为直接有效的手段,在很多品种上已经获得了成功[9-11]。但对于环孢菌素A生产菌,特别是高产菌株的基因工程改造还鲜见报道。作者针对环孢菌素A生产菌原生质体制备、再生、转化条件进行探索,建立了可行的转化体系,为后续的环孢菌素A生产菌株的基因工程育种奠定了基础。
1 实验
1.1 材料
1.1.1 菌种、质粒与试剂
环孢菌素A高产菌株多孔木霉(Tolypocladium inflatum)060901,华北制药集团新药研究有限责任公司。质粒pPIPKA,自行保存,含有融合了产黄青霉异青霉素N合成酶基因启动子(Pipns)的腐草霉素抗性基因[12]。
裂解酶、麦芽粉,Sigma公司;酵母粉、蛋白胨, Oxoid公司;Easy-DNA试剂盒,Invitrogen公司;腐草霉素,InvivoGen公司;其它试剂均为国产。
1.1.2 培养基、缓冲溶液
菌丝培养基和高渗培养基均参照Weber等[13]方法配制,略作改进。菌丝培养基:一水麦芽糖5%,蛋白胨1%,KH2PO40.5%,KCl 0.25%,p H值5.6。高渗培养基:麦芽粉2%,酵母粉0.4%,山梨醇21. 8%,琼脂0.8%,p H值5.7。
斜面培养基:可溶性淀粉1.5%,玉米浆1.0%,蛋白胨0.15%,蔗糖0.25%,KH2PO40.025%,琼脂2.5%,p H值5.0。
原生质体制备及转化缓冲溶液[12]:KMP(KCl 0.7 mol·L-1,甘露醇0.8 mol·L-1,磷酸钾缓冲溶液20 mmol·L-1,p H值6.3),KMPC(KMP加50 mmol·L-1CaCl2),PPC(PEG3500 40%,CaCl250 mmol·L-1,磷酸钾缓冲溶液20 mmol·L-1,p H值6.3)。
1.2 方法
1.2.1 多孔木霉060901对腐草霉素的敏感性考察
制备多孔木霉060901孢子液,取适量涂布在含不同浓度腐草霉素的高渗培养基和斜面培养基平板上, 28℃下培养10 d左右,观察其生长情况。
1.2.2 原生质体制备
接种多孔木霉060901到菌丝培养基,孢子终浓度为6.5×106个·m L-1,28℃、230 r·min-1下培养72 h。收集菌丝,用含0.5%裂解酶的KMP溶液28℃下处理1 h,过滤除去菌丝碎片,900 g、4℃下离心10 min收集原生质体,用0.8 mol·L-1KCl溶液洗原生质体2次,原生质体悬于KMPC溶液,终浓度为1.5 ×108个·m L-1。
1.2.3 原生质体转化
取200μL原生质体加到2 m L离心管中,加50μL PPC溶液和5μg质粒p PIPKA,冰上放置30 min,再加1 m L PPC溶液,混匀加到高渗培养基中,倒平板。28℃下培养20 h左右,加盖腐草霉素抗性(5 μg·m L-1),28℃下继续培养10 d左右,挑取腐草霉素抗性克隆,转接到含2μg·m L-1腐草霉素的抗性斜面培养基上,培养7 d左右。
1.2.4 转化子分析
1.2.4.1 基因组DNA提取
取斜面孢子接种到菌丝培养基,28℃下振荡培养48 h,取菌丝,液氮研磨,用Easy-DNA试剂盒提取DNA基因组。
1.2.4.2 转化子基因水平鉴定
采用文献[13]设计的腐草霉素抗性基因的引物ph1、ph2,以出发菌株及阳性克隆的基因组DNA为模板进行PCR扩增,通过琼脂糖凝胶电泳对转化子进行鉴定。
2 结果与讨论
2.1 多孔木霉060901对腐草霉素的敏感性
腐草霉素抗性为丝状真菌基因转化中常用的筛选标记。实验表明,多孔木霉对腐草霉素极为敏感,在高渗培养基中加入1μg·m L-1的腐草霉素即可抑制其生长;在斜面培养基上加入2μg·m L-1的腐草霉素,只有少数菌落能生长,且形态与对照菌株有明显的区别。因此,尝试采用含有腐草霉素抗性基因的产黄青霉转化载体pPIPKA建立多孔木霉的转基因体系。
2.2 多孔木霉060901原生质体转化
原生质体的制备方法参考了产黄青霉的制备和转化方法[12],主要对菌丝的培养条件进行了优化,根据该菌生长慢、易结球的特点,采取了加大接种量、并在摇瓶中加玻璃珠的方法,菌丝培养48~96 h均可得到原生质体,但以72 h效果最好,原生质体的制备量大,达7×107个·g-1湿菌丝,且再生率高,在30%左右。原生质体量和质粒量对转化效率的影响见表1。

表1 原生质体量和质粒量对转化效率的影响Tab.1 The effect of protoplast amount and plasmid amount on transformation efficiency
由表1可以看出,毎个转化反应选用3×107个· g-1湿菌丝的原生质体和5μg质粒的转化效果比较好。经过多批转化,发现批次间的差异比较大,可能一些细微的变化也会对转化效率造成影响。
2.3 转化子鉴定
经过转化共得到能在腐草霉素抗性斜面上正常生长的菌株228株,随机挑选部分菌株提取基因组DNA,并以其为模板,用腐草霉素抗性基因引物ph1/ ph2进行PCR扩增,结果表明所选菌株均有预期的腐草霉素抗性基因(图1)。
2.4 传代实验
转化菌株在无抗性斜面传代5次,再接种到含腐草霉素的斜面上,仍生长良好,证明转化子抗性基因能够稳定遗传。
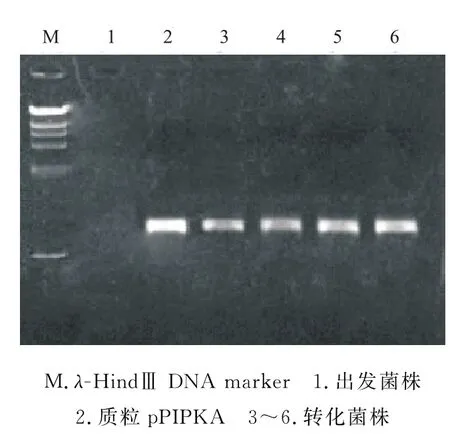
图1 转化菌株的PCR鉴定结果Fig.1 The results of PCR identification for transformation strains
2.5 讨论
环孢菌素A因其在器官移植和自体免疫疾病治疗方面所起的重要作用,一直受到人们的重视,不断提高其产量是工业化生产的重要目标。建立在随机突变和大规模筛选基础上的常规育种方法及培养工艺的改进在环孢菌素A产量的提高方面发挥了重大的作用,但随着菌株产量的提高和突变的累积,传统育种方法的局限性不断显现,进一步提高高产菌株的产量越来越困难。现代生物技术为菌种改良提供了更为直接和理性的方法。通过基因工程方法对工业微生物的改造,在放线菌和真菌上均有成功的报道[9-11],但基因工程技术在环孢菌素A生产菌改造方面应用的报道还很少。高效的转基因体系是工业微生物基因工程育种的基础。原生质体制备的预实验中曾采用Weber等[13]报道的环孢菌素A生产菌的原生质体转化系统,结果发现原生质体的制备量少,所需酶浓度高,而且在离心浓缩时,原生质体大部分悬浮在上清中,不易沉淀。经过多次实验,对产黄青霉的原生质体制备及转化体系[12]进行改良,确定了用于环孢菌素A高产菌株多孔木霉060901的原生质体制备及转化方法,该方法所需酶浓度低,原生质体制备量大,成活率高。但与Weber等的报道相比,转化效率还比较低,这可能与本研究选用的宿主为环孢菌素A高产菌株有关。本研究选用的质粒pPIPKA曾用于产黄青霉菌的转化,可以成功地整合到多孔木霉基因组中,且经过多次传代仍可以稳定地表达。由于该菌对腐草霉素比较敏感,使用较低浓度的腐草霉素便可筛选得到阳性克隆,与Weber等使用的潮霉素(600μg·m L-1)相比,是一种比较经济的选择。
3 结论
以腐草霉素抗性为选择标记,建立了环孢菌素A高产工业菌株的基因转化体系,成功将外源基因转入环孢菌素A生产菌,并整合到染色体上。传代实验表明,外源基因可以稳定表达。为后续的环孢菌素A生产菌的基因工程育种奠定了基础。
[1] Heuslera K,Pletscher A.The controversial early history of cyclosporine[J].Swiss Med Wkly,2001,131(21-22):299-302.
[2] Sowden J M,Allen B R.Cyclosporin in dermatology:A historical overview[J].Int J Dermatol,1992,31(7):520-523.
[3] Pritchard D I.Sourcing a chemical succession for cyclosporin from parasites and human pathogens[J].Drug Discovery Today,2005, 10(10):688-691.
[4] Lawen A,Zocher R.Cyclosporin synthetase:The most complex peptide synthesizing multienzyme polypeptide so far described [J].J Biol Chem,1990,256(19):11355-11360.
[5] Hoppert M,Gentzsch C,Schörgendorfer K.Structure and localization of cyclosporin synthetase,the key enzyme of cyclosporin biosynthesis in Tolypocladium inflatum[J].Arch Microbiol,2001, 176(4):285-293.
[6] Lee L,Agathos S N.Effect of amino acid on the production of cyclosporine A by Tolypocladium inflatum[J].Biotechnology Letters,1989,11(2):77-82.
[7] Balaraman K,Mathew N.Optimization of media composition for the production of cyclosporine A by Tolypocladium species[J]. Indian J Med Res,2006,123(4):525-530.
[8] Lee M J,Lee H N,Han K,et al.Spore inoculum optimization to maximize cyclosporin A production in Tolypocladium niveum[J]. J Microbiol Biotechnol,2008,18(5):913-917.
[9] Chiang S J.Strain improvement for fermentation and biocatalysis processes by genetic engineering technology[J].J Ind Microbiol Biotechnol,2004,31(3):99-108.
[10] Olano C,Lombo F,Mendez C,et al.Improving production of bioactive secondary metabolites in actinomycetes by metabolic engineering[J].Metabolic Engineering,2008,10(5):281-292.
[11] Crawford L,Stepan A M,Mcada P C,et al.Production of cephalosporin intermediates by feeding adipic acid to recombinant Penicillium chrysogenum strains expressing ring expansion activity [J].Biotechnology,1995,13(1):58-62.
[12] 王富强,任志红,徐平,等.产黄青霉转化载体pPIPKA的构建及青霉素工业生产菌株的转化研究[J].菌物学报,2004,23(1):66-72.
[13] Weber G,Leitner E.Disruption of the cyclosporine synthetase gene of Tolypocladium niveum[J].Curr Genet,1994,26(5-6): 461-467.
Construction of Protoplasts Transformation System for Cyclosporin A Industrial Strain
DAI Meng,LIU Jing,ZHAO Ying,ZHANG Jia,ZHANG Li,ZHENG Gui-zhen
(New Drug R&D Center of North China Pharmaceutical Co.,National Engineering& Research Center of Microbial Medicine,Shijiazhuang 050015,China)
A protoplasts transformation system for high-productive industrial strain of cyclosporin A was successfully constructed by using phleomycin resistant gene as select marker.The PCR results proved that the foreign DNA had been integrated in the chromosome of T.inflatum and it could be expressed steadily after several generations.This system laid a foundation for genetic engineering breeding of the cyclosporin A-producing strain.
cyclosporin A;Tolypocladium inflatum;protoplasts transformation
Q 813
A
1672-5425(2013)03-0036-03
10.3969/j.issn.1672-5425.2013.03.009
石家庄高端医药产业园创新药物孵化基地资助项目(2011ZX09401-306)
2013-01-09
戴梦(1980-),男,上海人,工程师,研究方向:微生物功能基因组学及基因工程育种,E-mail:daimeng80927@2008.sina. com,daimeng80927@gmail.com;通讯作者:郑桂珍,高级工程师。
