β-4,4′-二羟基联苯卟啉的合成及其生物活性研究
2013-07-18徐意祥王司卫黄齐茂潘志权
徐意祥,李 清,王司卫,黄齐茂,潘志权
(武汉工程大学绿色化工过程省部共建教育部重点实验室,湖北武汉430073)
β-4,4′-二羟基联苯卟啉的合成及其生物活性研究
徐意祥,李 清,王司卫,黄齐茂,潘志权
(武汉工程大学绿色化工过程省部共建教育部重点实验室,湖北武汉430073)
以β-硝基四苯基金属卟啉为原料,将4,4′-二羟基联苯引入四苯基卟啉的β位得到一系列4,4′-二羟基联苯卟啉,通过紫外光谱、红外光谱、质谱及核磁共振氢谱等对该卟啉化合物进行了结构表征,并考察了其生物活性。结果表明,4,4′-二羟基联苯引入到四苯基卟啉的β位,使其Soret带一定程度上红移;β-4,4′-二羟基联苯卟啉具有明显的产生单线态氧的能力;光照条件下,β-4,4′-二羟基联苯卟啉对pBR322质粒DNA有明显的切割作用;β-4,4'-二羟基联苯卟啉可能是以外部自堆积的方式与CT-DNA发生作用的。
β-取代;卟啉;DNA切割
卟啉类化合物对肿瘤组织具有选择性富集作用,在光照条件下能够产生活化分子氧从而使其周围肿瘤组织氧化以致坏死,该方法已被广泛用于光动力疗法(PDT)治疗恶性肿瘤[1,2]。人工合成β-取代卟啉化合物的结构更接近天然卟啉的构象[3],使其具有更为特殊的光化学性质和生物学特性,因此,β-取代卟啉的合成研究对于PDT的广泛应用具有重要的现实意义。4,4′-二羟基联苯是一种常见的光敏材料中间体[4],作者在此将其引入四苯基卟啉(TPP)的β位合成了β-(4,4′-二羟基联苯基)-5,10,15,20-四苯基卟啉,并对合成的卟啉化合物进行了结构表征和初步的生物活性测试[5]。
1 实验
1.1 试剂与仪器
柱层析硅胶(200~300目,100~120℃活化1 h),青岛海洋化工厂;三羟甲基氨基甲烷-乙酸/盐酸(TAE/TBE)缓冲溶液:0.05 mol·L-1Tris-HCl, 0.1 mol·L-1NaCl,p H值7.4;溴酚蓝、溴化乙锭(EB)、琼脂糖、p BR322质粒DNA,日本Toyobo公司;小牛胸腺DNA(CT-DNA)、1,3-二苯基异苯并呋喃(DPBF),华美生物工程公司。所用试剂均用标准方法纯化。
LTQ XL型液相色谱-离子阱质谱色质联用仪,美国Thermo公司;Agilent 400 MHz型核磁波谱共振仪,美国Agilent公司;FTIR-8100型红外光谱仪、UV-2450型紫外可见分光光度计,日本Shimadzu公司;RY-1型熔点仪,天津市分析仪器厂;DYY-8B型稳流稳压电泳仪,南京普阳科学仪器研究所;Lourmat Bio Print-1000型凝胶成像分析系统,法国Vilber公司;高压汞灯(350~800 nm,50 W),西安教学仪器厂。
1.2 合成
原料4,4′-二羟基联苯的合成参照文献[6],β-(4, 4′-二羟基联苯基)-5,10,15,20-四苯基卟啉的合成路线如图1所示。
1.2.1 β-(4,4′-二羟基联苯基)-5,10,15,20-四苯基铜卟啉(Ⅰ)的合成
在装有回流冷凝管和氩气进出口管的100 m L三口烧瓶中加入200 mgβ-硝基-5,10,15,20-四苯基铜卟啉和40 m L无水N,N-二甲基甲酰胺溶液,混合均匀,反应前通入高纯氩气,加热至100℃回流;向反应瓶中加入20 mg氢氧化钠和400 mg 4,4′-二羟基联苯,用TLC(环己烷∶氯仿=1∶1)监测反应至无原料点,反应约2 h,停止加热,冷却至室温;将反应混合物倒入到200 m L饱和氯化钠冰水溶液中,搅拌均匀后抽滤,得到的固体物质溶解于氯仿中,浓缩,以硅胶作固定相、环己烷-氯仿(1∶1)作淋洗剂,进行柱层析分离,收集第3色带(主带)部分,浓缩,加入热甲醇重结晶,得紫色晶体128 mg(0.15 mmol),产率55%。UV-Vis(CHCl3),λmax,nm:413,540;m.p.>300℃; IR(KBr),υ,cm-1:3422、1597(C=C),3054、821、752 (Ar-H),1655(C=N),1222(C-O),1004(Cu-N); MS(FAB),m/z:860[M]+。
1.2.2 β-(4,4′-二羟基联苯基)-5,10,15,20-四苯基镍卟啉(Ⅱ)的合成

图1 β-(4,4′-二羟基联苯基)-5,10,15,20-四苯基卟啉的合成路线Fig.1 Synthetic route ofβ-(4,4′-dihydroxybiphenyl)-5,10,15,20-tetraphenylporphyrin
将200 mgβ-硝基-5,10,15,20-四苯基镍卟啉加入100 m L三口烧瓶中,其它操作同上,得紫红色晶体104 mg,产率54%。UV-Vis(CHCl3),λmax,nm:416, 531;m.p.>300℃;1HNMR(400 MHz,CDCl3),δ: 8.72~8.17(m,7H,β-吡咯H),8.00~7.76(m,8H, 5,10,15,20-Ho),7.69~7.62(m,12H,5,10,15,20-Hm,p),7.42~7.40(m,7 H,4,4′-二羟基联苯基H), 6.88~6.86(s,2H,OH);IR(KBr),υ,cm-1:3448 (C=C),3052(C-H),1597(C=C),1006(Ni-N), 834、793(Ar-H)。
1.3 产生单线态氧能力的测定
将待测1μmol·L-1卟啉溶液和100μmol·L-11,3-二苯基异苯并呋喃(DPBF)混溶于Tris-HCl缓冲溶液中,取3 m L混合溶液于比色皿中,用高压汞灯照射混合液(距样品20 cm),用紫外分光光度计检测混合溶液在415 nm处吸光度值随着时间的变化,以光照时间为横坐标、吸光度为纵坐标作图,比较卟啉产生单线态氧的能力。
1.4 切割pBR322质粒DNA的测定
在PE管中分别依次加入0.5μL卟啉溶液、0.5μL p BR322质粒DNA和1.5μL蒸馏水,混合均匀。用高压汞灯光照(距样品20 cm)混合溶液2 h,同时进行未光照的对比实验,光照停止后每支PE管中加入0.5μL溴酚蓝终止反应。在琼脂糖凝胶(含0.1%EB)中点样,以Tris-HCl-EDTA缓冲溶液为电泳液,在电压90 V下电泳1.5 h,在凝胶成像系统上成像。
1.5 卟啉与CT-DNA滴定的紫外可见吸收光谱测定
在参比池和样品池中分别加入3 m LTris-HCl缓冲溶液,同时在样品池中加入3μmol卟啉溶液,使待测卟啉的浓度为1μmol·L-1。用紫外分光光度计记录随着CT-DNA浓度的增大,溶液在300~700 nm光谱范围内其特征吸收峰的变化情况。
2 结果与讨论
2.1 合成与表征
2.1.1 合成
β-硝基四苯基卟啉的β位引入4,4′-二羟基联苯的反应属于单分子自由基亲核取代反应(SRN1)[7]。通入高纯氩气是防止原料和产品被氧化,加入少量的氢氧化钠利于4,4′-二羟基联苯形成酚氧负离子。产物采用柱层析分离方法提纯,反应完成后将溶剂DMF除净,得到的固体用氯仿溶解,抽滤除去不溶于氯仿的杂质,再将滤液浓缩的固体分离提纯。由于产物存在两个羟基,过柱时严重拖带,以环己烷-氯仿(1∶1)为淋洗剂,柱中颜色明显分带:第1带鲜红色,为脱去硝基后的金属四苯基卟啉;第2带暗红色,为未反应的β-硝基四苯基卟啉铜;第3带(主带)红色,为产物带,将第1带和第2带分离出来后改用氯仿将第3带淋洗下来,即得到目标产物紫色固体。
2.1.2 红外光谱分析
β-(4,4′-二羟基联苯基)-5,10,15,20-四苯基卟啉的红外光谱中,3488~3422 cm-1处强而宽的峰为C=C伸缩振动吸收峰,834~793 cm-1处中而尖锐的峰归属为苯环上C-H的面外振动弯曲吸收峰,1655~1597 cm-1处为C=N的伸缩振动峰,1004 cm-1和1006 cm-1处分别为Cu-N和Ni-N振动峰。以CDCl3为溶剂的1HNMR图谱中,δ8.72~8.17处归属为吡咯环上的氢(7H),δ8.00~7.76和δ7.69~7.62处归属为卟啉中位苯环上的氢(20 H),δ7.42~7.40处归属为4,4′-二羟基联苯基上的氢(7H),δ 6.88~6.86处为4,4′-二羟基联苯基的羟基上的氢(2H)。
2.1.3 紫外可见吸收光谱分析
TPP和化合物Ⅱ的紫外可见吸收光谱见图2。
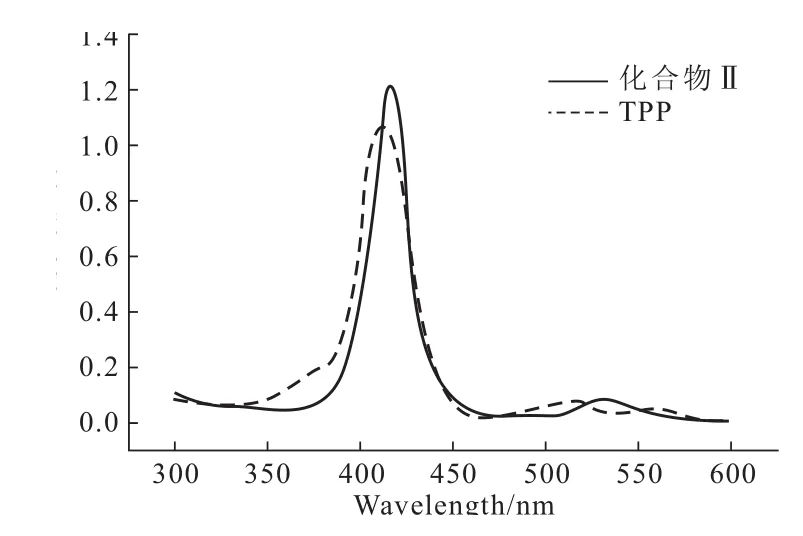
图2 TPP和化合物Ⅱ的紫外可见吸收光谱Fig.2 The UV-Vis absorption spectra of TPP and compoundⅡ
由图2可知,化合物Ⅱ的紫外可见吸收光谱与四苯基卟啉相比较,其S带和Q带有不同程度的红移。四苯基卟啉在结合了金属离子之后,卟啉的环内电子云密度增大,共轭程度增强,整个体系的能量降低,分子更加稳定,使卟啉的Q带数量减少;4,4′-二羟基联苯取代卟啉环上的硝基使得整个卟啉共轭体系越长,其吸收越移往长波方向,说明4,4′-二羟基联苯与卟啉环上基团相互作用,使得其Soret带发生红移。
2.2 产生单线态氧能力
单线态氧(1O2)是杀伤癌细胞和肿瘤组织的主要因素,因此卟啉化合物在光照条件下产生单线态氧的相对产量决定了其光敏能力的大小[8]。DPBF是常用的单线态氧捕获剂,不同光照时间卟啉-DPBF混合溶液在415 nm处的吸光度值见图3,由曲线的斜率即可判定卟啉化合物产生单线态氧的能力。
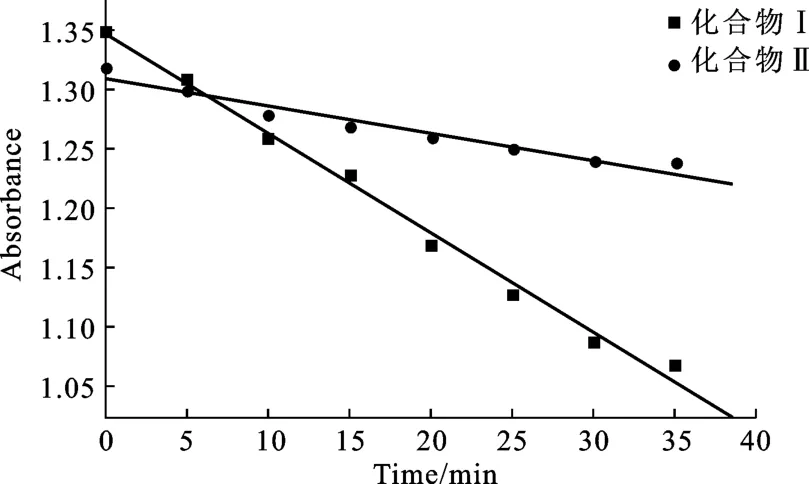
图3 卟啉-DPBF混合溶液在不同光照时间的吸光度值Fig.3 The absorbance of porphyrin-DPBF solution at different light irradiation times
由图3可知,化合物Ⅰ、Ⅱ的曲线斜率分别为-0.0023、-0.0082,表明β-(4,4′-二羟基联苯基)-5, 10,15,20-四苯基卟啉均具有产生单线态氧的能力,其中化合物Ⅰ是顺磁性金属离子,使卟啉光敏反应中分子三线态寿命明显降低,因此产生单线态氧能力较弱。
2.3 切割p BR322质粒DNA
pBR322质粒DNA以结构紧密的共价闭环超螺旋型(构型Ⅰ)为主,当与卟啉作用后,DNA双链受到切割,产生结构松散的开环缺刻型(构型Ⅱ)和线型(构型Ⅲ)[9]。三种型态DNA在琼脂糖凝胶电泳中的迁移速率为:构型Ⅰ>构型Ⅱ>构型Ⅲ[10]。不同浓度的化合物Ⅱ在光照和未光照的条件下对超螺旋p BR322质粒DNA的切割效果见图4。

图4 化合物Ⅱ在不同浓度下对超螺旋pBR322质粒DNA的切割Fig.4 Cleavage of supercoiled p BR322 plasmid DNA by compoundⅡwith different concentrations
由图4可知,经过光照后,化合物Ⅱ具有切割DNA的作用,其对DNA的切割作用随浓度的增大而增强,在浓度为600μmol·L-1时(Lane4)的切割效果最佳。
2.4 卟啉与CT-DNA滴定的紫外可见吸收光谱
紫外可见吸收光谱是研究化合物与DNA相互作用的最方便、常用的手段,紫外可见吸收光谱的变化是化合物与DNA结合的证据之一[11]。卟啉与DNA以插入方式作用时,紫外可见吸收光谱中卟啉的Soret带会发生强烈的减色(>35%)和红移(>15 nm);以外部沟面结合方式作用时,Soret带会发生较小的减色(<10%)和红移(<8 nm);以外部自堆积的方式作用时, Soret带会发生强烈的减色和中等强度的红移[12]。
CT-DNA滴定化合物Ⅱ的紫外可见吸收光谱见图5。
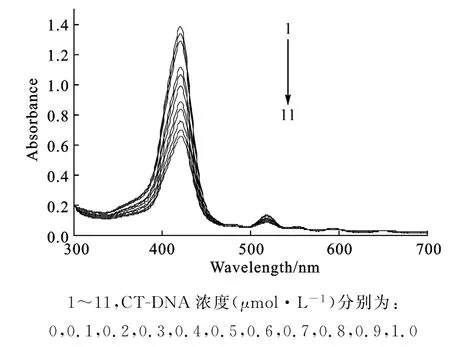
图5 CT-DNA滴定化合物Ⅱ的紫外可见吸收光谱Fig.5 The UV-Vis absorption spectra of compoundⅡ
由图5可知,随着CT-DNA浓度的不断增大, Soret带发生了较大的减色(约50%),但红移不明显(3 nm),推测化合物Ⅱ可能是以外部自堆积的外部结合方式与CT-DNA发生作用的。
3 结论
以β-硝基四苯基金属卟啉为原料,将4,4′-二羟基联苯引入四苯基卟啉的β位合成了β-(4,4′-二羟基联苯基)-5,10,15,20-四苯基卟啉,β-4,4′-二羟基联苯卟啉具有明显的产生单线态氧的能力,在光照条件下对p BR322质粒DNA有明显的切割作用,可能以外部自堆积的方式与CT-DNA发生作用。
[1] Mezo G,Herényi L,Habdas J,et al.Syntheses and DNA binding of new cationic porphyrin-tetrapeptide conjugates[J].2011,155 (1):36-44.
[2] Temelli B,Unaleroglu C.Synthesis of meso-tetraphenyl porphyrins via condensation of dipyrromethanes with N-tosyl imines[J]. Tetrahedron,2009,65(10):2043-2050.
[3] Harrach G,Valicsek Z,Horváth O.Water-soluble silver(Ⅱ)and gold(Ⅲ)porphyrins:The effect of structural distortion on the photophysical and photochemical behavior[J].Inorganic Chemistry Communications,2011,14(11):1756-1761.
[4] Yoshikawa Y,Saito Y,Maruyama K.Lignan compounds and 4,4′-dihydroxybiphenyl protect C2Cl2cells against damage from oxidative stress[J].Biochemical and Biophysical Research Communications,2006,344(1):394-399.
[5] Barbee J,Kuznetsov A E.Revealing substituent effects on the electronic structure and planarity of Ni-porphyrins[J].Computational and Theoretical Chemistry,2012,981(1):73-85.
[6] 林静,林敏,陈立,等.4,4′-二羟基联苯的合成[J].应用化学, 1993,10(3):83-84.
[7] 黄齐茂,翟保评,徐汉生,等.区域选择性合成2-硝基-5,10,15,20-四芳基金属卟啉[J].有机化学,2001,21(10):746-750.
[8] Yadav D,Kruk J,Sinha R K,et al.Singlet oxygen scavenging activity of plastoquinol in photosystemⅡof higher plants:Electron paramagnetic resonance spin-trapping stydy[J].Biochimica et Biophysica Acta,2010,1797(11):1807-1811.
[9] Zhu L N,Kong D M,Li X Z,et al.DNA Cleavage activities of tetraazamacrocyclic oxamido nickel(Ⅱ)complexes[J].Polyhedron, 2010,29(1):574-580.
[10] 王海滔,刘剑洪,张黔玲,等.钌(Ⅱ)配合物光谱性质及对DNA光切割作用[J].深圳大学学报(理工版),2011,28(1):47-53.
[11] Bhattacharya S,Mandal G,Ganguly T.Detailed spectroscopic investigations to reveal the nature of interaction of anionic porphyrin with calf thymus DNA[J].Journal of Photochemistry and Photobiology B:Biology,2010,101(1):89-96.
[12] Zhao P,Xu L C,Huang J W,et al.Tricationic pyridium porphyrins appending different peripheral substituents:Experimental and DFT studies on their interactions with DNA[J].Biophysical Chemistry,2008,135(1-3):102-109.
Research on Synthesis ofβ-4,4′-Dihydroxybiphenyl Porphyrins and Their Biological Activities
XU Yi-xiang,LI Qing,WANG Si-wei,HUANG Qi-mao,PAN Zhi-quan
(Key Laboratory for Green Chemical Process of Ministry of Education, Wuhan Institute of Technology,Wuhan 430073,China)
β-4,4′-Dihydroxybiphenyl porphyrins were synthesized by reaction ofβ-porphyrin with 4,4′-dihydroxybiphenyl directly,and structurally characterized by UV,1HNMR,IR and MS.Their biological activities were explored also.The results showed thatβ-4,4'-dihydroxybiphenyl porphyrins possessed remarkable ability to generate single line oxygen and to cleavage pBR322 plasmid DNA under light irradiation.Furthurmore,it maybe bind with CT-DNA in the mode of external self-accumulation.
β-substitute;porphyrin;DNA cleavage
O 626
A
1672-5425(2013)03-0027-04
10.3969/j.issn.1672-5425.2013.03.007
国家自然科学基金资助项目(20471045),湖北省自然科学基金青年杰出人才项目(2008CDB072)
2012-11-29
徐意祥(1982-),男,湖北武汉人,硕士,助教,研究方向:药物药剂合成,E-mail:lengzhu520@163.com;通讯作者:黄齐茂,博士,教授,E-mail:huangqim@163.com。
