产纤维素酶细菌的筛选及其紫外诱变
2013-07-18张学佳卢向阳
张学佳,田 云,卢向阳
(1.湖南农业大学生物科学技术学院,湖南长沙410128;2.湖南省农业生物工程研究所,湖南长沙410128)
产纤维素酶细菌的筛选及其紫外诱变
张学佳1,2,田 云1,2,卢向阳1,2
(1.湖南农业大学生物科学技术学院,湖南长沙410128;2.湖南省农业生物工程研究所,湖南长沙410128)
采用刚果红脱色圈法初筛得到143株有纤维素酶活性的细菌,然后采用DNS法复筛得到纤维素酶酶活最高的6株细菌,进一步进行紫外诱变处理,获得酶活提高最大且具有遗传稳定性的菌株E140′,酶活为0.90 IU·m L-1,较出发菌株(0.68 IU·m L-1)提高了32.35%。表明采用刚果红脱色圈法和DNS法联合筛选并结合紫外诱变,可以获得纤维素酶活性高的细菌。
刚果红;DNS;紫外诱变;纤维素酶
纤维素酶可以将纤维素降解为小分子糖,甚至单糖(葡萄糖等),实现废物利用。获得更高活性的纤维素酶,能大幅降低成本,改进工艺流程[1-3],将对生物质能源、造纸、发酵、纺织、洗涤等行业产生巨大影响。
自然界生物种类繁多,天然的纤维素酶种类及数量庞大,其活性也各不相同。如何快速有效地筛选获得高活性的纤维素酶及产酶菌株成为了研究的热点。
1 实验
1.1 菌种与培养基
细菌菌种来自于黄牛的牛粪及牛胃内容物、黑山羊羊粪、腐木木屑、多年生乔木根系附近的土壤。
CMC-Na筛选培养基(g·L-1):CMC-Na 5,蛋白胨10,氯化钠10,酵母提取物5,琼脂糖12。
细菌产酶培养基(g·L-1):麸皮40,蛋白胨20, K2HPO410,酵母提取物4。
1.2 方法
1.2.1 刚果红脱色圈法初筛[4-7]
取细菌菌种1 m L接入装有CMC-Na筛选培养基的培养皿中,置于37℃恒温培养箱静置培养8 h后,每小时观测1次,待细菌长到直径约0.3~2 cm时,取出培养皿。倒入1%刚果红染液静置1 h,倒掉染液。倒入1 mol·L-1的氯化钠溶液静置0.5 h,倒掉氯化钠溶液,观察有无脱色圈。如果该细菌能分泌纤维素酶,则有脱色圈;反之,则无。
1.2.2 DNS法复筛[8]
(1)细菌粗酶液的制备:取活化的菌种接入装有细菌产酶培养基的三角瓶中,于37℃、140 r·min-1摇床培养48 h。取1 m L培养液,4000 r·min-1离心10 min。取0.5 m L上清液,即为粗酶液。
(2)采用DNS法,在波长为540 nm处测定一系列已知浓度葡萄糖的OD值,绘制葡萄糖标准曲线。
(3)酶活的测定:取适当稀释的粗酶液0.5 m L于15 m L刻度试管中,加1.5 m L蒸馏水,另取一份置于沸水浴10 min灭活作对照。加DNS试剂3.0 m L, 50℃水浴30 min,沸水浴5 min,冷却后用水补足到10 m L,在540 nm波长下测定OD值。依据标准曲线方程求出葡萄糖浓度(μmol·m L-1),计算粗酶液中糖含量,并按下式计算酶活:
酶活定义:在自然p H值条件下,1 m L酶液水解底物1 min产生1μmol还原糖所用的酶量为1个酶活力单位(IU·m L-1)。
1.2.3 紫外诱变
取对数生长期的细菌,在显微镜下用血细胞计数器计细菌个数,稀释至细菌浓度为1×108个·m L-1。取稀释菌液分别紫外诱变处理0 s、15 s、30 s、45 s、60 s、75 s、90 s、105 s、120 s、135 s、150 s,绘制致死率曲线。
以致死率75%~90%之间的时间作为最佳诱变时间,对复筛得到的菌株进行紫外诱变。将诱变菌株进行刚果红脱色圈筛选[9,10]。取脱色圈大的菌株用DNS法检测酶活,并将酶活提高的菌株添加50%甘油保存于-20℃冰箱。
1.2.4 酶活稳定性鉴定[10,11]
取诱变后粗酶活最高的6株菌,活化。传代一定代数以后开始标记为0代,以0代为起点接种产生的下一批菌种为第1代,然后以第1代接种产生第2代,如此类推,直到产生第5代菌株,测定各代菌株的粗酶活。
2 结果与讨论
2.1 初筛结果
由于细菌将酶分泌到培养基中,因此脱色圈的大小一定程度上与酶的扩散程度相关,受时间影响(图1)较大。从图1可以看出,点样5 d后的脱色圈直径大于点样3 d后的脱色圈直径。另一方面,由于细菌菌落增长速度和脱色圈变大速度的不一致(甚至有时菌落长大到一定程度就几乎不再增大),采用菌落直径与脱色圈直径的比值作为酶活高低评判的方式也存在一定的理论缺陷。采用刚果红脱色圈法筛选得到143株有刚果红脱色圈的细菌菌株。部分初筛结果见表1。
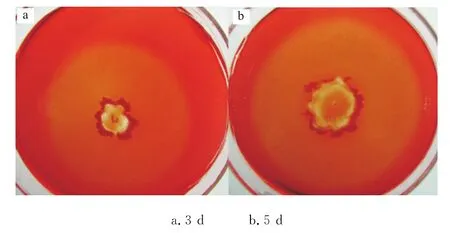
图1 时间对脱色圈的影响Fig.1 The influence of time on the decolorizing circle

表1 部分初筛实验结果Tab.1 Part of primary screening results
2.2 复筛结果
对初筛得到的143株菌进行DNS法复筛,最终选择DNS法测得的酶活最高的6株菌株(表1)进行紫外诱变实验。
2.3 紫外诱变结果
紫外照射时间与致死率的关系曲线见图2。
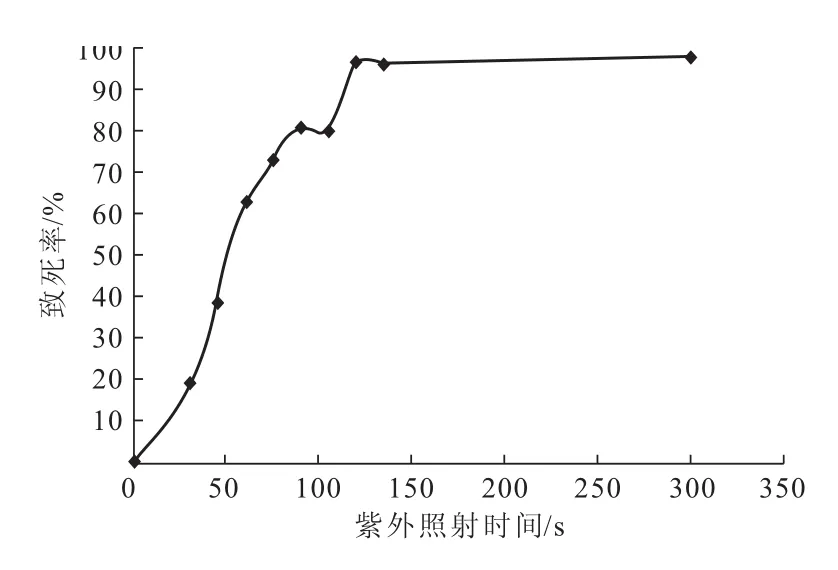
图2 紫外照射时间与致死率的关系Fig.2 The relationship between the ultraviolet irradiation time and the fatality rate
从图2可以看出,紫外照射超过120 s以后,致死率接近100%,一般选择致死率在75%~90%之间进行紫外诱变,本实验选取致死率为83.5%的90 s作为最佳诱变时间。
将复筛得到的6株菌分为6组分别紫外诱变处理90 s,将各组酶活最高的诱变菌株分别命名为D1′、A83′、E140′、E17′、D22′、B4′,紫外诱变前后细菌酶活对比见表2。
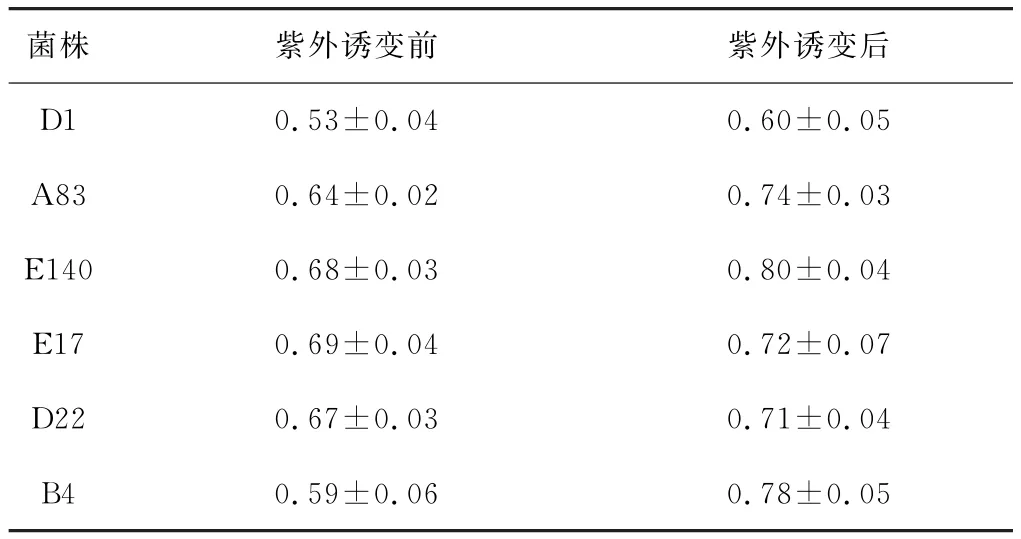
表2 紫外诱变前后细菌酶活对比/IU·mL-1Tab.2 The bacterial enzyme activity before and after UV mutagenesis/IU·m L-1
2.4 酶活稳定性(表3)
从表3可以看出,E140的紫外诱变菌株E140′的酶活最高,比较稳定,且最高酶活为0.90 IU·m L-1,较出发菌株E140的0.68 IU·m L-1提高了32.35%。
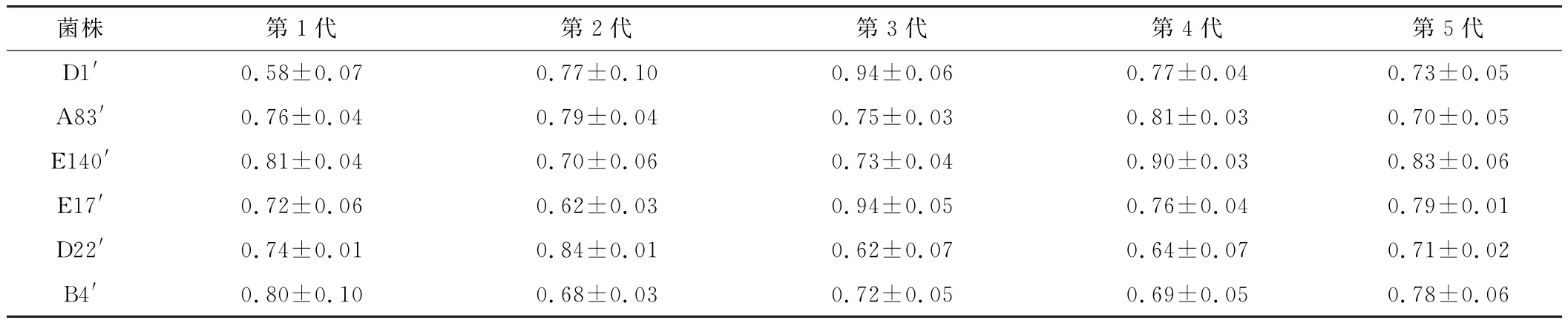
表3 6株诱变菌株的酶活稳定性/IU·m L-1Tab.3 Enzyme activity stability of the six mutation strains/IU·m L-1
2.5 讨论
刚果红脱色圈的直径大小并不能直接反映细菌纤维素酶活力的高低。当细菌产纤维素酶但不分泌到培养基时(即产生的酶附着在细菌的表面,这种情况比较少),就很难观察到脱色圈。另外,脱色圈的大小一定程度上与酶的扩散程度相关,受时间影响很大。因此,实验仅以有无脱色圈作为是否有纤维素酶活性的判断标准(目的在于筛选去掉没有纤维素酶活性的其它菌株),而以DNS法测得的酶活作为酶活高低的判断标准。实验发现,脱色圈直径的大小、脱色圈直径与菌落直径的比值,与DNS法测得的酶酶活性高低并不一致(表1),也说明仅用脱色圈直径的大小、脱色圈直径与菌落直径的比值作为纤维素酶活性的评价方法并不可靠。建议,在筛选规模较大的时候,以简单的方法(如刚果红脱色圈法)进行初筛、以复杂但精确的方法(如DNS法)进行复筛,兼顾筛选的效率并进一步扩大筛选范围,以快速获得更多、更高效的产酶菌株。
3 结论
通过刚果红脱色圈法初筛及DNS法复筛,得到6株纤维素酶酶活最高的细菌,再经紫外诱变处理,获得了酶活提高32.35%的诱变菌株E140′。表明采用刚果红脱色圈法和DNS法联合筛选并结合紫外诱变,可以获得纤维素酶酶活高的细菌。
[1] 陈洪章.纤维素生物技术[M].北京:化学工业出版社,2011:4-7.
[2] 王禄山,张正,等,译.纤维素降解的超分子机器[M].北京:化学工业出版社,2011:11-14.
[3] 曲音波,等.木质纤维素降解酶与生物炼制[M].北京:化学工业出版社,2011:23-24.
[4] Teather R M,Wood P J.Use of Congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from the bovine rumen[J].Applied and Environmental Microbiology,1982,43(4):777-780.
[5] Hendricks C W,Doyle J D,Hugley B.A new solid medium for enumerating cellulose-utilizing bacteria in soil[J].Applied and Environmental Microbiology,1995,61(5):2016-2019.
[6] 张建峰,耿宏伟,王曙光,等.一株高产纤维素酶菌的筛选[J].食品工程,2010,(10):170-172.
[7] 齐海萍,胡文忠,范圣第,等.纤维素酶产生菌的筛选[J].江苏农业科学,2010,(3):420-422.
[8] Eveleigh D E,Mandels M,Andreotti R,et al.Measurement of saccharifying cellulase[J].Biotechnology for Biofuels,2009,2(1):21-28.
[9] 焦秀凤,盛晓莉,单继阳,等.纤维素分解菌的筛选及其紫外诱变[J].化学与生物工程,2010,27(1):52-54.
[10] 张秋卓,蔡伟民.纤维素酶高产菌株的复合交替诱变选育[J].工业微生物,2008,38(6):32-37.
[11] 桂春燕,陈义伦,谢晓平,等.黄河三角洲耐高渗碱性纤维素酶产生细菌YRD-19的诱变育种和产酶条件优化[J].食品工业科技, 2010,31(10):163-167.
Screening and Ultraviolet Mutagenesis of Cellulase-Producing Bacteria
ZHANG Xue-jia1,2,TIAN Yun1,2,LU Xiang-yang1,2
(1.College of Bioscience and Biotechnology,Hunan Agricultural University,Changsha 410128,China; 2.Hunan Agricultural Bioengineering Research Institute,Changsha 410128,China)
Firstly,143 strains with cellulase activity were obtained by primary screening with Congo red decolorizing ring method,and then 6 strains with the highest enzyme activity were obtained by screening with DNS method.After the furtherly UV mutagenesis treatment,a mutant strain E140′with the highest enzyme activity increasing and genetic stability was got,whose enzyme activity reached 0.90 IU·m L-1,increasing by 32.35%than that of the starting strain(0.68 IU·m L-1).It showed that cellulase-producing bacteria with high enzyme activity could be obtained by screening with both Congo red decolorizing ring method and DNS method, combining with UV mutagenesis treatment.
Congo red;DNS;UV mutagenesis;cellulase
TQ 920.1 Q 936
A
1672-5425(2013)03-0014-03
10.3969/j.issn.1672-5425.2013.03.004
科技部国际科技合作项目(2010DFA62510),教育部2009年度长江学者和创新团队发展计划项目(IRT0963)
2012-12-20
张学佳(1986-),男,湖南益阳人,硕士研究生,主要从事应用微生物学研究,E-mail:zhangxuejia99@163.com;通讯作者:卢向阳,教授,E-mail:xiangyangcn@163.com;田云,副研究员,E-mail:tianyun79616@163.com。
