高效液相色谱法同时分析水稻和稻田中吡嘧磺隆 和苯噻酰草胺的残留量
2013-07-15杨丽华龚道新罗俊凯王雅丽丁春霞
杨丽华,龚道新*,罗俊凯,王雅丽,丁春霞
(湖南农业大学 a. 资源环境学院;b.农业环境保护研究所;c.理学院,湖南 长沙 410128)
吡嘧磺隆(pyrazosulfuro)具有杀草谱广、用药量少、环境污染轻等优点,可用于防治狼把草、野慈姑、鸭舌草、异型莎草等一年生和部分多年生杂草,对稗草有一定的抑制作用[1]。苯噻酰草胺( mefenacet)是酰苯胺类稻田高活性杀稗剂,属于细胞生长和分裂抑制剂,主要用于防除稻田禾本科杂草,对稗草防治有特效[2]。苯噻酰草胺对阔叶草和莎草的防效不够理想,一般通过与吡嘧磺隆等磺酰脲类除草剂复配扩大杀草谱,延长持效期,且该类除草剂混剂对单一物种的防除效果普遍高于其单剂。将吡嘧磺隆和苯噻酰草胺与肥料(氮、磷、钾微量元素或有机肥)加工到一起生产出的类似复合肥的集肥田和除草于一体的稻田除草药肥[3–4],已经在农业生产中逐步应用。这种药肥的应用不可避免地产生农药残留问题。目前,日本已制定了稻米中吡嘧磺隆和苯噻酰草胺单剂的限量(苯噻酰草胺的MRL值为0.05 mg/kg,吡嘧磺隆的含量不能超过0.10 mg/kg)[5],中国拟制订关于吡嘧磺隆和苯噻酰草胺在稻米等产品中的限量标准,因此,水稻和稻田中吡嘧磺隆和苯噻酰草胺残留检测方法的建立具有明显的应用价值。
吡嘧磺隆和苯噻酰草胺残留量的测定方法主要有高效液相色谱法(high performance liquid chromatography,HPLC)[6–10]、气相色谱法[11–12]和高效液相色谱–质谱联用法[13]等。目前,国内外对吡嘧磺隆和苯噻酰草胺复配除草剂及其药肥的研究主要是针对其除草药效,其单剂在环境介质和各种作物中残留的检测方法已有报道[14–22],但其复配除草剂及药肥在水稻和稻田环境中残留量的同时检测鲜见报道。笔者建立同时测定稻田水、土壤、水稻植株和糙米中吡嘧磺隆和苯噻酰草胺残留量的高效液相色谱分析方法,现将结果报道如下。
1 材料与方法
1.1 材 料
2010年6—9月于湖南农业大学实验基地(在该基地未使用过含吡嘧磺隆和苯噻酰草胺的农药)多点采集水稻植株样品,切成1 cm长后混匀;于水稻田中多点取耕作层(0~20 cm)土壤样品,去杂后混匀;按对角线法多点随机采集稻田水样品,混合均匀后盛入洁净的封口塑料瓶中;水稻成熟后用砻谷机将谷壳和糙米分开,取经植物粉碎机粉碎并过0.84 mm筛的糙米样品。
主要仪器:Agilent Technologies 1260型高效液相色谱仪(美国安捷伦公司,配有紫外检测器和化学工作站);THZ-82A型水浴恒温振荡器(江苏省金坛市荣华仪器制造有限公司);RE–2000A型旋转蒸发器(上海亚荣生化仪器厂);玻璃层析柱(1.5 cm ×20 cm)。
主要试剂:弗罗里硅土(Florisil,0.15~0.25 mm,国药集团化学试剂有限公司生产,用前在550 ℃烘3~5 h,冷却后以2%蒸馏水脱活);丙酮(长沙湘科精细化工厂)和二氯甲烷、乙酸乙酯、乙腈、乙酸(天津市恒兴化学试剂制造有限公司);甲醇(江苏汉邦科技有限公司);无水硫酸钠、氯化钠(天津市博迪化工有限公司)等。以上试剂均为A.R.级。
吡嘧磺隆·苯噻酰草胺0.43%颗粒剂、吡嘧磺隆和苯噻酰草胺的标准品(纯度分别为97.3%和90.5%),均由广西乐土生物科技有限公司提供。
1.2 方 法
1.2.1 吡嘧磺隆和苯噻酰草胺提取条件的确定
1.2.1.1 提取溶剂的选择和各样品的提取方法
因稻田水、土壤、糙米和水稻植株中的杂质及色素等不尽相同,故根据吡嘧磺隆和苯噻酰草胺的溶解特性,分别选用不同的提取剂来提取:稻田水以二氯甲烷作为提取剂;稻田土壤样品以丙酮、丙酮–乙酸、甲醇–乙酸为提取剂;糙米以甲醇、二氯甲烷、丙酮、丙酮–乙酸为提取剂;水稻植株以丙酮–乙酸乙酯–乙酸、石油醚–二氯甲烷–乙酸、正己烷–乙酸乙酯、二氯甲烷–乙酸和二氯甲烷–乙腈–乙酸为提取剂。
1) 稻田水样品的提取。准确量取稻田水样100.0 mL,置于盛有20 mL10%氯化钠溶液的分液漏斗中,摇匀后分别用30、30、20 mL二氯甲烷萃取3次,合并萃取液,在旋转蒸发仪上45 ℃浓缩近干,用色谱甲醇定容至5.0 mL,过0.45 μm有机系滤膜,供HPLC测定。
2) 稻田土壤样品的提取。准确称取稻田土壤样品20.0 g,置于250 mL三角瓶中,加80 mL甲醇,并加适量乙酸,调节pH至5~6,在水浴恒温(25 ℃)振荡器中振荡30 min,静置;用定量滤纸过布氏漏斗减压抽滤,合并抽滤液并转入三角瓶中,在旋转蒸发仪上45 ℃浓缩近干;用少量二氯甲烷溶解,并转入盛有20 mL 10%氯化钠溶液的分液漏斗中,再用30、30、20 mL二氯甲烷萃取3次,合并萃取液,在旋转蒸发仪上45 ℃浓缩近干;用色谱甲醇定容至5.0 mL,过0.45 μm有机系滤膜,供HPLC检测。
3) 糙米样品的提取。准确称取粉碎好的糙米样品10.0 g,置于250 mL三角瓶中,加80 mL丙酮,并加适量乙酸,调pH至5~6,在水浴恒温(25 ℃)振荡器中振荡30 min。余下提取步骤同稻田土壤样品的提取方法。
4) 水稻植株样品的提取:准确称取水稻植株样品10.0 g,置于250 mL三角瓶中,加二氯甲烷和乙腈的混合液(体积比1∶1)80 mL,并加适量乙酸,调pH至5~6,在水浴恒温(25 ℃)振荡器中振荡30 min,静置;布氏漏斗减压抽滤,合并抽滤液,转入三角瓶中,在旋转蒸发仪上45 ℃浓缩近干。浓缩液过弗罗里硅土柱净化:先用20 mL二氯甲烷和甲醇的混合液(体积比1∶1)预淋,将浓缩液移入弗罗里硅土净化柱中,用70 mL二氯甲烷和甲醇的混合液(体积比1∶1)淋洗(每次10 mL左右),收集淋出液,于旋转蒸发器上45 ℃浓缩近干,用色谱甲醇定容至5.0 mL,过0.45 μm有机系滤膜,供HPLC检测。
1.2.1.2 柱净化洗脱条件的确定
分别以丙酮、丙酮–乙酸乙酯(体积比1∶1)、甲醇和甲醇–二氯甲烷(体积比1∶1)作为洗脱剂对Flosisil净化柱进行洗脱。
1.2.1.3 弗罗里硅土柱净化淋洗体积的确定
取10 mg/L吡嘧磺隆和苯噻酰草胺混合标准溶液1 mL入弗罗里硅土柱中,用100 mL甲醇–二氯甲烷(体积比1∶1)淋洗,以10 mL为单位,分10次收集淋洗液,浓缩后用色谱甲醇定容,供HPLC检测。
1.2.2 HPLC 检测条件的确定
1.2.2.1 检测波长的选择
将吡嘧磺隆和苯噻酰草胺的混合标准溶液10 mg/L 进行HPLC 检测,以稳定的流动相为空白值,在吡嘧磺隆和苯噻酰草胺标准品峰最高时,利用紫外可变波长检测器在波长190~340 nm 进行光谱扫描,根据其最大吸收波长,确定HPLC 检测波长。
1.2.2.2 流动相的选择
以不同体积比的甲醇–水为流动相时,吡嘧磺隆存在拖尾现象,且峰型较宽,这可能是由于吡嘧磺隆分子中碱性基团在色谱柱吸附产生的,为此,在流动相中加入乙酸来改善峰型。以保留时间和分离效果为定性指标,以峰面积为定量指标分别考察不同体积比的乙酸、水、甲醇(2.5∶22.5∶75.0、3.0∶27∶70、3.5∶31.5∶65.0 和4.0∶36.0∶60.0)对目标化合物的分离效果。
1.2.3 标准曲线的绘制及检出限
采用梯度稀释法,用色谱甲醇将吡嘧磺隆和苯噻酰草胺分别配制成质量浓度0.01、0.05、0.10、0.25、0.50、1.00 mg/L的混合标准工作溶液,在选定的色谱条件下测定各浓度标准工作溶液所对应色谱峰的峰面积。以标准工作溶液的质量浓度(X)与其对应的色谱峰的峰面积(Y)绘制标准工作曲线,得出回归方程、相关系数和线性范围。根据3倍信噪比计算吡嘧磺隆和苯噻酰草胺的检出限。
1.2.4 回收率和精密度试验
在稻田水、土壤、水稻植株和糙米的空白对照样品中分别添加吡嘧磺隆和苯噻酰草胺的混合标准工作溶液,使其质量分数分别为0.05、0.10、1.00 mg/kg,每个处理重复5 次。按上述选定方法进行提取、净化和检测,计算回收率和相对标准偏差。
1.2.5 对所建立的前处理方法和HPLC 法的验证
根据中国农业部农药残留田间试验准则[23],在湖南农业大学实验基地的水稻田边选取一块没有种植水稻的稻田(灌水深3~5 cm),采用直接撒施法施入吡嘧磺隆·苯噻酰草胺0.43%颗粒剂270 kg/hm2(有效成分为1 161.0 g/hm2,其中吡嘧磺隆为43.2 g/hm2,苯噻酰草胺为1117.8 g/hm2),分别在施药后2 h 和1、3、5、7、10、14、21、28、35、42 d 采集稻田土壤(取样深度为0~10 cm)和稻田水样品。试验重复3 次。
采用直接撒施法,分别按吡嘧磺隆·苯噻酰草胺0.43%颗粒剂180、270 kg/hm2施入移栽后5~7 d的水稻移栽田或抛秧后5~7 d 的水稻抛秧田或1.5~2.0 叶期的水稻直播田,施药1 次。试验重复3次。在水稻的正常收获期分别采集水稻植株(包括稻秆和稻谷)。
按选定的吡嘧磺隆及苯噻酰草胺的提取和检测条件,测定吡嘧磺隆·苯噻酰草胺0.43%颗粒剂稻田水、稻田土壤、水稻植株和糙米样品,其中5 份以添加标准样品的方式(0.50 和1.00 mg/kg 的加标水平) 用于过程控制。重复3 次,计算样品中吡嘧磺隆和苯噻酰草胺的残留量。
2 结果与分析
2.1 HPLC 检测方法和样品前处理方法的建立
2.1.1 吡嘧磺隆和苯噻酰草胺的适宜提取剂
试验结果表明:
1) 以二氯甲烷为稻田水样品提取剂时,吡嘧磺隆和苯噻酰草胺的回收率均在86%以上,而且两者分离较好,故选用二氯甲烷作为稻田水样品的提取剂。
2) 稻田土壤样品以丙酮为提取剂时有杂质峰干扰,基线高且不稳定;以丙酮–乙酸为提取剂时添加回收率较低(50%以下);以甲醇–乙酸为提取剂时干扰杂质少,分离效果较好,添加回收率都在80%以上,故选用甲醇–乙酸作为稻田土壤样品的提取剂。
3) 糙米样品以甲醇、二氯甲烷为提取剂时均有杂质峰干扰;以丙酮、丙酮–乙酸为提取剂时的添加回收率均达80%以上,且以丙酮–乙酸为提取液时吡嘧磺隆更易进入有机相,添加回收率也相对较高,而对苯噻酰草胺的回收率无影响,所以,选用丙酮–乙酸作为糙米样品的提取剂。
4) 水稻植株样品以丙酮–乙酸乙酯–乙酸、石油醚–二氯甲烷–乙酸为提取剂时提取杂质多,基线不平,吡嘧磺隆和苯噻酰草胺的峰型也不好,其添加回收率也不达标;以正己烷–乙酸乙酯为提取剂时也有杂质干扰;以二氯甲烷–乙酸为提取剂时,添加回收率较低(50%);以二氯甲烷–乙腈–乙酸为提取剂时,吡嘧磺隆和苯噻酰草胺的添加回收率均达到了农药残留量分析与检测的技术要求,峰形好、对称,与杂质的分离效果也好,故选取二氯甲烷–乙腈–乙酸作为水稻植株的提取剂。
2.1.2 柱净化最佳淋洗条件
水稻植株样品分别以丙酮、丙酮–乙酸乙酯为洗脱剂时,苯噻酰草胺的回收率达101.66%,而吡嘧磺隆无法洗脱,其添加回收率也不达标。以甲醇为洗脱剂时,苯噻酰草胺的回收率达85.60%,而吡嘧磺隆的回收率偏低(70.64%)。以甲醇–二氯甲烷为洗脱剂时,苯噻酰草胺和吡嘧磺隆的回收率分别为96.01%和95.27%,吡嘧磺隆淋洗7 次的回收率分别为11.9%、48.6%、15.6%、9.6%、6.2%、3.4%和0%,前60 mL 的总淋洗回收率达96.01%;苯噻酰草胺淋洗7 次的回收率分别为16.1%、50.4%、14.0%、6.3%、5.3%、4.0%和0%,前60 mL 的总淋洗回收率达95.27%,且洗脱下来的杂质较少,不干扰目标化合物的测定,因此,选用甲醇–二氯甲烷溶合液(体积比1∶1)作为水稻植株样品的淋洗剂,用量为60 mL。
2.1.3 HPLC 法同时分析吡嘧磺隆和苯噻酰草胺的波长和流动相
紫外光谱图显示,吡嘧磺隆和苯噻酰草胺的最大紫外吸收波长分别为240、219 nm。比较波长220、230、240、250 nm 的检测结果,发现波长为240 nm时既能兼顾吡嘧磺隆和苯噻酰草胺的测定灵敏度和稳定性,也能使杂质干扰较少,故选取240 nm 作为测定波长。
流动相中甲醇的比例越大,吡嘧磺隆和苯噻酰草胺的峰型对称越好,但甲醇比例过大时,吡嘧磺隆和苯噻酰草胺的分离不好;甲醇比例过小时,吡嘧磺隆和苯噻酰草胺的峰型变宽。优化试验结果表明,甲醇、水、乙酸混合(体积比70.0∶29.7∶0.3)时,吡嘧磺隆和苯噻酰草胺的分离效果较好,它不仅能使吡嘧磺隆和苯噻酰草胺及稻田中的杂质有效分离,而且峰形对称,灵敏度高,保留时间适当,能有效避免基质中相关物质的干扰,故选取甲醇、水、乙酸的混合液(体积比70.0∶29.7∶0.30)作为流动相。
综上所述,高效液相色谱法同时分析吡嘧磺隆和苯噻酰草胺的条件:流动相为甲醇、水、乙酸的混合液(体积比70.0∶29.7∶0.3),流速0.6 mL/min,柱温30 ℃,检测波长240 nm,进样量20 μL,C18不锈钢柱(4.6 mm×150 mm,5 μm)。此条件下吡嘧磺隆和苯噻酰草胺的标准色谱图见图1。图1 结果表明,吡嘧磺隆和苯噻酰草胺的分离效果较好,且峰形对称,灵敏度高,保留时间适当。

图1 苯噻酰草胺和吡嘧磺隆标准溶液的分离色谱图Fig.1 HPLC chromatogram of mefenacet and pyrazosulfuro in standard solution
2.1.4 线性关系及检出限
在上述选定的HPLC条件下,混合标准工作液中吡嘧磺隆和苯噻酰草胺的质量浓度为0.01~1.00 mg/L时,质量浓度与其峰面积呈良好的线性关系。吡嘧磺隆的线性回归方程为y =115.13x+0.671,R2=0.999 7;苯噻酰草胺的线性回归方程为y=151.96x– 0.444,R2=0.999 8。吡嘧磺隆和苯噻酰草胺的检出限均为0.01 mg/L。
2.1.5 方法的精密度和回收率
由表1可见,在加标质量浓度为0.05~1.00 mg/kg时,稻田水、土壤、水稻植株和糙米中吡嘧磺隆和苯噻酰草胺的平均添加回收率分别为86.32%~104.07%、84.00%~98.53%、88.36%~95.37%和88.69%~ 95.00%;它们的相对标准偏差都小于或等于8.55%,符合中国农药残留量分析与检测的技术要求。
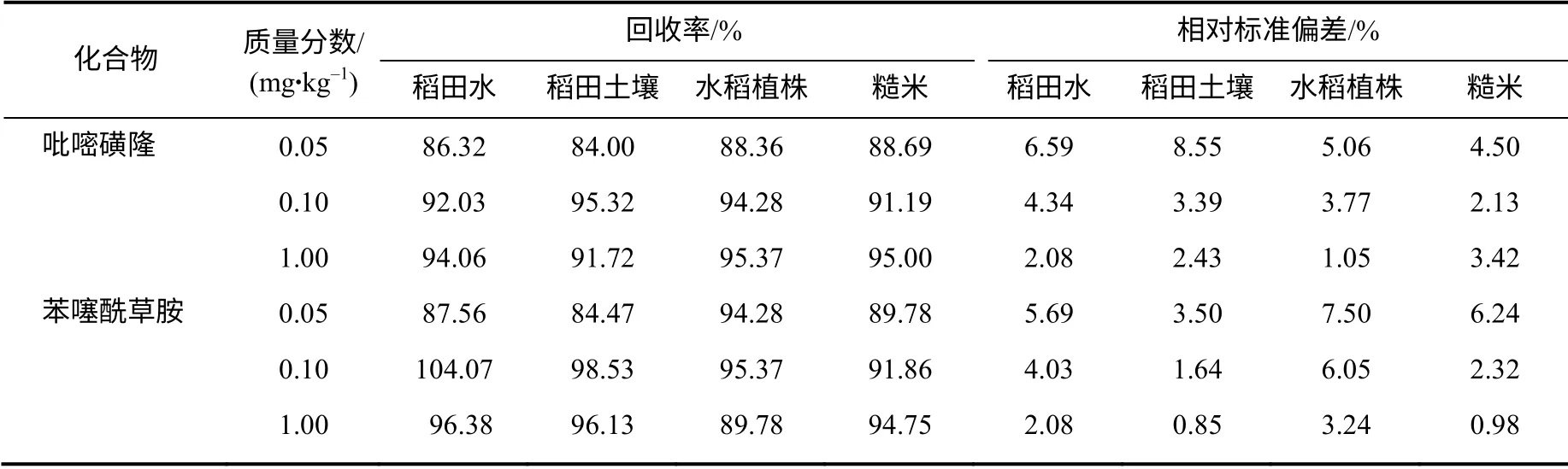
表1 吡嘧磺隆和苯噻酰草胺在稻田水、稻田土壤、水稻植株和糙米中的添加回收率Table 1 Recoveries results of pyrazosulfuro and mefenacet in water,soil,plant and unpolished rice
2.2 样品中吡嘧磺隆和苯噻酰草胺的检测结果
验证结果表明,稻米样品中均无吡嘧磺隆和苯噻酰草胺检出,而其他样品中均有吡嘧磺隆和苯噻酰草胺检出。质量控制样品的测定结果稳定、可靠,其吡嘧磺隆和苯噻酰草胺的回收率为87.5%~103.5%,相对标准偏差为3.2%~8.3%。图2结果表明,加标样品的HPLC色谱峰均有足够的信噪比,且峰形良好,其中空白样品的背景干扰小,不影响实际样品中吡嘧磺隆和苯噻酰草胺的定量分析。
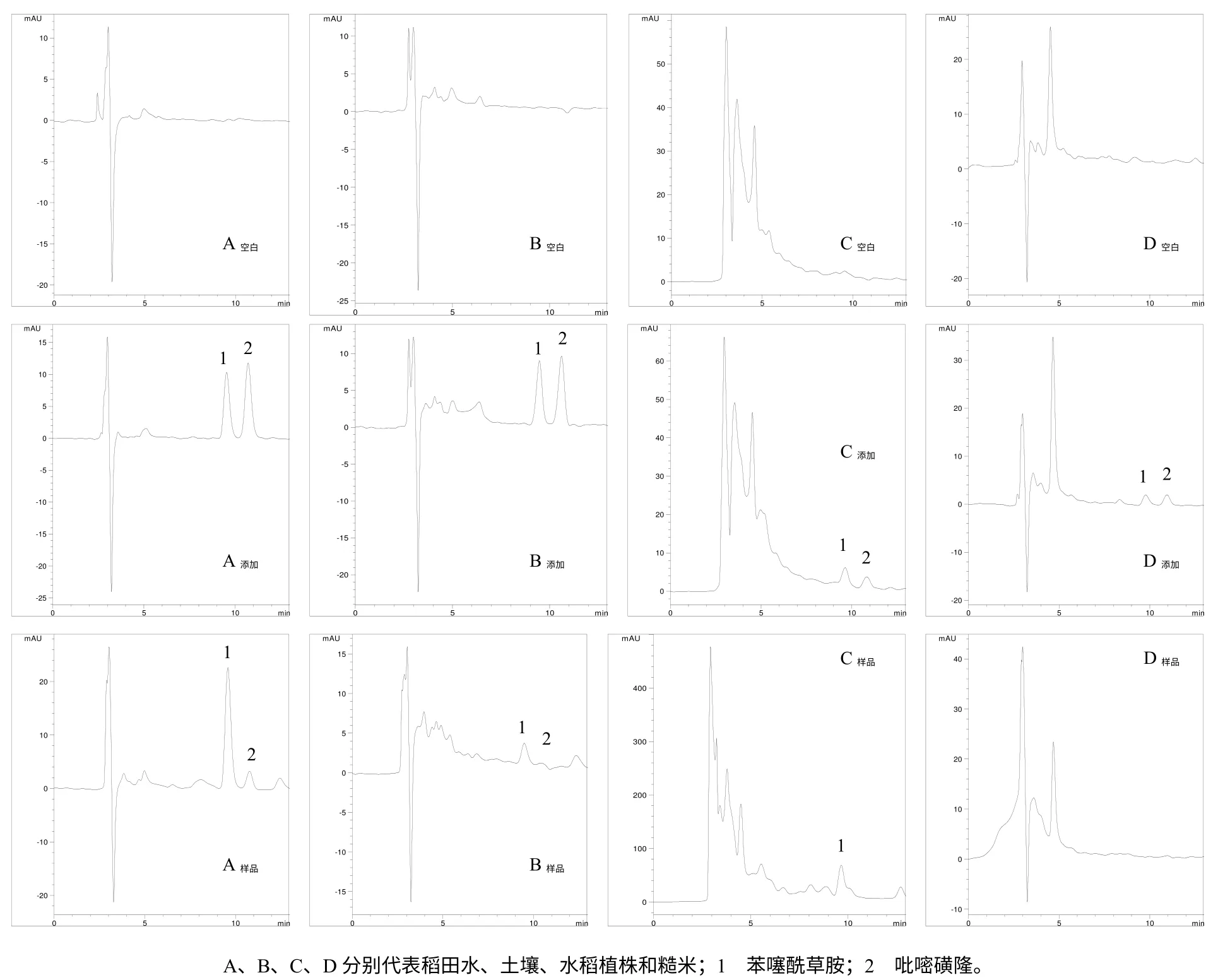
图2 稻田水、土壤、水稻植株和糙米样品中苯噻酰草胺和吡嘧磺隆检测的色谱图Fig.2 HPLC chromatograms of mefenacet and pyrazosulfuro in water,soil,plant and unpolished rice
3 结 论
采用高效液相色谱法同时测定稻田水、稻田土壤、水稻植株和糙米中吡嘧磺隆和苯噻酰草胺的残留量。稻田水样品用二氯甲烷直接萃取;稻田土壤和糙米样品分别用酸性甲醇和丙酮提取,再用二氯甲烷萃取净化;水稻植株样品用酸性二氯甲烷和乙腈的混合液(体积比1∶1)提取,再经弗罗里硅土柱净化。采用C18不锈钢柱(4.6 mm×150 mm,5 μm)分离,以甲醇、水、乙酸的混合液(体积比70.0∶29.7∶0.3)为流动相,流速0.6 mL/min,柱温30 ℃,在240 nm下检测。该方法简单快速,不受样品中其他组分的干扰,能准确有效地同时测定水稻和稻田中吡嘧磺隆和苯噻酰草胺的残留量,对实际样品的检测结果符合农药残留量分析与检测技术要求,具有一定的推广价值。
[1]徐大高,吴建辉,罗建军.吡嘧磺隆和苯噻草胺的高效液相色谱分析[J].农药,2003,42(3):24.
[2]易秀成.25%苯噻草胺·吡嘧磺隆泡腾片高效液相色谱分析方法研究[J].安徽化工,2004(6):46–47.
[3]季相金,解占军,王祥珍.除草药肥研究概况[J].杂粮作物,2003,23(3):176–177.
[4]杨丽华,龚道新,唐晶,等.高效液相色谱法同时测定稻田中苄嘧磺隆和苯噻酰草胺残留[J].色谱,2012,30(1):71–75.
[5]The Japan Positive List System for Agricultural Chemical Residues in Foods [S/OL].(2006–05–29)[2010–07–21]http://www.m5.ws001.squarestart.ne.jp/foundation/agrdtl.php?a_inq=76900.
[6]郭继业,于晓红,崔红兵,等.10%吡嘧磺隆可湿性粉剂的液相色谱分析[J].农药科学与管理,2006,25(9):7–9.
[7]祁彦,占春瑞,张新忠,等.高效液相色谱法同时测定大豆中10 种磺酰脲类除草剂的残留量[J].色谱,2004,22(11):634–637.
[8]韩谋国,陈蔚林.25%苯噻草胺·吡嘧磺隆水分散性抛掷型粒剂的研究[J].安徽化工,2005(1):36–37.
[9]石相梅,徐晓巍.高效液相色谱法测定水和废水中的烟嘧磺隆、吡嘧磺隆、噻嗪酮、氟虫氰[J].污染防治技术,2009,22(8):89–92.
[10]傅强,杨仁斌,徐浩然,等.固相萃取–高效液相色谱法测定甘蔗和土壤中二甲四氯的残留量[J].湖南农业大学学报:自然科学版,2011,37(5):554–557.
[11]屠海云,姜荷,李玮.气相色谱–质谱法测定粮谷中5种除草剂残留[J].食品科学,2010,31(16):217–219.
[12]陆建坚.苯噻酰草胺的填充柱气相色谱分析[J].贵州化工,2007,32(8):35–36.
[13]周平勇,占春瑞,李海燕,等.高效液相色谱–质谱联用法测定茶叶中30 种磺酰脲类除草剂的残留量[J].理化检验:化学分册,2010,46(3):292–295.
[14]毛应明,王学松,熊建军.固相萃取–高效液相色谱法测定紫菜中吡嘧磺隆残留量[J].长春理工大学学报,2010,12(5):88–89.
[15]金雁,姚家彪,赵颖,等.高效液相色谱法测定蔬菜中磺酰脲类除草剂多残留量的研究[J].检验检疫科学,2006,18(6):7–9.
[16]汪涛,宓鹤鸣,柴逸峰,等.微波辅助–固相萃取–高效液相色谱法测定稻谷中苯噻草胺残留量[J].第二军医大学学报,2008,29(7):845–846.
[17]陈建波,刘伟,崔艳梅,等.浊点萃取–高效液相色谱法测定草莓汁中的多种农药残留[J].分析化学,2008,36(3):401–404.
[18]刘明洋,龚道新,任竞,等.葡萄和土壤中霜脲氰的残留分析方法[J].湖南农业大学学报:自然科学版,2009,35(2):195–199.
[19]周艳明,陈柏,田宏哲.高效液相色谱法测定马铃薯中15 种除草剂的残留量[J].农药,2009,48(10):749–754.
[20]王媛媛,李光浩.SPE–HPLC 检测谷类中多种残留农药的研究[J].环境科学与技术,2011,34(1):124–127.
[21]Kang C A, Kim M R., Shen J Y,et al .Supercritical fluid extraction for liquid chromatographic determination of pyrazosulfuron-ethyl in soils[J].Bull Environ Contam Toxicol,2006,76:745–751
[22]Hongyun Niu,Yali Shi,Yaqi Cai,et al.Samples with single-walled carbon nanotubes disk[J].Microchim Acta,2009,164:431–438.
[23]NY/T788–2004 农药残留试验准则[S].
