偏肿革裥菌漆酶基因克隆及启动子序列分析
2013-07-12郑苗苗池玉杰
郑苗苗,池玉杰
(1 齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔161006;2 东北林业大学 林学院,黑龙江 哈尔滨150040)
漆酶(Laccase)是一种多酚氧化酶,一般含有4 个铜原子,分布于3 个高度保守的不同结合位点,每个铜原子在催化机制中都有很重要的作用.漆酶能催化O2通过4 个电子还原成水,并且伴随着一些酚类底物的氧化[1].漆酶最早是由日本的吉田于1883年在漆树的分泌物中发现,随后1893年Laborde 又证实在一些真菌中也含有这种酶.到目前为止,发现漆酶广泛存在于真菌和植物中,而且某些昆虫、细菌当中也含有漆酶[2].其中,真菌中的白腐菌类含有漆酶最多,研究也最为广泛.近120 多年来,漆酶一直是生物学、化学和环境科学等领域中十分活跃的研究热点[3].
真菌漆酶存在很多同工酶基因,由于菌株的生长环境和生理状态不同其表达量也不同[4].多项研究表明,受金属离子、营养元素和小分子芳香化合物影响,漆酶基因在转录水平表达较低[5].由于转录本的增加主要是由转录模板上游的启动子及其相关顺式作用元件发挥作用后直接引发的,从而影响了漆酶的表达量[6].因此,研究真菌漆酶基因转录控制区的结构与功能对于提高漆酶蛋白的表达产量以及在异源表达中提高漆酶活性至关重要.本文通过RTPCR、RACE 技术和SEFA-PCR 方法相结合,从偏肿革裥菌Lenzites gibbosa 中获得编码漆酶基因的cDNA、Genomic DNA 的全长序列及启动子序列,并且对其序列进行了分析,它们在GenBank 上的登录号为JF817353 和JF906787.
1 材料与方法
1.1 菌株与试剂
偏肿革裥菌菌株采集于黑龙江省凉水国家自然保护区,由东北林业大学鉴定并保存.DNAquick_快捷型植物基因组DNA 提取系统、DNAquick Plant System 均为TIANGEN 公司产品;E.Z.N.A 真菌RNA 提取试剂盒、E.Z.N.A 凝胶回收试剂盒均为OMEGA 公司产品;Genome Walking Kit 试剂盒、两步法RT-PCR 试剂盒、3'RACE试剂盒均为TaKaRa 公司产品;SMART RACE cDNA 扩增试剂盒为Clontech 公司产品;Escherichia coli JM109 感受态细胞为TaKaRa公司产品;pMD20-T Vector、LA Taq DNA 聚合酶为Promega 公司产品;其余试剂为进口或国产分析纯.
1.2 基因组DNA 和总RNA 提取
以陈军等[7]报道的优化后的漆酶培养基培养偏肿革裥菌.提取偏肿革裥菌基因组DNA 和总RNA,产物用核酸检测仪测定纯度,通过琼脂糖凝胶电泳检验完整性.
1.3 cDNA 核心片段克隆
合成cDNA 第1 链参照两步法RT-PCR 试剂盒使用说明.在GenBank 中选取20 条不同漆酶全长基因的氨基酸序列,根据比对结果查找出同源序列保守区,从而设计1 对简并引物(表1),PCR 反应体系25 μL,含10×PCR Buffer 2.5 μL,dNTP Mixture(2.5 mmol/L)1 μL,TaKaRa Ex TaqTMHS(5 U/μL)0.5 μL,引物Lcc-RT1 和Lcc-RT2 各0.5 μL,cDNA 1 μL.反应条件为94 ℃预变性3 min;然后以94 ℃30 s,55 ℃30 s,72℃2 min 进行30 个循环;于72 ℃延伸10 min,取3 μL 扩增产物用10 g/L 琼脂糖凝胶电泳鉴定(以下检测方法相同).

表1 扩增漆酶cDNA 序列和基因组序列引物Tab.1 Primers for amplifying the laccase gene fragment
1.4 漆酶cDNA3'/5'末端的RACE-PCR 扩增
参照3'RACE 试剂盒和SMART RACE cDNA 扩增试剂盒使用说明合成cDNA,根据漆酶cDNA 基因片段序列,设计3'/5'RACE 特异性引物(表1),从而获得漆酶cDNA 基因的3'/5'末端序列.cDNA3'末端套式PCR 反应体系25 μL,第1 次PCR 反应含10×LA PCR BufferⅡ(Mg2+Free)2 μL,MgCl2(25 mmol/L)1 μL,1×cDNA Dilution Buffer Ⅱ1 μL,3' RACE Outer Primer(10 μmol/L)1 μL,TaKaRa LA Taq®(5 U/μL)1 μL,Gene Specific Outer Primer(10 μmol/L)1 μL,cDNA 1 μL.反应条件:94 ℃预变性2 min;94℃30 s,58 ℃30 s,72 ℃2 min,20 个循环;72 ℃延伸15 min.第2 次PCR 反应含10×LA PCR Buffer Ⅱ(Mg2+Free)2.5 μL,MgCl2(25 mmol/L)2.5 μL,dNTP Mixture(2.5 mmol/L)4 μL,Gene Specific Inner Primer(10 μmol/L)1 μL,3' RACE Inner Primer(10 μmol/L)1 μL,TaKaRa LA Taq(5 U/μL)0.25 μL,1st PCR 产物0.5 μL.反应条件:94 ℃预变性2 min;94 ℃30 s,58 ℃30 s,72 ℃2 min,30 个循环;72 ℃延伸15 min.cDNA5'末端套式PCR 反应体系25 μL,10×Advantage2 PCR Buffer 2.5 μL,dNTP Mixture(10 mmol/L)0.5 μL,50×Advantage2 polymerase Mixture 0.5 μL,5' RACE-Ready cDNA 1.5 μL,GSP1(10 μmol/L)0.5 μL,UPM(10×)2.5 μL.反应条件同3' RACE.
1.5 漆酶cDNA 全长及Genomic DNA 全长的扩增
根据cDNA 3'/5'末端测序的结果,分别在其5'末端和3'末端设计特异性引物(表1),用于扩增漆酶cDNA 全长.同时,以基因组DNA 为模板,扩增漆酶Genomic DNA 全长.cDNA 全长PCR 反应体系50 μL,含5×Prime STARTMBuffer(Mg2+Plus)10 μL,dNTP Mixture(10 mmol/L)4 μL,Prime STARTMHS DNA Polymerase(2.5 U/μL)0.5 μL,引物Lcc2-S1 和Lcc2-S2 各1 μL,反转录cDNA 5 μL.Genomic DNA全长PCR 反应体系及反应条件同1.3.
1.6 SEFA-PCR 法克隆漆酶基因的启动子序列
根据已获得的漆酶Genomic DNA 全长序列,设计5'端启动子特异性引物,分别为:Lcc2-SP1、Lcc2-SP2、Lcc2-SP3(表1),以基因组DNA 为模板进行3轮PCR 扩增,获得漆酶基因5'端启动子序列.
1.7 漆酶基因结构及启动子结构分析
将上述获得的漆酶cDNA 全长和漆酶Genomic DNA 全长以及漆酶基因的启动子序列经过纯化试剂盒回收后,进行T 载体克隆,并送交生工生物工程(上海)股份有限公司测序.应用相关生物学软件对获得的漆酶cDNA 序列和漆酶基因组序列以及漆酶基因的启动子序列进行相似性比较及结构特点分析.
2 结果与分析
2.1 偏肿革裥菌漆酶cDNA 的克隆与序列分析
根据真菌漆酶基因保守的Cu-bind 结构域Ⅰ和Ⅳ氨基酸序列设计的简并引物扩增漆酶cDNA 核心片段,获得1 条约1 200 bp 基因片段,将其进行T 载体克隆并测序,结果得到大小为1 185 bp 的基因片段,其序列与GenBank 中序列Blastn 比对后得知其为漆酶基因片段(图1).根据获得的漆酶cDNA 核心片段的3'端保守区域设计特异性正向引物,以此引物扩增反转录的3'RACE cDNA,获得一大小约500 bp 条带,将其纯化后进行测序,获得基因片段为390 bp,其3'端有典型的PolyA 尾巴,在PolyA 尾前有一加尾信号(AATAAA)(图2).将该序列输入到Gen-Bank 中Blastx 比对后确认其与漆酶基因具有很高的相似性.根据获得的漆酶cDNA 核心片段5'端保守区域设计特异性反向互补引物,以此引物扩增反转录的5'RACE cDNA,获得一大小约750 bp 条带,将其纯化后测序,获得片段为753 bp,5'端有一非编码区(1~73 bp),编码区的长度为698 bp,该序列与RT-PCR 扩增的片段有重复区域,且将该序列输入到GenBank 中Blastx 比对后发现其与漆酶基因具有很高的相似性(图3).

图1 偏肿革裥菌漆酶基因的RT-PCR 结果Fig.1 RT-PCR products of laccase gene from Lenzites gibbosa

图2 偏肿革裥菌漆酶基因的3' RACE Outer PCR 和3'RACE Inner PCR 结果Fig.2 3' RACE Outer PCR and Inner PCR of laccase gene from Lenzites gibbosa

图3 偏肿革裥菌漆酶基因的5'RACE-PCR 结果Fig.3 5'RACE-PCR of laccase gene from Lenzites gibbosa
根据RT-PCR 获得的漆酶基因片段与3'/5'RACE 获得的漆酶基因片段具有重复区域,剪切拼接后得到一全长为1 563 bp 的漆酶基因,命名为Lg-lac2.该漆酶基因cDNA 序列在GenBank 上的登录号为JF817353.漆酶基因具有真核基因的一般特征:在其5'端有一非编码区,长度为73 bp;3'端有一典型的PolyA 尾巴和一加尾信号(AATAAA).通过NCBI 的ORF Finder 查找到1 条长1 563 bp 的完整开放式阅读框(Open reading frame,ORF),从第95~1 637 bp 的核苷酸片段的相对分子质量约为53 900,等电点(pI)约为5.65,限制性酶切位点有68 个,其编码520 个氨基酸.利用SignalP V2.0 软件分析编码的氨基酸序列发现其N 端包括一典型信号肽序列(1~21 氨基酸),剪切位点为VVG-AI.通过应用Scanprosite 程序可得出在漆酶基因编码的氨基酸序列中含有8 个N-糖基化位点(N-X-S/T),天冬酰胺残基分别位于氨基酸序列的第54、141、208、217、251、333、341、436 位,它们都是潜在的糖基化位点.应用RPS-Blast 进行保守结构域分析表明,该蛋白有3 个保守的结构域:即pfam07732、pfam07731 和pfam00394,其中pfam07732 和pfam07731 是多铜氧化酶中与次级代谢物生物合成、运输和分解代谢相关的结构域;第3 个pfam00394 是铜氧化酶(Cu-oxidase)的保守结构域(图4).将漆酶基因编码的氨基酸序列与GenBank 中登录的蛋白序列进行Blastp 比对后发现,它与其他真菌漆酶基因编码的氨基酸序列具有较高的相似性.其中与彩绒革盖菌Trametes versicolor 的氨基酸序列相似性评价最高,相似性达83%,与变色栓菌Trametes sp.I-62、栓菌Trametes sp.48424、灵芝Ganoderma lucidum 的漆酶基因序列相似性达到72%~81%.
2.3 漆酶Genomic DNA 全长的获得与结构分析
根据漆酶cDNA 的全长序列,设计1 对特异性引物,以基因组DNA 为模板通过PCR 扩增获得该漆酶Genomic DNA 的全长序列(图5),长度为2 165 bp,命名为Lg-lac2'.该序列在GenBank 中的登录号为JF906787.
通过比较漆酶基因的cDNA 和Genomic DNA 全长序列,发现该漆酶基因包含11 个外显子和10 个内含子.内含子的长度分别为56、53、64、51、53、59、58、57、67 和84 bp,是典型的真菌内含子的长度(49~85 bp)[3].内含子中剪切位点的特征序列为5'-GT…AG-3'(图4).
2.4 漆酶基因启动子的获得与转录调控元件分析
根据漆酶Genomic DNA 全长序列信息,参照Liu等[8]的方法,靠近5'端设计3 条反向引物Lcc2-SP1、Lcc2-SP2 和Lcc2-SP3,以偏肿革裥菌基因组DNA 为模板对该基因上游片段进行hiTAIL-PCR 扩增.3 轮反应后,引物Lcc2-SP1、Lcc2-SP2 和Lcc2-SP3 获得了较长的PCR 产物(图6).对第2 轮PCR 中的Lcc2-SP2 和AP2 引物产物进行回收测序,获得了总长度1 500 bp 的序列信息,分析发现该序列包括了漆酶基因5'末端及其上游.
利用Softberry 网站的Recognition of regulatory motifs with statistic 和Promoter prediction 对所克隆得到的Lg-Lac2'启动子序列进行分析.在所克隆的Lg-Lac2'启动子序列中,5' 端上游包含了真核生物启动子的基本转录调控元件,Lg-lac2'的启动子序列中存在许多潜在的外源诱导物响应结合元件:2 个CAAT框,分别位于第-702、-776 位;5 个AP2 元件,位于第-119、-173、-348、-365、-731 位;1 个热击元件(CreA)(SYGGRG),位于第-697 位;2 个潜在的压力响应元件(STRE)(CCCCT/AGGGG),分别位于第-38、-247 位;1 个潜在的热击响应元件(HSEs)(TCNNGAAN),位于第-23 位;1 个异生物质反应元件(XRE)(CACGCW),位于第-306 位;7 个氮因子结合位点(GATA)或其互补序列(TATC),分别位于第-81、-112、-154、-218、-579、-779、-842 位;3 个金属应答元件(MRE)(TGCRCNG),分别位于第-426、-451、-629 位;1 个ACE 作用元件,位于第-468位;1 个NIT2 元件,位于第-154 位[9-10](图4).
根据Lg-lac2 的Genomic DNA 全长序列的内含子及外显子的大小以及启动子序列的长度不同,在一定程度上与其他真菌进行比较.结果表明,Lg-lac2的TⅠ、TⅢ、TⅣ、TⅥ和TⅦ内含子与其他种相同,TⅡ、TⅤ和TⅧ内含子除Flammol/Lulina velutipes 较大外,其他几个种与Lg-lac2 相同,TⅨ和TⅩ内含子Lg-lac2 与其他真菌都有所不同.启动子序列以及3'非翻译区序列的长度各种间也有所不同(图7).由此可见,不同种类真菌的漆酶基因结构不同,从而导致漆酶基因的功能以及漆酶基因的表达调控也各不相同.
2.5 偏肿革裥菌漆酶基因的系统进化分析
漆酶是一个具有重要生物学功能的酶,其在真菌、植物和动物生长过程中起着不可忽视的作用[11-12].因此根据它的氨基酸变异情况可在一定程度上了解物种进化的规律.用Treeview 对白腐菌进行系统进化树分析,结果明显包括3 部分,分别是多孔菌Polyporales、伞菌Agaricales 和子囊菌Ascomycota.本文中的漆酶基因属于多孔菌,其中与Trametes versicolor 漆酶基因在系统进化过程中遗传距离最近,相似性评价最高.从系统进化树也可看出,同一物种漆酶基因不同的同工酶之间遗传距离也存在着差异(图8).

图4 Lg-lac2 基因的核苷酸序列和推导的氨基酸序列Fig.4 Nucleotide sequence and deduced amino acid sequence of the Lg-lac2 gene

图5 偏肿革裥菌漆酶Genomic DNA 全长的PCR 结果Fig.5 PCR products of laccase gene from Lenzites gibbosa
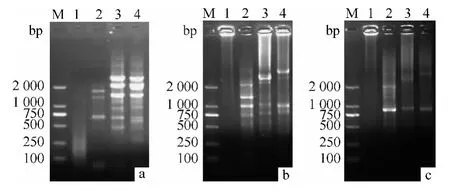
图6 偏肿革裥菌漆酶Genomic DNA 全长5'启动子hiTAILPCR 扩增Fig.6 HiTAIL-PCR products of 5'promoter of laccase gene from Lenzites gibbosa

图7 白腐真菌漆酶Genomic DNA 全长、启动子及3'非翻译区序列比对Fig.7 Comparison of promoter lengths and intron distribution for the novel Lenzites gibbosa laccase genes and other six selected fulllength sequences with higher or lower homologous laccases from six white-rot fungi

图8 Lg-lac2 基因的系统进化树分析Fig.8 Phylogenetic tree of Lg-lac2 gene
3 讨论与结论
对偏肿革裥菌漆酶同工酶基因启动子的克隆,有助于对偏肿革裥菌漆酶表达调控机制的进一步研究.同时,作为在偏肿革裥菌中克隆的可诱导型启动子,也为在偏肿革裥菌中构建诱导型表达载体提供了物质基础.另外,在偏肿革裥菌漆酶基因启动子的5'端调控区域,还分布有1 个潜在的热击响应元件(HSEs)和2 个潜在的压力响应元件(STRE).Faraco 等[2]在酵母菌Pichia pastoris 中证明,HSEs 能够感受外界强烈热刺激从而激活金属硫蛋白基因的转录,因而HSEs 和STRE 可能会共同响应高浓度Cu2+的压力而激活偏肿革裥菌漆酶基因的转录.Marzluf[6]的研究也表明,在酵母菌、粗糙脉孢菌Neurospora crassa 等真菌中,特异的氮因子结合元件(GATA)能够激活氮结构基因的转录.而本文在所克隆的偏肿革裥菌漆酶基因启动子序列上也分析到有7 个潜在的氮因子结合位点,这说明偏肿革裥菌漆酶基因还可能受到N 源的调控.
综上所述,本文利用RT-PCR、RACE 技术和SEFA-PCR 方法在偏肿革裥菌菌株中获得1 个新的漆酶基因cDNA 和Genomic DNA 的全长序列以及漆酶基因启动子序列.这对于今后研究漆酶基因在偏肿革裥菌生长发育过程中所起的生物学作用和进行基因遗传操作具有重要的意义.
[1]BALDRIAN P.Fungal laccases-occurrence and properties[J].FEMS Microbiol Rev,2006,30(2):215-242.
[2]FARACO V,GIARDINA P,SANNIA G.Metal-responsive elements in Pleurotus ostreatus laccase gene promoters[J].Microbiology,2003,149(8):2155-2162.
[3]RUSHMORE T H,KING R G,PAULSON K E.Regulation of glutathione S-transferase Ya subunit gene expression:Identification of a unique xenobiotic-responsive element controlling inducible expression by planar aromatic compounds[J].Proc Natl Acad Sci USA,1990,87(10):3826-3830.
[4]SODEN D M ,DOBSON A D W.Differential regulation of laccase gene expression in Pleurotus sajor-caju[J].Microbiology,2001,147(7):1755-1763.
[5]XIAO Y Z,CHEN Q,HANG J,et al.Selective induction,purification and characterization of a laccase isozyme from the basidiomycete Trametes sp.AH28-2[J].Mycologia,2004,96(1):26-35.
[6]MARZLUF G A.Genetic regulation of nitrogen metabolism in the fungi[J].Microbiol Mol Biol Rev,1997,61(1):17-32.
[7]陈军,高大文,池玉杰,等.偏肿拟栓菌Pseudotrametes gibbosa 产漆酶的条件优化[J].菌物学报,2008,27(6):940-946.
[8]LIU Yaoguang,CHEN Yuanling.High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences[J].Biotechniques,2007,43(5):649-50.
[9]TREGER J M,MAGEE T R,McENTEE K.Functional analysis of the stress response element and its role in the multistress response of Saccharomyces cerevisiae[J].Biochem Biophys Res Commun,1998,243(1):13-19.
[10]STRAUSS J,HORVATH H K,ABDALLAH B M,et al.The function of CreA,the carbon catabolite repressor of Aspergillus nidulans,is regulated at the transcriptiosl and post-transcriptional level[J].Molecular microbiology,1999,32(1):169-178.
[11]MOLDES D,SANROMÁN M Á.Amelioration of the ability to decolorize dyes by laccase:Relationship between redox mediators and laccase isoenzymes in Trametes versicolor[J].World J Microbiol Biotechnol,2006,22(11):1197-1204.
[12]TONG P,HONG Y,XIAO Y,et al.High production of laccase by a new basidiomycete,Trametes sp.[J].Biotechnol Lett,2007,29(2):295-301.
