以α-葡萄糖苷酶活性抑制率为指标优化山茱萸果肉的提取条件
2013-07-10李慧敏刘艳妮王小蕊康杰芳
李慧敏,刘艳妮,王小蕊,康杰芳
(陕西师范大学教育部药用资源与天然药物化学教育部重点实验室西北濒危药材资源开发国家工程实验室生命科学学院,陕西西安710062)
山茱萸(Cornus officinalis Sieb. et Zucc.)的干燥成熟果肉是三大名贵木本药材之一[1]。新鲜山茱萸果肉中含有单糖、多糖、有机酸、苷类、环烯醚萜类、黄酮、蒽醌、甾体和内酯等成分[2],临床上多用山萸肉和酒山萸肉;山茱萸是常用的降血糖药物[3],常出现在中医降血糖的组方中。现代药理研究结果表明:山茱萸所含的糖蛋白、熊果酸、齐墩果酸、多糖、苷类、鞣质和环烯醚萜类等成分都具有降血糖效果[4-11]。α-葡萄糖苷酶抑制剂通过抑制小肠黏膜刷状缘α-葡萄糖苷酶对食物中淀粉和糖类的降解,延迟并减少葡萄糖的吸收,从而降低餐后血糖;目前常用的此类降糖药物有阿卡波糖、伏格列波糖和米格列醇,但价格高、副反应和毒副作用较大,因此从天然动植物和矿物中寻找低毒、高效的α-葡萄糖苷酶抑制剂具有广阔的应用前景。
作者采用α-葡萄糖苷酶抑制剂微孔板高通量筛选模型,用单因素和正交实验设计相结合的方法对山茱萸果肉中α-葡萄糖苷酶抑制剂的提取工艺进行优化,为山茱萸果肉中降血糖活性成分的提取及深入开发利用提供理论依据。
1 材料和方法
1.1 实验材料
供试山茱萸果肉于2011 年10 月至11 月采集于陕西佛坪,经陕西师范大学植物学教研室鉴定为山茱萸的干燥成熟果肉,标本存放于陕西师范大学生命科学学院。称取去核的果肉400 g,粉碎并过40 目筛后备用。
供试的二甲基亚砜(DMSO)、α-葡萄糖苷酶(EC3.2.1.20)和4-硝基苯-α-D-吡喃葡萄糖苷(PNPG)均为美国Sigma公司出品,其余试剂均为分析纯。Anthos Zenyth 3100 酶标仪产自北京惠安泽泰科技有限公司,RE-52AA 型旋转蒸发仪产自上海亚荣生化仪器厂,XH-B 型旋涡混合器产自姜堰市康健医疗器具有限公司,KQ-600DB 台式数控超声波清洗器产自昆山市超声仪器有限公司。
1.2 方法
1.2.1 山茱萸果肉提取液的基础制备流程 准确称取果肉粗粉 0.5 g,根据不同实验设计的要求按料液比(W ∶V)1∶10 加入体积分数40%乙醇,振荡摇匀,放置3 h 后在30 ℃、420 W 条件下超声处理20 min,抽滤,滤液经旋转蒸发浓缩至10 mL,加入乙醚萃取油脂后静置10 min,旋转蒸发至无乙醚味,即为果肉提取液,可直接用于α-葡萄糖苷酶活性抑制率的测定。
1.2.2 α-葡萄糖苷酶活性测定 参照文献[12]的方法略加优化。在96 微孔板上每孔加0.1 mmol·L-1磷酸钾缓冲液(pH 6.8)180 μL,及 α-葡萄糖苷酶 15 μL 和提取液 4 μL,混匀后于37 ℃恒温处理 15 min;加入10 mmol·L-1PNPG 30 μL,混匀后于37 ℃恒温反应15 min;于波长405 nm 处测 OD值(ODc)。每个样品重复测定3 次,取平均值,计算抑制率。另设对照组a(用缓冲液代替样品提取液)、空白对照组b(用缓冲液代替α-葡萄糖苷酶和样品提取液)和样品对照组d(用缓冲液代替α-葡萄糖苷酶和底物),其余测定流程均相同,分别获得ODa、ODb和ODd,按以下公式计算抑制率:抑制率(I)=〔1-(ODc-ODd)/(ODa-ODb)〕×100%。此外,设置阿卡波糖阳性对照组e,测定阿卡波糖对α-葡萄糖苷酶活性的抑制率。
1.2.3 单因素实验设计 根据上述基础流程,分别设置料液比、乙醇浓度、超声处理温度和处理时间4 个单因素实验。其中料液比(W ∶V)分别为 1∶5、1∶10、1∶15、1∶20、1∶25 和 1∶30;乙醇体积分数分别为10%、20%、40%、60%、80%和100%;超声处理温度分别为 20 ℃、30 ℃、40 ℃、50 ℃ 、60 ℃ 和 70 ℃;超声处理时间为 10、20、30、40、50 和 60 min。每一单因素实验中除涉及的因素外,其余提取流程均与上述基本流程相同,并按上述方法测定提取液对α-葡萄糖苷酶活性的抑制率。
1.2.4 正交实验设计 在单因素实验基础上,采用L9(34)正交实验设计。料液比(W ∶V)为1∶10、1∶15 和1∶25;乙醇体积分数为30%、40%和50%;超声处理时间为30、40 和50 min;超声处理温度为50 ℃、60 ℃和70 ℃。按上述基础流程制备提取液并测定对α-葡萄糖苷酶活性的抑制率;并对获取的最优条件进行验证实验,3 次重复。
1.3 数据处理和分析
用Origin 软件计算果肉提取液对α-葡萄糖苷酶的半抑制浓度(IC50),并与阳性对照阿卡波糖的IC50进行对比。采用SPSS 17.0 统计分析软件进行数据处理和分析。
2 结果和分析
2.1 单因素实验结果
在料液比、乙醇浓度、超声处理温度和时间不同的条件下获得的果肉提取液对α-葡萄糖苷酶活性的抑制率见图1。
由图1-A 可知:随提取过程中料液比的增大,山茱萸果肉提取液对α-葡萄糖苷酶活性的抑制作用增强。其中,料液比1 ∶5 至1∶15,获得的提取液的抑制率明显升高;此后,抑制率趋于平稳。从成本角度考虑,料液比1∶15 比较适宜。
由图1-B 可知:提取过程中加入体积分数10% ~40%乙醇,获得的果肉提取液对α-葡萄糖苷酶活性的抑制率随乙醇体积分数的提高逐渐增加;用体积分数40%乙醇提取,获得的提取液抑制率最大。因此,最适宜的乙醇体积分数约为40%。
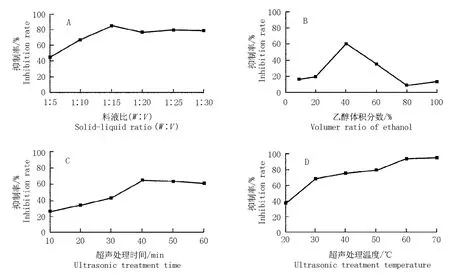
图1 在不同提取条件下获得的山茱萸果肉提取液对α-葡萄糖苷酶活性的抑制率Fig. 1 Inhibition rate of extract from Cornus officinalis Sieb. et Zucc. flesh obtained under different extraction conditions to α-glucosidase activity
由图1-C 可知:随提取过程中超声处理时间的延长,获得的果肉提取液对α-葡萄糖苷酶活性的抑制率逐渐增大;处理时间超过40 min,获得的提取液的抑制率趋于平缓。因此,最佳超声处理时间约为40 min。
由图1-D 可知:随提取过程中超声处理温度的升高,获得的果肉提取液对α-葡萄糖苷酶活性的抑制作用逐渐增强;处理温度高于60 ℃,获得的提取液的抑制率趋于平缓。所以,最适宜的超声处理温度约为60 ℃。
2.2 正交实验结果及最佳提取条件的验证
正交实验结果表明(表1):不同提取因素与山茱萸果肉提取液对α-葡萄糖苷酶活性抑制率有不同程度的关系,其中超声处理温度对α-葡萄糖苷酶活性抑制率的影响程度最大,而超声处理时间的影响程度最小。根据K 值推测山茱萸果肉的最优提取条件为 D3C2A3B1,即料液比 1∶15(W ∶V)、乙醇体积分数50%、超声处理温度70 ℃、超声处理时间30 min。
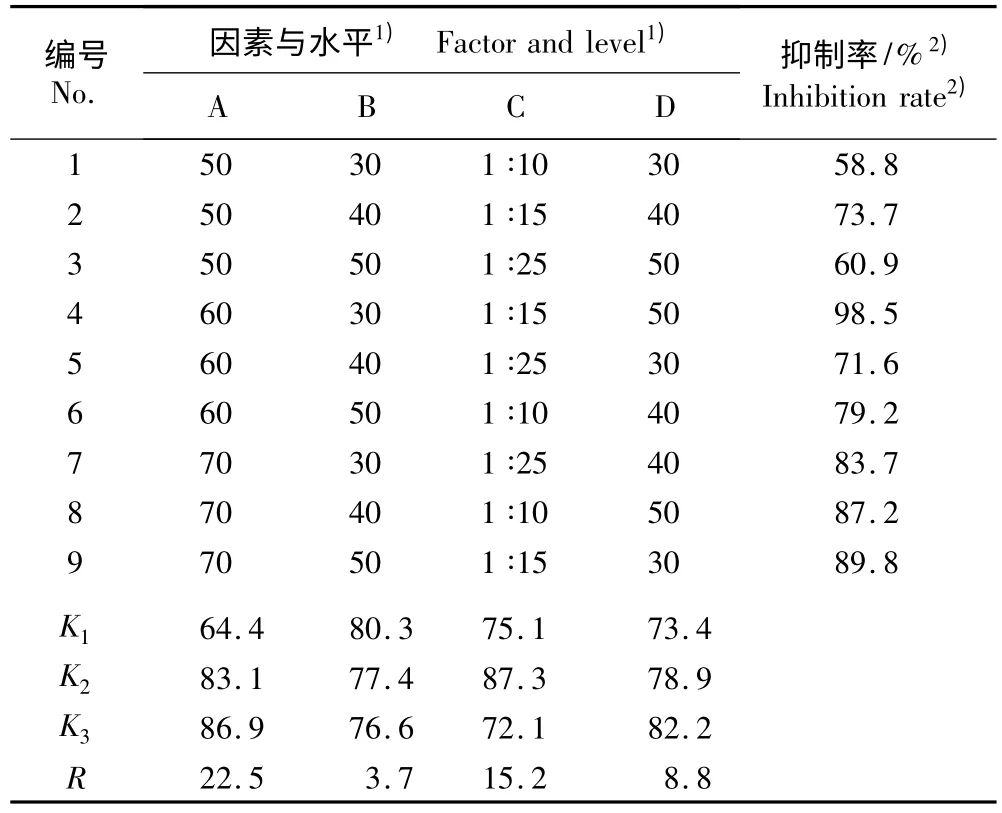
表1 山茱萸果肉提取液不同提取条件的正交实验结果Table 1 Result of orthogonal experiment of different extraction conditions of extract from Cornus officinalis Sieb. et Zucc. flesh
根据前述最优提取条件重复提取3 次,获得的果肉提取液对α-葡萄糖苷酶活性的抑制率分别为98.39%、98.43%和98.40%,平均值为 98.41%,RSD 为 0.021%,说明该提取条件稳定,且重现性良好。
将山茱萸果肉提取液配制成不同浓度并测其对α-葡萄糖苷酶活性的抑制率,其 IC50为409.30 mg·L-1,远低于阳性对照品阿卡波糖的IC50(890.48 mg·L-1),说明采用最佳提取条件获得的果肉提取液对α-葡萄糖苷酶活性抑制作用明显。
3 结 论
正交实验结果表明:在料液比1∶15、加入体积分数50%乙醇、超声处理温度70 ℃和超声处理时间30 min 的条件下获得的山茱萸果肉提取液对α-葡萄糖苷酶活性的抑制率最高,达98.5%。该提取条件稳定且重现性好。
山茱萸营养与药用价值均较高;山茱萸醇提物对糖尿病大鼠有明显的降糖作用,但对正常大鼠血糖无明显影响,且山茱萸总萜可以提高正常小鼠糖耐量,降低四氧嘧啶糖尿病模型小鼠的血糖值,提高血清胰岛素水平[11]。因而,对山茱萸降糖作用的深入研究将有广泛的应用前景。
[1]王花红,郭五保,顾 莹,等. 山茱萸药材指纹图谱的研究[J].西北植物学报,2004,24(10):1922-1928.
[2]于 淼,王晓先,贾 琳. 山茱萸的药理作用研究进展[J]. 东南国防医药,2010,12(3):240-243,260.
[3]高大威,范玉生,李 娜,等. 山茱萸活性成分的鉴定及降糖效果的研究[J]. 黑龙江畜牧兽医,2008(12):92-94.
[4]唐成康,高小平,徐大勇,等. 山茱萸糖蛋白的纯化及部分理化性质研究[J]. 天然产物研究与开发,2005,17(12):147-151.
[5]HSU J H,WU Y C,LIU I M,et al. Release of acetylcholine to raise insulin secretion in Wistar rats by oleanolic acid,one of the active principles contained in Cornus officinalis[J]. Neuroscience Letters,2006,404:112-116.
[6]许惠琴,朱 荃. 山茱萸环烯醚萜总苷对实验性糖尿病肾病的保护作用[J]. 南京中医药大学学报,2003,19(6):342-344.
[7]马庆一,陈丽华,杨海延,等. 山茱萸中α-葡萄糖苷酶抑制活性因子的筛选(Ⅰ)[J]. 食品科学,2007,28(1):167-170.
[8]YOKOZAWA T,YAMABE N,KIMH Y,et al. Protective effects of morroniside isolated from Corni Fructus against renal damage in streptozotocin-induced diabetic rats[J]. Biological and Pharmaceutical Bulletin,2008,31:1422-1428.
[9]YAMABE N,NOH J S,PARK C H,et al. Evaluation of loganin,iridoid glycoside from Corni Fructus, on hepatic and renal glucolipotoxicity and inflammation in type 2 diabetic db/db mice[J]. European Journal of Pharmacology,2010,648:179-187.
[10]YAMABE N,KANG K S,GOTO E,et al. Beneficial effect of Corni Fructus, a constituent of Hachimi-ji-gan, on advanced glycation end-product-mediated renal injury in Streptozotocintreated diabetic rats[J]. Biological and Pharmaceutical Bulletin,2007,30:520-526.
[11]韩璟超,季 晖,薛城锋,等. 山茱萸总萜的降血糖作用[J].中国天然药物,2006,4(2):125-129.
[12]张 丽. 滇丁香、茜草抑制α-葡萄糖苷酶活性成分研究[D].开封:河南大学药学院,2007:4-5.
