鲢鱼鱼鳞胶原蛋白肽抗氧化作用研究
2013-07-06陈日春熊文飞蔡一楠郑宝东
陈日春, 熊文飞, 蔡一楠, 郑宝东,*
(1.福建农林大学食品科学学院,福建福州 350002;2.福州市食品工业研究所,福建福州 350013)
大量研究表明,蛋白质水解物多具有抗氧化活性,可作为天然的抗氧化剂使用[1].蛋白质水解物是包含了肽类和氨基酸的混合物,主要通过酶解或微生物发酵制备,其中起主要作用的是小分子肽类.此外,与抗氧化酶的作用相比,蛋白质水解物的抗氧化活性更高、分子量更小且结构简单、更易吸收,摄入体内具有提高机体抗氧化能力和补充营养的双重效用[2].
胶原蛋白作为一种结构蛋白,在鱼类加工副产物(鱼鳞、鱼皮、鱼骨等)中含量非常丰富,充分利用这些胶原蛋白生产高附加值的活性肽,不仅能够变废为宝,还能一定程度上减少环境污染.胶原蛋白经酶水解后主要形成相对分子量较小的胶原蛋白肽,其吸收率更高,并能够促进蛋白质和碳水化合物的吸收[3].目前关于非鱼鳞胶原蛋白肽在动物体内抗氧化活性的研究报道较多[4-9],也已有研究表明源于鲤鱼鱼鳞、罗非鱼鱼鳞和草鱼鱼鳞的胶原蛋白肽在体外表现出良好的抗氧化活性[10-12],而针对鱼鳞胶原蛋白肽体内抗氧化活性的研究尚未见报道.因此本研究首先采用超滤膜对鲢鱼鱼鳞胶原蛋白肽(sliver carp scale collagen peptides,SCSCP)进行分离分级,通过6种体外抗氧化实验比较不同超滤组分的抗氧化活性强弱,初步筛选出抗氧化活性较强的组分;继而采用高脂饲料喂养大鼠,建立高血脂动物模型,对活性较强组分的抗氧化活性进行体内验证,旨在为明确SCSCP的抗氧化活性作用机理及相关功能性食品的开发提供理论基础.
1 材料与方法
1.1 材料与试剂
鲢鱼鱼鳞,收集于福州市华林永辉超市;胃蛋白酶(1∶3 000),上海源聚生物科技有限公司;碱性蛋白酶(2×105U/g),南宁庞博生物工程有限公司;氯化硝基四氮唑蓝(分析纯)、烟酰胺腺嘌呤二核苷酸(分析纯)、吩嗪硫酸甲酯(分析纯),上海源叶生物科技有限公司;1,10-菲啰啉(分析纯)、1,1-二苯基-2-苦基肼(分析纯),中科瑞泰(北京)生物科技有限公司;铁氰化钾、氯化铁、三氯乙酸、氯化亚铁、硫氰酸铁、硫酸氰胺、铁氰化钾均为分析纯,国药集团上海化学试剂有限公司;谷胱甘肽过氧化物酶(GSHPx)测试盒(比色法)、丙二醛(MDA)测试盒(TBA法)、超氧化物歧化酶(SOD)测试盒(羟胺法测总SOD),南京建成生物工程研究所;血脂康胶囊,北大维信生物科技有限公司;清洁级SD大鼠(雄性,体重110~130 g),上海斯莱克动物实验中心.
1.2 主要仪器设备
AR1140型电子天平,梅特勒-托利多仪器(上海)有限公司;XMTD-8222型自动恒温振荡器,上海精宏试验室设备有限公司;H2050R型台式高速大容量冷冻离心机,湘仪离心机有限公司;LGJ-10D型冷冻干燥机,北京四环科学仪器厂;UV-1600型紫外分光光度计,上海美谱达仪器有限公司;L-8800型氨基酸自动分析仪,日立公司;YW-MIC-03型试验室微型多功能膜分离设备,合肥禹王膜工程技术有限公司.
1.3 实验方法
1.3.1 鲢鱼鱼鳞胶原蛋白抗氧化肽的制备
新鲜鱼鳞用冰纯水清洗除杂后,用EDTA进行脱钙处理[13],脱钙后的鱼鳞于0.1mol/L氢氧化钠溶液中浸泡6 h脱除非胶原蛋白,料液比(g/mL)1∶8;将经脱钙和除去非胶原蛋白后的鱼鳞浸泡于0.5 mol/L乙酸溶液中,添加0.85%胃蛋白酶,液料比(g/mL)1∶18,提取胶原蛋白;经300目滤布过滤得到胶原蛋白提取液,向提取液中添加氯化钠至其浓度达0.9mol/L,盐析24 h,然后冷冻离心(10000 r/min,15min)获得胶原蛋白沉淀物,将沉淀物置于截留分子量为10 ku的透析袋中透析24 h,冻干得到胶原蛋白;将胶原蛋白冻干粉配成质量分数为5.47%的溶液,溶液pH值调至8.0,添加4 200 U/g碱性蛋白酶于50℃酶解4.24 h,得到胶原蛋白肽溶液备用.
1.3.2 鲢鱼鱼鳞胶原蛋白抗氧化肽的膜分离分级
在室温条件下,依次采用截留分子量为5,3,1 ku的三级超滤膜对鲢鱼鱼鳞胶原蛋白酶解产物进行分离分级.各超滤组分表示为SCSCP-Ⅰ(分子量大于5 ku)、SCSCP-Ⅱ(分子量为 3 ~5 ku)、SCSCP-Ⅲ(分子量为1~3 ku)、SCSCP-Ⅳ(分子量小于1 ku).三级膜分离压力分别为0.15,0.20,0.25 MPa,料液质量浓度均为10 mg/mL.膜分离工艺流程见图1.
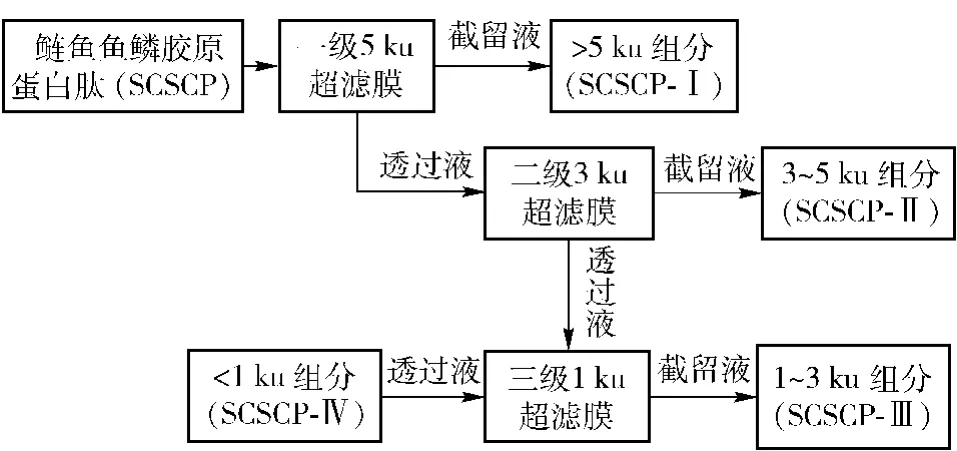
图1 SCSCP的膜分离工艺流程Fig.1 SCSCPmembrane separation process
1.3.3 DPPH·自由基清除活性的测定
DPPH·自由基清除活性的测定参照Shimada等[14]的方法略作修改.取2.5 mL样品液置于试管中,加入2.5mL溶于体积分数为95%乙醇的DPPH溶液(0.1mmol/L),将混合物激烈振荡10 s,然后置于室温下反应30 min,反应结束后,于517 nm下测量反应混合物吸光度,同时以2.5mL蒸馏水代替样品液做空白对照.样品液对DPPH自由基清除活性按式(1)计算.

式(1)中:A0为空白对照吸光度,A为样品吸光度.
1.3.4自由基清除活性的测定
·自由基清除活性的测定参照Wang等[15]的方法略作修改.取1mL样品溶液置于试管中,加入1mL氯化硝基四氮唑蓝(NBT,2.52 mmol/L)和1 mL烟酰胺腺嘌呤二核苷酸(624 mmol/L),添加1 mL吩嗪硫酸甲酯溶液(PMS,120μmol/L)启动反应,于25℃下反应5min后测量产物560 nm处吸光度,同时以蒸馏水代替样品液做空白对照.样品液对超氧阴离子自由基的清除活性按式(2)计算.

式(2)中:B0为空白对照吸光度,B为样品吸光度.
1.3.5 ·OH自由基清除活性的测定
·OH自由基清除活性的测定参照Wang等[15]的方法.取1.0mL 1,10-菲啰啉(1.865mmol/L)与2.0mL样品液于具塞试管中混合,加入1.0 mL FeSO4·7H2O(1.865 mmol/L), 最 后 加 入 1 .0 mL H2O2溶液(体积分数为0.03%)启动反应,将试管置于37℃水浴中反应60 min,于536 nm处测量反应混合液吸光度,并以蒸馏水代替样品液做阴性对照,以蒸馏水代替过氧化氢作为空白对照.样品对羟自由基的清除活性按式(3)计算.

式(3)中:C为样品吸光度,C1为阴性对照吸光度,C0为空白对照吸光度.
1.3.6 还原力的测定
还原力的测定参照Kaur等[16]的方法.将2mL样品溶液与5 mL磷酸盐缓冲液(0.2 mol/L,pH值为6.6)混合,加入5mL质量分数为1%铁氰化钾溶液,将混合物在50℃下保温20min.最后加入5mL体积分数为10%的三氯乙酸(TCA)溶液,混匀,在3 000 r/min下离心10 min.取2 mL上清液和1 mL蒸馏水混合,加入0.5mL质量分数为0.1% 氯化铁溶液,于700 nm下测量吸光度,吸光度越高说明样品的还原能力越强.
1.3.7 金属离子螯合力的测定
采用样品对亚铁离子的螯合能力来评价其对金属离子的螯合特性[17].取800μL样品液(20mg/mL)置于试管中,加入10μL氯化亚铁溶液(2 mmol/L)和20μL菲啰啉溶液(5 mmol/L),混匀后于室温下反应10min,测量反应液在波长为562 nm时的吸光度,并采用蒸馏水代替样品液做空白对照.SCSCP对亚铁离子的螯合率按式(4)计算.
亚铁离子螯合率=((1-D/D0)×100%.(4)式(4)中:D为样品吸光度,D0为空白对照吸光度.
1.3.8 脂质氧化抑制活性的测定
脂质氧化的抑制能力通过硫氰酸铁比色法确定[18].取0.5 mL样品液置于试管中,加入2.0 mL磷酸钠缓冲溶液(0.2mol/L,pH值为7.0)和2.5mL溶于体积分数为95%乙醇的亚油酸溶液(2 mg/mL),混匀后置于37℃培养箱中反应7 d.每隔24 h取0.1mL反应产物置于试管中,加入4.7 mL乙醇溶液(体积分数为75%),0.1mL硫酸氰胺溶液(质量分数为30%)和0.1mL溶于体积分数为3.5%盐酸的氯化亚铁溶液(20 mmol/L),将该混合物激烈振荡反应3min,于500 nm处测定其吸光度,同时以蒸馏水代替样品液做空白对照,以二丁基羟基甲基(BHT)做阳性对照.SCSCP对脂质氧化抑制活性按式(5)计算.
脂质氧化抑制率=((1-E/E0)×100%.(5)式(5)中:E为样品吸光度,E0为空白对照吸光度.
1.3.9 动物饲料
基础饲料按照GB14924.3—2010[19]配制;高脂饲料配方:基础饲料79%、猪油10%、蛋黄粉10%、胆固醇1%.
1.3.10 动物的饲养与分组
实验动物共分为6组.正常对照组、模型组、SCSCP高中低剂量组,阳性对照组.每组10只清洁级SD大鼠,其中正常对照组喂基础饲料,其他组均喂高脂饲料.各组每天上午灌胃,正常对照组与模型组以蒸馏水灌胃,阳性对照组以血脂康灌胃,高中低剂量组分别灌胃150,300,600 mg/kg体重的SCSCP水溶液.实验期间各组大鼠均自由进食和饮水.
1.3.11 样品采集
实验期间,每天记录各组实验前后大鼠体重及处死后大鼠的肝脏和脾脏质量.大鼠持续喂养6周后,禁食12 h,摘眼球取血,于4℃下4 000 r/min离心10min,制备血清.
1.3.12 GSH-Px、MDA、SOD 的测定
按试剂盒使用说明对大鼠血清中 GSH-Px、MDA、SOD进行测定.
1.3.13 氨基酸组成的测定
取样品20mg置于6mol/L盐酸溶液中,于110℃真空条件下酸水解24 h,然后采用氨基酸分析仪测定水解液中氨基酸组成.
1.4 数理统计
采用DPS7.05软件进行单因素方差分析,组间比较采用Tukey法,P<0.05表示差异显著.实验结果以平均值±SD表示.
2 结果与分析
2.1 不同超滤组分对DPPH·自由基的清除作用
不同超滤组分对DPPH·自由基的清除结果见图2.由图2可知,随着胶原蛋白肽质量浓度的增加,各超滤组分DPPH·自由基清除率不断上升,表明胶原蛋白肽不同超滤组分对DPPH·自由基的清除率具有密切的量效关系.当胶原蛋白肽各超滤组分质量浓度增加到8 mg/mL时,SCSCP-Ⅰ、SCSCP-Ⅱ、SCSCP-Ⅲ、SCSCP-Ⅳ对 DPPH·自由基的清除率分别为(55.72±2.69)%,(67.43±2.34)%,(71.07±1.06)%,(85.06±3.23)%,结果显示SCSCP-Ⅳ对DPPH·自由基的清除活性最强(P<0.05).与同质量浓度的 Vc比较,SCSCP-Ⅳ对DPPH·自由基的清除率仍较弱,相差16.98%(P<0.05).超滤前8mg/mL SCSCP对DPPH·自由基的清除率为(55.55±1.09)%,低于 SCSCP-Ⅱ、SCSCP-Ⅲ、SCSCP-Ⅳ对DPPH·清除活性(P<0.05).

图2 胶原蛋白肽不同超滤组分对DPPH·的清除作用Fig.2 DPPH·scavenging activity of different UF fractions of collagen peptides
2.2 不同超滤组分对O-2·自由基的清除作用
不同超滤组分对·自由基的清除结果见图3.由图3可知,随着胶原蛋白肽质量浓度的增加,各超滤组分对·自由基清除率不断上升,在胶原蛋白肽质量浓度由0 mg/mL增加到4 mg/mL的过程中,胶原蛋白肽不同超滤组分对·自由基的清除率具有密切的量效关系.然而随着胶原蛋白肽浓度的进一步增加,·自由基清除率并没有显著的提高(P>0.05).当胶原蛋白肽各超滤组分质量浓度为 4 mg/mL 时,SCSCP-Ⅰ、SCSCP-Ⅱ、SCSCP-Ⅲ、SCSCP-Ⅳ对·自由基的清除率分别为(56.53±2.70)%,(63.20±2.98)%,(63.29±2.45)%,(63.66±1.56)%,结果显示SCSCP-Ⅳ对·自由基的清除活性最强,但差异并不显著(P>0.05).与同浓度的Vc比较,SCSCP-Ⅳ对·自由基的清除活性仍较弱(P<0.05),相差54.70%.超滤前4 mg/mL SCSCP对·自由基的清除率为(61.51±1.50)%,低 于 SCSCP-Ⅱ、SCSCP-Ⅲ、SCSCP-Ⅳ 对·清除活性,但差异并不显著(P>0.05).结果表明,不同分子量的鲢鱼鱼鳞胶原蛋白肽对的清除活性差异不明显(P>0.05).
2.3 不同超滤组分对·OH自由基的清除作用
不同超滤组分对·OH自由基的清除结果见图4.由图4可知,随着胶原蛋白肽质量浓度的增加,各超滤组分对·OH自由基清除率不断上升,表明胶原蛋白肽不同超滤组分对·OH自由基的清除率具有密切的量效关系.当胶原蛋白肽各超滤组分质量浓度为 8 mg/mL 时,SCSCP-Ⅰ、SCSCP-Ⅱ、SCSCP-Ⅲ、SCSCP-Ⅳ对·OH自由基的清除率分别为(53.30±1.74)%,(66.08±1.52)%,(74.82±1.46)%,(78.79±1.24)%,结果显示SCSCP-Ⅳ对·OH自由基的清除活性最强(P<0.05).与同质量浓度的Vc比较,SCSCP-Ⅳ对·OH自由基的清除率仍较弱(P<0.05),相差20.92%.超滤前8 mg/mL SCSCP对·OH自由基的清除率为(62.14±1.03)%,低于SCSCP-Ⅱ、SCSCP-Ⅲ、SCSCP-Ⅳ对·OH 清除活性.结果表明,超滤处理能够富集鲢鱼鱼鳞胶原蛋白肽中对·OH自由基清除活性较强的组分,且不同分子量的胶原蛋白肽对·OH自由基的清除活性相差较大(P<0.05).
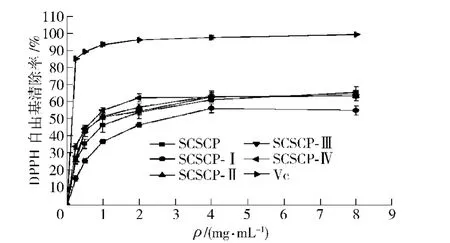
图3 胶原蛋白肽不同超滤组分对·的清除作用Fig.3 ·scavenging activity of different UF fractions of collagen peptides
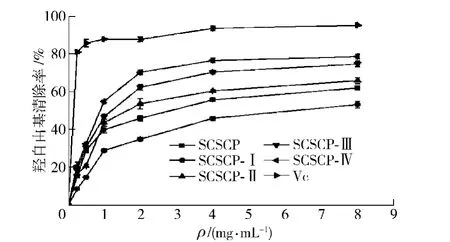
图4 胶原蛋白肽不同超滤组分对·OH的清除作用Fig.4 ·OH scavenging activity of different UF fractions of collagen peptides
2.4 不同超滤组分的还原力
不同超滤组分的还原力见图5.由图5可知,随着胶原蛋白肽质量浓度的增加,各超滤组分还原力不断上升,表明胶原蛋白肽不同超滤组分的还原力具有密切的量效关系.当胶原蛋白肽各超滤组分质量浓度为 8 mg/mL 时,SCSCP-Ⅰ、SCSCP-Ⅱ、SCSCP-Ⅲ、SCSCP-Ⅳ的还原力分别为0.587±0.012,0.617±0.015,0.667±0.021,0.937±0.047,结果显示SCSCP-Ⅳ的还原力最强(P<0.05).与同质量浓度的GSH-比较,SCSCP-Ⅳ的还原力仍较弱(P<0.05),相差30.20%.超滤前8mg/mL SCSCP的还原力为 0.620±0.010,低于 SCSCP-Ⅲ(P>0.05)和SCSCP-Ⅳ(P<0.05)的还原力.结果表明,超滤处理能够富集鲢鱼鱼鳞胶原蛋白肽中还原力较强的组分,且不同分子量的胶原蛋白肽还原力差异较明显(P<0.05).

图5 胶原蛋白肽不同超滤组分的还原力Fig.5 Reducing power of different UF fractions of collagen peptides
2.5 不同超滤组分的金属离子螯合力
不同超滤组分的金属离子螯合力见图6.由图6可知,随着胶原蛋白肽质量浓度的增加,各超滤组分对亚铁离子的螯合率不断上升,表明胶原蛋白肽不同超滤组分对亚铁离子的螯合率具有密切的量效关系.当胶原蛋白肽各超滤组分质量浓度为8mg/mL时,SCSCP-Ⅰ、SCSCP-Ⅱ、SCSCP-Ⅲ、SCSCP-Ⅳ对亚铁离子的螯合率分别为(55.53±1.62)%,(64.47±2.70)%,(66.10±2.25)%,(73.47±1.50)%,结果显示SCSCP-Ⅳ对亚铁离子的螯合率最强(P<0.05).与同质量浓度的 EDTA比较,SCSCP-Ⅳ对亚铁离子的螯合率仍较弱(P<0.05),相差35.97%.超滤前8mg/mL SCSCP对亚铁离子的螯合率为(62.30±1.28)%,低于SCSCP-Ⅱ(P>0.05)、SCSCP-Ⅲ(P > 0.05)、SCSCP-Ⅳ(P < 0.05)对亚铁离子的螯合率.结果表明,超滤处理能够在一定程度上富集鲢鱼鱼鳞胶原蛋白肽中对亚铁离子的螯合率较强的组分,且分子量小于1 ku的胶原蛋白肽对亚铁离子的螯合率较为突出(P<0.05).
2.6 不同超滤组分的脂质氧化抑制作用
不同超滤组分对脂质氧化的抑制作用见图7.由图7可知,随着胶原蛋白肽质量浓度的增加,各超滤组分对脂质氧化的抑制率不断上升,表明胶原蛋白肽不同超滤组分对脂质氧化的抑制率具有密切的量效关系.当胶原蛋白肽各超滤组分质量浓度为8 mg/mL 时,SCSCP-Ⅰ、SCSCP-Ⅱ、SCSCP-Ⅲ、SCSCP-Ⅳ对脂质氧化的抑制率分别为(44.87±2.26)%,(58.83±1.37)%,(63.80±2.08)%,(72.73±0.45)%,结果显示SCSCP-Ⅳ对脂质氧化的抑制率最强(P<0.05).与同质量浓度的 B HT比较,SCSCP-Ⅳ对脂质氧化的抑制率要低24.67%(P<0.05).超滤前8mg/mL SCSCP对脂质氧化的抑制率为(55.57±1.16)%,低于 S CSCP-Ⅱ(P >0.05)、SCSCP-Ⅲ(P <0.05)、SCSCP-Ⅳ(P <0.05)对脂质氧化的抑制率.结果表明,超滤处理能够在一定程度上富集鲢鱼鱼鳞胶原蛋白肽中对脂质氧化的抑制率较强的组分,且不同分子量的胶原蛋白肽对脂质氧化的抑制率的差异较为明显(P<0.05).

图6 胶原蛋白肽不同超滤组分的亚铁离子螯合活性Fig.6 Fe2+-chelating activity of different UF fractions of collagen peptides

图7 胶原蛋白肽不同超滤组分对脂质氧化的抑制活性Fig.7 Inhibition activity of lipid oxidation of different UF fractions of collagen peptides
2.7 不同超滤组分的氨基酸组成
为阐述氨基酸侧链对SCSCP抗氧化活性的影响,分别收集SCSCP各超滤组分进行氨基酸分析,其结果如表1.各超滤组分中谷氨酸、甘氨酸、丙氨酸、精氨酸、脯氨酸和羟脯氨酸含量均较高,SCSCP-Ⅳ中总疏水性氨基酸含量最高.Chen等[20]报道抗氧化剂的疏水性是其接近疏水性物质的重要途径.对蛋白质水解物和肽而言,疏水性的提高可增加在油脂中的溶解性,从而加强其抗氧化活性[21].有报道指出,来源于不同蛋白的抗氧化肽的抗氧化活性与其疏水性的提高密切相关[22].因此推测SCSCP-Ⅳ较高的抗氧化活性与其总疏水性氨基酸含量较高紧密相关.此外,Chen等[23]研究发现组氨酸和精氨酸分别含有的较活泼的咪唑环和胍基能够有效地与孤对电子结合,可对抗氧化和螯合金属离子作出较大贡献,这也可能是SCSCP-Ⅳ具有较高抗氧化活性的另一原因.
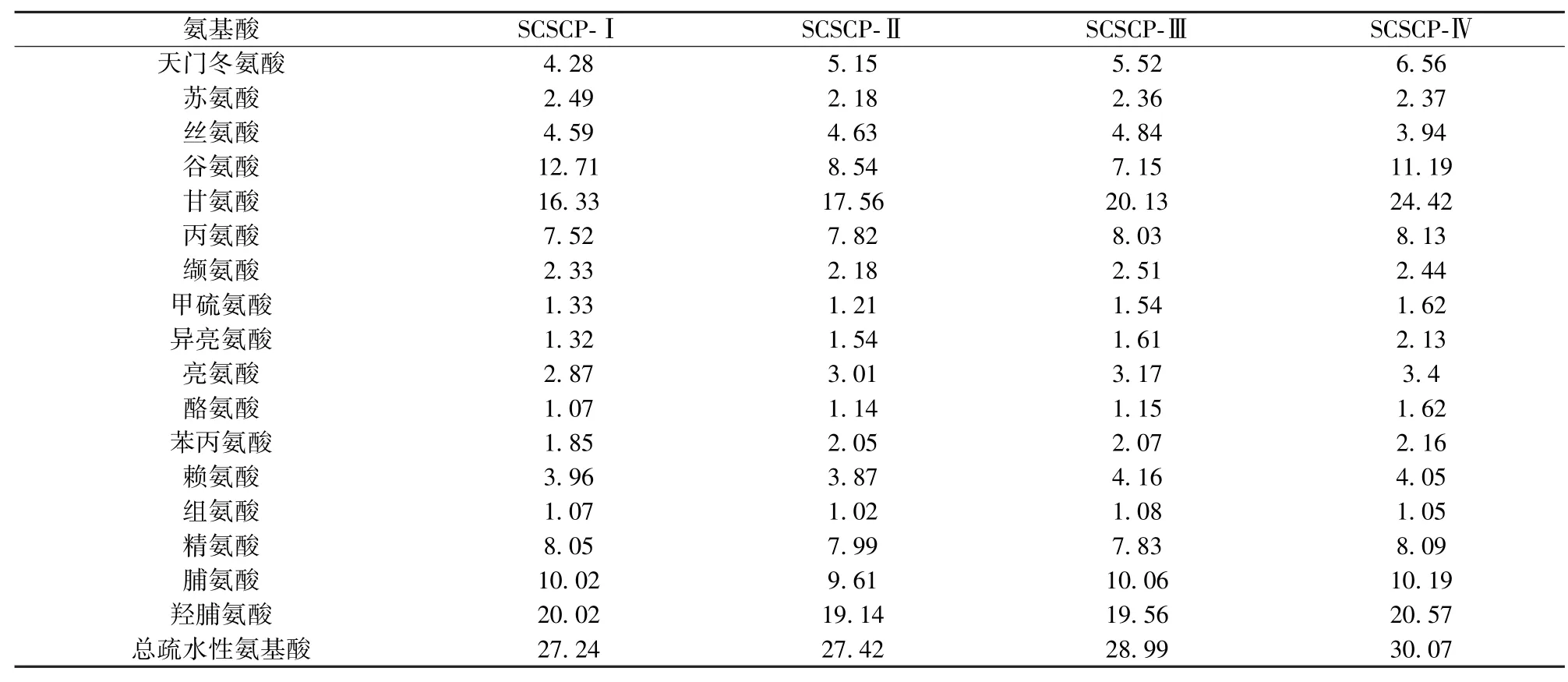
表1 SCSCP不同超滤组分的氨基酸组成Tab.1 Amino acid composition of UF fractions of SCSCP-mg/100 g
2.8 SCSCP-Ⅳ动物体内抗氧化试验结果分析
根据体外实验结果,SCSCP-Ⅳ的抗氧化活性较强,为进一步验证其抗氧化性能,设计动物试验,考察其在大鼠体内的抗氧化活性.
2.8.1 SCSCP-Ⅳ对大鼠体重及肝、脾指数的影响
SCSCP-Ⅳ对大鼠体重及肝、脾指数的影响结果见表2.由表2可知,体重:造模前各组之间的大鼠体重无显著差别(P<0.05),连续喂养6周后,模型组体重显著高于其他各组(P<0.01).肝脏指数:模型组显著高于正常对照组和SSCP高剂量组(P<0.01或P<0.05).脾脏指数:各组与正常对照组之间无显著差异(P>0.05),模型组明显高于SSCP高剂量组与阳性对照组(P<0.01或P<0.05).

表2 SCSCP对大鼠体重及肝脾指数的影响Tab.2 Effects of SCSCP on body weight and index of liver and spleen
2.8.2 SCSCP-Ⅳ对大鼠血清中 MDA含量以及SOD与GSH-Px活力的影响
SCSCP-Ⅳ对大鼠血清中MDA含量以及SOD与GSH-Px活力的影响结果见表3.由表3可知,与正常对照组比,高脂模型组的MDA含量明显增高(P<0.05),SOD与GSH-Px活力明显降低(P<0.05);SCSCP剂量组与正常对照组之间的MDA含量与SOD活力无显著差异(P>0.05),GSH-Px活力明显提高(P<0.05).与高脂模型组比,SSCP各剂量组MDA含量明显降低(P<0.05),SOD活力显著提高(P<0.05);SCSCP中高剂量组GSH-Px活力显著提高(P<0.01).阳性对照组MDA含量明显降低(P<0.05),SOD与GSH-Px活力显著提高(P<0.01或P<0.05).
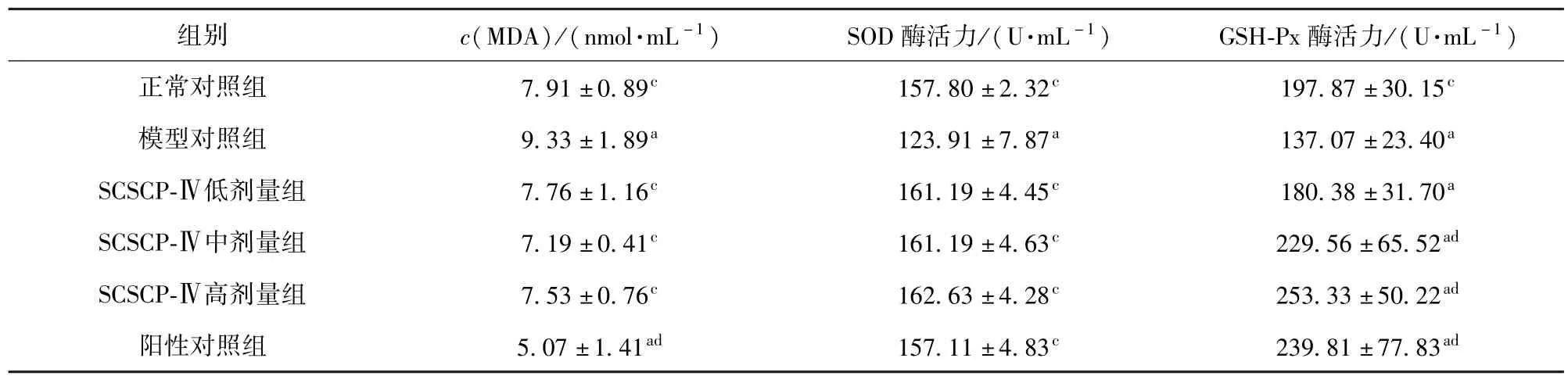
表3 SCSCP对血清中MDA含量以及SOD与GSH-Px活力的影响Tab.3 Effects of SSCP on MDA,SOD and GSH-Px activities in serum
3 结 论
本研究采用截留分子量分别为5,3,1 ku的超滤膜对鲢鱼鱼鳞胶原蛋白肽(SCSCP)进行分离分级,采用6种体外抗氧化指标评价各超滤组分抗氧化活性的强弱,建立了高脂动物模型,考察体外抗氧化活性较强的超滤组分在大鼠体内的抗氧化作用.
1)体外抗氧化实验结果表明,SCSCP各超滤组分与体外抗氧化评价指标间存在显著的量效关系,不同超滤组分的抗氧化活性不同,其中SCSCP-Ⅳ(分子量小于1 ku)的体外抗氧化活性最强(P<0.05).氨基酸组成分析表明,SCSCP-Ⅳ中总疏水性氨基酸和精氨酸含量均较高,推测可能与其较高的抗氧化活性有关.
2)采用高脂饲料喂食大鼠建立高脂血症动物模型的研究结果表明,SCSCP-Ⅳ能显著提高大鼠血清中抗氧化酶SOD与GSH-Px活力以及降低MDA含量(P<0.05).表明SCSCP-Ⅳ在大鼠体内具有较好的抗氧化作用.
3)本实验结果明确了鲢鱼鱼鳞胶原蛋白肽的体内外抗氧化功能,但对于其具体起作用的功效成分和作用机理,以及相关功能性食品的研究与开发还有待于进一步研究.
[1] Di Bernardini R,Harnedy P,Bolton D,et al.Antioxidant and antimicrobial peptidic hydrolysates from muscle protein sources and by-products[J].Food Chemistry,2011,124(4):1296-1307.
[2] Pappenheimer JR,Volpp K.Transmucosal impedance of small intestine:correlation with transport of sugars and amino acids[J].American Journal of Physiology-Cell Physiology,1992,263(2):480-493.
[3] 丁进锋,苏秀榕,李妍妍,等.海蜇胶原蛋白肽的降血脂及抗氧化作用的研究[J].天然产物研究与开发,2012,24(3):362-365.
[4] 耿浩,刘云玲,马超,等.多棘海盘车体壁胶原蛋白肽的制备及其抗氧化活性[J].食品与发酵工业,2011,37(6):42-46.
[5] 邱芳萍,王长周,季晓枫.林蛙皮胶原蛋白肽酶解工艺数学建模及抗氧化作用的研究[J].食品与生物技术学报,2013(1):89-93.
[6] 李亚欣,施用晖,王洁昀,等.胶原蛋白肽对高脂日粮小鼠抗氧化能力和血脂代谢的影响[J].天然产物研究与开发,2011,23(1):54-58.
[7] 林云鉴,乐国伟,施用晖,等.猪骨胶原蛋白肽缓解高脂饮食诱导小鼠肝脏氧化应激的基因芯片分析[J].天然产物研究与开发,2012,24(4):454-459.[8] 王军波,谢英,裴新荣,等.海洋胶原肽的分子组成及其降血脂和抗氧化作用研究[C]∥营养与食品——健康中国高级论坛Ⅱ.大连:中国食品科学技术学会营养支持专业委员会,2008:42-47.
[9] Saito M,Kiyose C,Higuchi T,et al.Effect of collagen hydrolysates from salmon and trout skins on the lipid profile in rats[J].Journal of Agricultural and Food Chemistry,2009,57(21):10477-10482.
[10] 沈澎.鲤鱼鱼鳞胶原肽的制备及特性研究[D].长春:吉林农业大学,2011.
[11] 胡娟.酶解鱼鳞明胶制备生物活性肽的研究[D].广州:华南理工大学,2010.
[12] 申锋,杨莉莉,熊善柏,等.胃蛋白酶水解草鱼鱼鳞制备胶原肽的工艺优化[J].华中农业大学学报,2010,29(3):387-391.
[13] 陈日春.鲢鱼鱼鳞的脱钙工艺[J].农产品加工·学刊,2013(2):42-44.
[14] Shimada K,Fujikawa K,Yahara K,etal.Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J].Journal of Agricultural and Food Chemistry,1992,40(6):945-948.
[15] Wang B,Li Z R,Chi C F,et al.Preparation and evaluation of antioxidant peptides from ethanol-soluble proteins hydrolysate of Sphyrna lewini muscle[J].Peptides,2012.36(2):240-250.
[16] Kaur R,Arora S,Singh B.Antioxidant activity of the phenol rich fractions of leaves of Chukrasia tabularis A.Juss[J].Bioresource Technology,2008,99(16):7692-7698.
[17] Chung Y C,Chang C T,Chao WW,et al.Antioxidative activity and safety of the 50 ethanolic extract from red bean fermented by bacillus subtilis IMR-NK1[J].Journal of Agricultural and Food Chemistry,2002,50(8):2454-2458.
[18] Yang J I,LiangWS,Chow C J,et al.Process for the production of tilapia retorted skin gelatin hydrolysates with optimized antioxidative properties[J].Process Biochemistry,2009,44(10):1152-1157.
[19] 国家质量监督检验检疫总局.GB 14924.3—2010实验动物小鼠大鼠配合饲料[S].北京:中国标准出版社,2001:485-487.
[20] Chen H M,Muramoto K,Yamauchi F,et al.Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein[J].Journalof Agriculturaland Food Chemistry,1996,44(9):2619-2623.
[21] Rajapakse N,Mendis E,Byun H G,et al.Purification and in vitro antioxidative effects of giant squid muscle peptides on free radical-mediated oxidative systems[J].The Journal of Nutritional Biochemistry,2005,16(9):562-569.
[22] Wang J,Zhao M,Yang X,etal.Improvementon functional properties ofwheat gluten by enzymatic hydrolysis and ultrafiltration[J].Journal of Cereal Science,2006,44(1):93-100.
[23] Chen H M,Muramoto K,Yamauchi F,et al.Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J].Journal of Agricultural and Food Chemistry,1998,46(1):49-53.
