天然活性成分生物转化的微生物、特异酶及其应用
2013-07-06金凤燮鱼红闪孙长凯芦明春刘春莹张春枝徐龙权
金凤燮, 鱼红闪, 孙长凯, 芦明春, 刘春莹, 张春枝, 徐龙权
(1.大连工业大学生物工程学院,辽宁大连 116034;2.大连医科大学脑疾病研究所,辽宁大连 116044)
我国中草药植物有万余种,但其中少部分只用于药,大部分用于公众营养和保健食品,用于化妆品以及日用化学制品——牙膏甚至色素和墨水等.这些植物的天然活性成分种类繁多,超过6万余种,可归纳为几大类:配糖体类(包括三萜皂苷和甾醇皂苷)、黄酮类、醌类、苯丙素类、生物碱类、鞣质、酯类等[1].但是这些植物主要的天然成分与化学药不同,化学药口服后直接吸收,起药效;而大部分主要的天然成分人体难吸收、活性低,口服后在消化系统内转化为另一种高活性结构,吸收起功效;而且人体内这种转化很弱,大部分很难利用[2-3].因此,在体外改变低活性、难吸收的天然成分,制备高活性、易吸收的有效成分,对公众营养食品、功能食品和化妆品、日化产品以及中草药行业技术升级意义巨大.
改变植物天然活性成分结构,生物转化是很有效的方法.然而,其种类繁多,结构复杂,现有的微生物和酶解决不了中草药天然成分的生物转化,必须开发许多新微生物和新酶类,才能解决天然成分转化制备易吸收、高活性成分的问题.
为此,为了得到易吸收、高活性的天然有效成分,本文筛选一批新微生物,发现一批新型特异的天然成分转化酶,研究了其特性和应用开发.
1 天然产物生物转化的新微生物筛选和分类鉴定
为了得到易吸收、高活性的天然有效成分,从土壤、人参地、森林地,筛选一批新微生物,确认新筛选菌的产酶和天然成分的转化功能,其中有用的菌进行分类鉴定,确定其新微生物的属名和种名.
1.1 新微生物筛选
土壤中的大部分微生物处于休眠状态、或者目的微生物数量很低,因此本文采用两种方法筛选微生物:富集培养4~5代后分离单菌落;另一种方法是,将土壤样品稀释、涂铺在低营养的培养皿的固体培养基上、长时间培养(培养1~3个月)方法,得到单菌落.为了保险起见,所得到的单菌落在培养皿的固体培养基重新分离单菌落,测定其16S rRNA基因序列,与在 NCBI(http:∥www.ncbi.nlm.nih.gov/)的基因库(GenBank)上所登录的已知菌比较;共筛选了与已知菌的16S rRNA基因序列同源性90%以下的菌有25种,90% ~95%的有43种,95%~97%的50种,97% ~98%的50种的新筛选菌.
一般地来说,16S rRNA基因序列同源性(相似度)为95%以下的菌,直接能确定为新属(new genus)微生物,同源性在95% ~97%的菌,直接能确定为新种(new species),同源性97% ~99%的菌,借助分子杂交判断是否新菌,碱基序列与已知菌基本不配对的为新菌.
因此,筛选了16S rRNA基因与已知菌相差较大的百余种菌,为筛选天然成分转化酶,提供新微生物资源.
1.2 新筛选菌生物转化产酶功能的确认
上述新筛选微生物,随培养基不同、诱导物不同,所产的天然成分转化酶的种类也不同.上述新筛选的菌种中,选择16S rRNA基因同源性在Gen-Bank库中所登录的已知菌相差较大的,如下20种菌株,研究了产中草药组分水解酶的功能.
如20种菌株分别在1%的Trypton/L,0.5%的酵母膏,1%的NaCl和0.02%人参提取物的培养基中培养,与人参皂苷Rb1反应.其结果如TLC图1.
巷道矿压显现特征为空间尺度上顶板离层变化大、变化快且各层位离层均较大,表面煤岩快速碎胀并向深部扩展。时间尺度为在开挖的过程及开挖后段时间内变形最快,变形剧烈阶段为开挖开始至距离掘进工作面30~50 m;后期出现持续的蠕变和不连续变形,表现为整体位移持续增大、顶板离层继续增加、表面碎胀逐渐发展等。

图1 20种菌株发酵液对人参皂苷Rb1的水解Fig.1 Twenty kinds of strains on hydrolysis of ginsenoside Rb1
从图 1 中可以看到:1,3,9,10,14,18 号菌,明显水解人参皂苷 Rb1;而且15,16,17,20号菌也水解人参皂苷Rb1,说明这些菌,都产人参皂苷酶.
相同的方法,改变菌和培养基、产酶诱导物的方法,可以确认其他新菌的天然成分转化功能的产酶菌.其中选择有特色、有用的菌,进行分类鉴定,确定新菌.
1.3 有用菌的分类鉴定
上述新筛选菌中,选择高产中草药成分酶的有用菌,按照国际上规定的新菌分类鉴定方法,确定其微生物属和种;发表在国际微生物协会新菌刊物Int.J.Syst.Evol.Microb(IJSEM)等国际微生物学刊物上,填补国际微生物学的新微生物.
例如,作者课题组与韩国KAIST的林完泽博士,共同研究了从人参土壤中分离筛选的新细菌Gsoil 085T进行分类鉴定.该菌的种系分析中提取DNA,其16S rRNA基因用PCR方法扩充、分离提纯其16S rRNA基因,其16S rRNA基因序列用SeqMan software(DNASTAR)测定的;结果是1463个碱基对组成;与基因库(GenBank):利用 BLAST在 NCBI(http:∥www.ncbi.nlm.nih.gov)上登录的菌上登录的已知菌比较,该菌属于细菌门(phylum Bacteroidetes)的 ‘Flexibacteraceae'科;相近的Emticicia oligotrophicaGPTSA100-15菌比较,16S rRNA的同源性只有94.6%;与‘Flexibacteraceae'科的其他菌相比较,16S rRNA的同源性为83.0%以下;DNA分子杂交结果,在16S rRNA基因水平上3.0%的基因序列不相同;在全基因水平上涉及70%序列不相同.该菌16S rRNA基因序列,在基因库中查找新菌种所对应的系统生物学位置,制作“邻近菌的种系发生树“Neighbour-joining phylogenetic tree”,在上述基础上研究了该菌的分类学形态和生化特性.
该菌DNA的G+C含量为40.5%,革兰氏阴性(Gram negative),绝对好氧(strictly aerobic),不运动,不利用很多糖;细胞脂肪酸组成不同于相近的Emticicia oligotrophicaGPTSA100-15菌是新的Emticicia属中一个新种,命名为Emticicia ginsengisolisp.nov..新发现的菌确定其属名和种名,刊登在国际微生物协会新菌刊物Int J Syst Evol Microb等国际微生物学刊物上,增添国际微生物学的新菌.
本课题组分类鉴定的新菌为:Emticicia ginsengisolisp.nov.菌(Int J Syst Evol Microb,2008,58,1100-1105);Kaistia granulisp.Nov.菌(Int J Syst Evol Microb, 2007, 57:2280-2283);Hymenobacter daecheongensissp.nov. 菌(Int J Syst Evol Microb,2009, 59,331 -335);Spirosoma panaciterraesp.nov.菌(Int J Syst Evol Microb,2009,59,1183-1187);Terrabacter ginsenosidimutanssp.nov.菌(Appl Enviro Microb, 2010, 76,5827-5836);Phycicoccus ginsenosidimutanssp.nov.菌(Int J Syst Evol Microb, 2011, 61,524-528);Mucilaginibacter compostisp.nov. 菌(J Microb,2011,49,393398);Ramlibacter ginsenosidimutanssp.nov.菌(J Microbiol Biotechnol, 2012, 22:311-315)等;不仅增添国际微生物新菌,为筛选天然成分转化酶,提供一批新微生物资源.
2 特异的天然成分转化酶及其特性

图2 人参皂苷糖苷酶I型催化反应Fig.2 Catalytic reaction of ginsenoside glucosidase I type
上述新微生物和重要的已知菌发酵,用离子交换柱、凝胶柱、分子筛等的分离方法,分离纯化得到纯的酶蛋白,其纯酶与各种天然活性成分的单体分别反应,确定酶的催化反应,研究该酶的其他特性,然后与国际上已公布的酶相比较,确定是否为新酶.由此,发现了一批新的特异性天然活性成分转化酶.
2.1 特异的人参、薯蓣、白头翁等皂苷酶
用上述方法,发现了一批皂苷酶;其中4种人参皂苷酶 I、II、III、IV 型,其酶分别如下.
人参皂苷糖苷酶I型[4],能水解人参二醇类皂苷 Rb1、Rb2、Rb3、Rc的(第 3 碳)3-O-的 β-(1→6)-葡萄糖苷键;水解(第20碳)20-O-位置的 β-(1→6)-葡萄糖苷键、α-(1→6)-阿拉伯糖苷键、β-(1→6)-木糖苷键和 3-碳(3-O-)上的 β-(1→2)-葡萄糖苷键等多种糖基,生成F2;F2进一步水解成C-K以及皂苷元(PPD),其催化反应如图2.
人参皂苷糖苷酶II型[5],能水解人参二醇类皂苷 Rb1、Rb2、Rb3、Rc 的 20-O-位置的 β-(1→6)-葡萄糖苷键、α-(1→6)-阿拉伯糖苷键、β-(1→6)-木糖苷键等多种糖基,生成Rd和Rg3皂苷.
人参皂苷糖苷酶III型[6],能水解人参二醇类皂苷的3-O-位置的糖基.来源于霉菌的酶水解Rd的3-O-糖苷,生成C-K;基因重组酶III型(新发现菌T ginsenosidimutanssp.nov.的bgpA基因,克隆到E-.coli细胞中表达的得到的酶,736个氨基酸残基,分子量81 kDa),水解3-O-位置的糖基:水解Rb1皂苷3-O-位置的糖基、逐步生成 Gyp17→Gyp75;同样,Rb2变成C-O→C-Y;Rc变成C-McI→C-Mc;水解Rd的3-O-糖基、逐步变成F2→C-K皂苷,如图3.
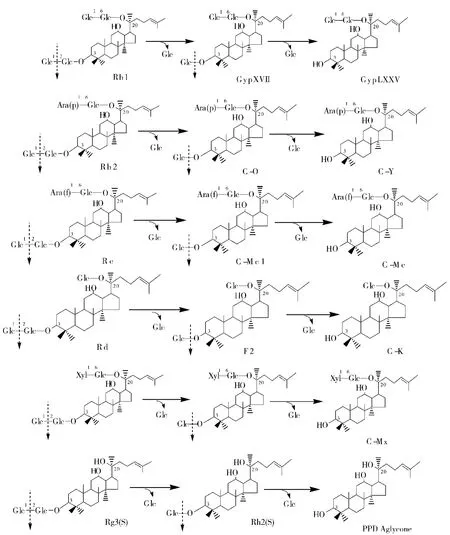
图3 人参皂苷糖苷酶III型催化反应Fig.3 Catalytic reaction of ginsenoside glucosidase III type
人参皂苷酶IV型[7-8],能水解人参三醇类皂苷Re、R1、Rf、Rg2 皂苷的 6-O-位置上的多种糖基,如图4.
归纳人参皂苷酶特性,人参皂苷I型酶水解人参皂苷第3碳、第20碳上的糖基;人参皂苷II型酶水解人参皂苷第20碳上的多种糖基;人参皂苷III型酶水解人参皂苷第3碳上的糖基;人参皂苷IV型酶水解人参皂苷第6碳上的多种糖基,是新酶.
用上述方法,也发现一些其他皂苷酶:薯蓣(穿山龙)甾醇皂苷酶[9],能水解薯蓣皂苷3-碳(3-O-)上的α-(1→2)-鼠李糖苷键、α-(1→4)-鼠李糖苷键和β-葡萄糖苷键,其催化反应如图5所示.
柴胡皂苷酶[10],能水解柴胡皂苷的3-O-上的多种糖基;白头翁皂苷酶,能水解白头翁皂苷的3-O-和28-O-上多种糖基;还有黄芪、朱砂根和大豆皂苷酶等.
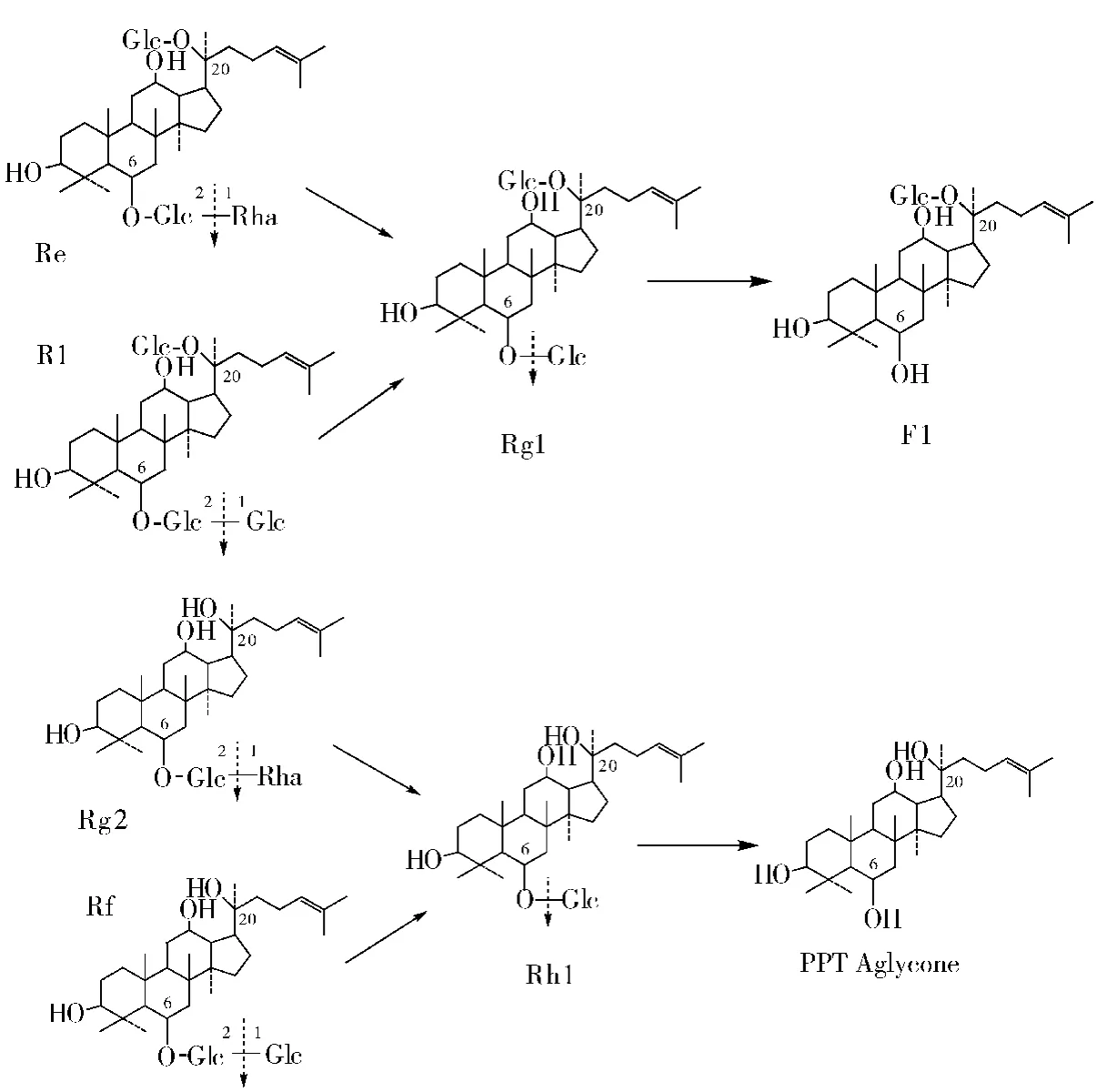
图4 人参皂苷糖苷酶IV型催化反应Fig.4 Catalytic reaction of ginsenoside glucosidase IV type
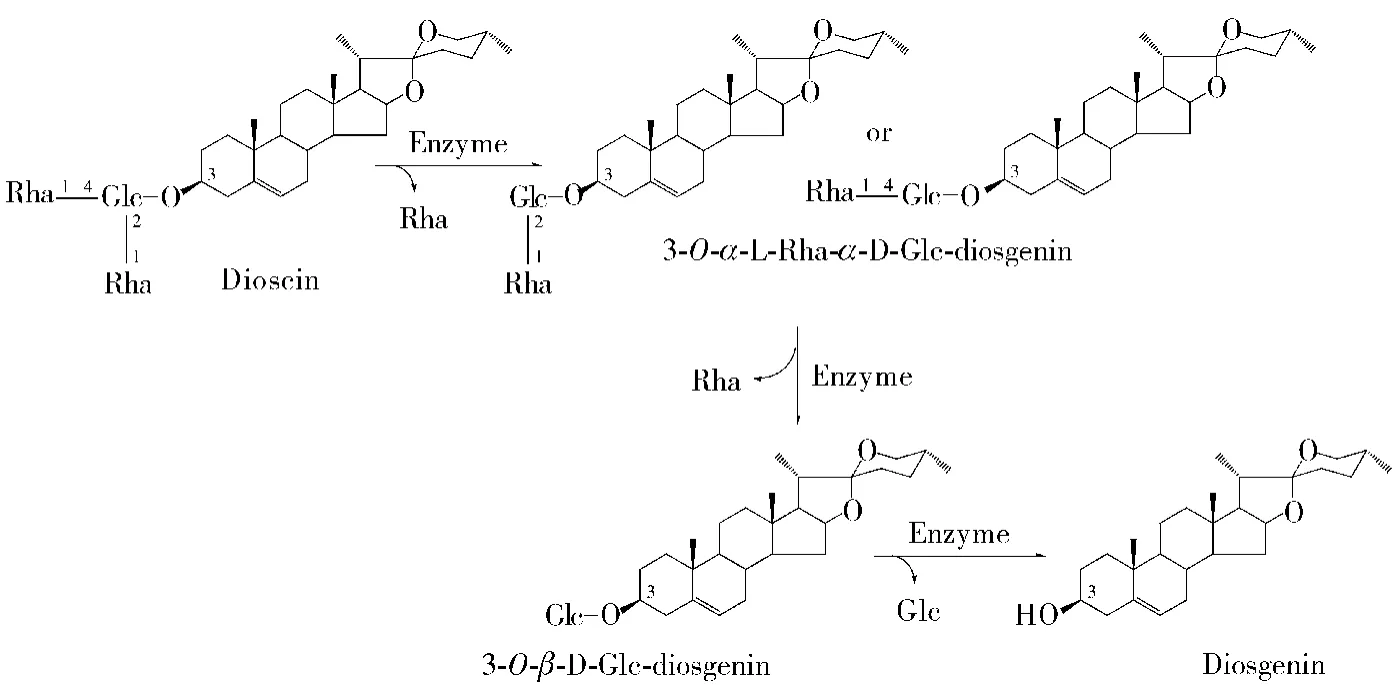
图5 薯蓣(穿山龙)甾醇皂苷酶催化反应Fig.5 Enzyme-catalyzed reactions of Yam(dioscorea)sterol saponins
上述皂苷酶的催化反应共性为,对苷元种类和糖基位置选择性高,对糖基种类(葡萄糖、阿拉伯糖、木糖、鼠李糖等种类)选择性低,能水解葡萄糖、阿拉伯糖、木糖、鼠李糖等多种糖基;这与国际酶学上的160余种糖苷酶“一种酶水解一种糖基(糖苷键)”(NC-IUBMB in http:∥www.qmul.ac.uk/iubmb/enzyme)的普遍规律所不同,是一类特异性的新苷酶,增添了国际酶学的一批新的皂苷酶[11].
2.2 其他天然活性成分转化酶
用上述方法发现一些其他天然成分转化酶:水解芦丁转化为异槲皮素和槲皮素的芦丁苷酶[12],黄芩苷转化为抗艾滋病毒的黄芩苷酶,大豆异黄酮的苷酶,红景天苷酶水解和合成酶[13],丹酚酸B转化为丹参素和低聚丹酚酸的丹酚酸酶,制备高活性淫羊藿苷的淫羊藿苷酶;其中大豆异黄酮的苷酶的催化反应如图6.

图6 大豆异黄酮苷酶催化反应Fig.6 Catalytic reaction of soy isoflavones glycosidase
以上筛选了一批新的特异的天然成分转化酶,为活性低、难吸收的天然成分转化为高活性的有效成分,提供了一批新酶.
3 特异的天然成分转化酶应用
为了上述新的天然成分转化酶的应用,育种了一些天然成分转化酶的生产菌;发现其酶在普通酶(淀粉、蛋白酶)发酵条件下不产,只有在发酵环境和营养恶劣条件下才产酶;建立了贫营养极端发酵法、生产天然成分转化酶类的方法.建立了从植物中提取天然成分转化酶方法.发现上述新酶抗有机溶剂;建立了酶生产中,用无毒有机溶剂沉淀酶方法,分离酶和产物;建立酶不用固定化、重复使用方法.在此基础上,利用天然成分转化酶生产了高活性天然活性成分;生产了高活性单体成分、高活性组分、高活性成分含量高的中草药和提取物;研究开发了高活性成分的公众营养食品、功能食品和化妆品.
1)酶转化法生产高活性单体成分:如酶转化法生产高活性单体皂苷C-K和F1的制备.人参皂苷C-K(Compound-K)在天然的人参中并不存在,是原人参二醇类皂苷(Rb1、Rb2、Rc、Rd 等)在人肠道内代谢的末端产物,是人体吸收的结构,具有抗突变、抗过敏、抗搔痒、抗败血病、抗糖尿病、抗癌、增强机体免疫力等作用,对保健食品、化妆品、人参药物意义很大,但是尚无产业化大量生产.同样,F1皂苷在天然的人参中并不存在,是原人参三醇类皂苷(Re、R1、Rg1等)在人肠道内代谢的产物,人体易吸收、具有保肝、益智等药理和保健功能,其结构如图7.
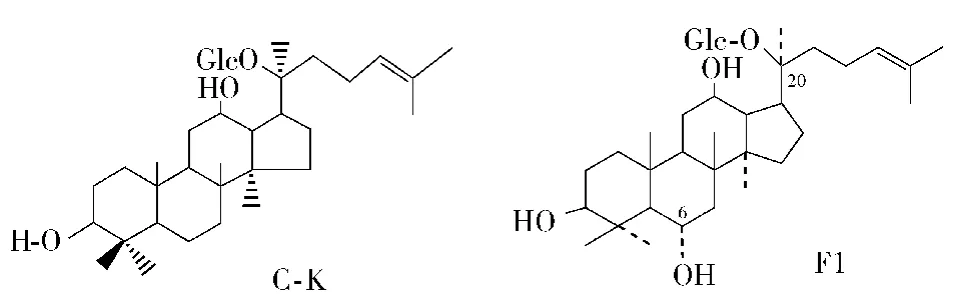
图7 人参皂苷C-K和F1的结构Fig.7 Structure of ginsenoside C-K and F1
利用新发现的人参皂苷酶I型[4]和IV型[5],分别转化生产高活性C-K和F1皂苷;其转化率为70% ~90%;酶不用固定化,反应后,重复使用,酶的回收率为70%~80%.
2)生物转化法制备4种异构体的Rg2组、Rg3组、Rh1组等红参稀有皂苷群:如,Rg2组等由20(S)-Rg2、20(R)-Rg2、Rg6 和 Rg4(F4)等 4 种异构体皂苷组成,Rg2组皂苷的结构与组成,如图8.

图8 Rg2组产品皂苷结构与组成的HPLCFig.8 Rg2 group saponins structure and HPLC of composition
红参稀有皂苷Rg2组,Rg3组,Rh1组等,由于四种异构体皂苷协同作用而比单体皂苷活性高,水中的溶解度高,更适合于开发人参制品、公众营养食品、化妆品和人参药物.如红参稀有皂苷Rg3组,20(S)-Rg3、20(R)-Rg3、Rk1和Rg5等4种异构体协同作用,比Rg3皂苷单体,抗癌、抗血栓、调节胰岛素活性提高较大.
本课题组与企业联合,利用生物转化法分别生产,4种异构体含量90%以上的Rg3组,Rg2组,Rh1组等;开发其应用,用于公众营养食品、人参制品、化妆品等添加剂.生物酶转化法,也生产了高活性白头翁皂苷组、高活性大豆异黄酮等,正开发其制品.
3)利用中草药植物本身含有的自身酶作用,在中药加工过程中发挥自身酶的作用,制备高活性有效成分含量高的中药或者提取物——活性中药.也就是说,中药加工过程中,有目的地发挥自身酶作用,提高活性有效成分的含量,改变了传统的中药加工的炮制和煎制等、传统的盲目性的加工方法.
如人参植物中含有人参自身皂苷酶[14-15],在传统红参加工过程中激活人参自身皂苷酶,制备活性红参;其活性红参中的稀有皂苷 Rg3,Rg5,Rh2,Rh3,Rg2,Rg4,Rh1,Rh4 含量比传统红参提高十几倍,同时人参中部分人上火成分Re,Rg1含量,降低到西洋参水平.
同样,也制备了高活性成分含量高的黄芩、丹参等提取物,提取了高活性大豆异黄酮混合物.开发了其公众营养食品、功能化妆品.
总之,为了得到易吸收、高活性的天然有效成分,本文筛选了一批新微生物,发现了一批新型特异的天然成分转化酶,开发了一批高活性的有效天然成分、高活性异构体混合物和活性中药,也开发了一些制品,也正在拓宽研发范围.
[1] 金凤燮.天然产物生物转化[M].北京:化学工业出版社,2009:-33.
[2] Kobashi K.Glycosides are natural products-evidence using germ-free and gnotobioticrats associated with a human intestinal bacterium[J].J Trad Med, 1998,15:1-13.
[3] Tawab M A,Bahr U,Karas M,et al.Degradation of ginsenoside in humans after oral administration[J].Drug Metab Dispos, 2003, 31:1065-1071
[4] Yu H,Zhang C,Liu M,et al.Purification and characterization of ginsenosidase hydrolyzing malti-glycosides of protopanaxadiol ginsenoside,Ginsenoside Type I[J].Chem Pharm Bull, 2007, 55:231 -235.
[5] Yu H,Liu Q,Zhang C,et al.A new ginsenosidase from Aspergillus strain hydrolyzing 20-O-multi-glycoside of PPD ginsenoside[J].Process Biochem,2009,44:772-775.
[6] Jin X,Yu H,Wang M,et al.Kinetics of a cloned spe-cial ginsenosidase hydrolyzing 3-O-glucoside of multi-protopanaxadiol-type ginsenosides,named ginsenosidase type III[J].J Microbiol Biotechnol, 2012, 22:343 -351.
[7] Wang D,Yu H,Song J,et al.A novel ginsenosidase from anAspergillusstrain hydrolyzing 6-O-multi-glycosides of protopanaxatriol-type ginsenosides,named ginsenosidase type IV[J].J Microbiol Biotechnol, 2011,21:1057-1063.
[8] Wang D,Yu H,Song J,et al.Enzyme kinetics of ginsenosidase type IV hydrolyzing 6-O-multi-glycosides of protopanaxatriol type ginsenosides[J].Process Biochem,2012,47:133 -138.
[9] Fu Y,Yu H,Tang S,et al.New dioscin-glycosidase hydrolyzing multi-glycosides of dioscin from absidia strain[J].J Microbiol Biotechnol, 2010, 20(6):1011-1017.
[10] Fu Yaoyao, An Jiayan, Yu Hongshan, et al.Purification and Characterization of new special saikosaponinglycosidase[J].Chemical Journal of Chinese University,2010, 31(6):1152-1157.
[11] Jin Fengxie, Yu Hongshan, Fu Yaoyao, et al.Biotransformation of ginsenosides(ginseng saponins)[J].International Journal of Biomedical and Pharmaceutical Science,2012(增刊):33-44.
[12] Liu T,Yu H,Zhang C,et al.Aspergillus nigerDLFCC-90 rhamniside hydrolase,a new type of flavonoid glycoside hydrolase[J].Appl Enviro Microb, 2012, 78(13):4752-4754.
[13] Zhang C,Yu H,Lu M,et al.Enzyme synthesis of salidoside:purification and characterization of saldosidase fromAspergilllas niger[J].Process Biochem, 2005,40:3143 -3147.
[14] Zhang C,Yu H,Bao Y,et al.Purification and characterization of ginsenoside-β-glucosidase from ginseng[J].Chem Pharm Bull, 2001,49:795 798.
[15] Zhang C,Yu H,Bao Y,et al.Purification and characterization of gisenoside-α-arabiofuranase hygrolyzing ginseoside Rc into Rd from the fresh rood ofPanax ginseng[J].Process Biochem,2002,37:793-798.
