仿刺参体腔液中酚氧化酶活性的分析
2013-07-02王轶南穆晓虎封妮莎宋坚常亚青
王轶南,穆晓虎,封妮莎,宋坚,常亚青
(大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
仿刺参体腔液中酚氧化酶活性的分析
王轶南,穆晓虎,封妮莎,宋坚,常亚青
(大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
在 (22±1)℃下抽取体质量为95.0~105.0 g的仿刺参Apostichopus japonicas体腔液,制备体腔液及体腔细胞溶解上清液 (CLS),分别测定其酚氧化酶 (PO)活性,检测分析不同刺激物 (CaCl2、MgCl2、LPS、SDS、Trypsin和甲醇)对酚氧化酶原 (proPO)系统的激活效果,并比较了不同规格仿刺参体腔液的酚氧化酶活性。结果表明:仿刺参体腔液中的PO活性个体差异较大,平均为 (146.90±55.60)U,体腔液与不同激活剂作用后PO活性均无明显变化;CLS中的PO活性为31.82 U,其在100 mmol/L MgCl2作用后PO活性大幅度提高,proPO比活为43.9 U,CLS与LPS、CaCl2和甲醇作用后PO活性无明显增加,与SDS和Trypsin作用后PO活性表现出一定的抑制。研究表明,仿刺参体腔液中的PO主要存在于体腔液中, CLS中的PO活性较低,proPO主要存在于体腔细胞中,可被Mg2+大幅度激活。52.4~68.5、20.7~24.4、4.9~5.6 g 3种规格的仿刺参体腔液中的PO活性分别为(42.18±7.62)、(34.10±9.28)、(33.29±7.42)U,表明不同规格仿刺参体腔液中的PO活性存在一定差异,总体呈现随规格的增大PO活性增强的趋势,其中100 g左右的仿刺参与3个较小规格的仿刺参体腔液中的PO活性存在显著性差异 (P<0.05)。
仿刺参;体腔液;酚氧化酶;酚氧化酶原
仿刺参Apostichopus japonicas产于辽宁、山东、河北等北方沿海地区,具有较高的营养价值和药用价值[1]。近年来,刺参养殖业的快速发展使养殖环境不断恶化,导致其病害频发,因此,对刺参免疫机制的研究具有重要意义。刺参的体腔液中存在多种免疫因子,已有学者对刺参机体酵母菌组成、溶血素、凝集素、溶菌酶等方面进行了研究[2-4],而有关刺参酚氧化酶的研究却很少。
无脊椎动物由于缺乏真正的抗体,只能依靠先天免疫来抵御外来病原及细菌的影响,其中酚氧化酶(PO)和酚氧化酶原(prophenoloxidase,proPO)激活系统在识别和防御中发挥重要作用[5-7]。PO一般以无活性的酚氧化酶原形式存在[8],酚氧化酶原激活系统激活后产生的黑色素及其中间产物可通过增强吞噬作用、包囊作用、介导凝集反应和产生杀菌物质等方式参与宿主防御反应。目前,关于酚氧化酶的研究多集中在节肢动物和软体动物中[9],对棘皮动物研究较少。研究发现,管海参Holothuria tubulosa、波罗的海海星Asterias rubens和冠海胆Diadema antillarum等棘皮动物具有酚氧化酶[10]。笔者已对虾夷马粪海胆Strongylocentrotus intermedius体腔液的酚氧化酶活性及其酶原激活等进行了研究[11],在此基础上,对仿刺参体腔液的PO进行研究,以期为提高仿刺参的免疫功能提供相关数据。
1 材料与方法
1.1 材料
4种规格(95.0~105.0、52.4~68.5、20.7~24.4、4.9~5.6 g)的健康仿刺参,购于大连鹤圣丰养殖场,取样前在实验室暂养一周。
L-多巴(3,4-dihydroxyl-phenylalanine,L-dopa)、脂多糖(lipopolysaccharide,LPS)、胰蛋白酶(Trypsin)购自BBI公司;十二烷基硫酸钠(SDS)购自上海生工生物工程技术服务有限公司;蛋白质浓度测定试剂盒购自南京建成生物工程有限公司。
1.2 方法
1.2.1 体腔液和体腔细胞溶解上清液的制备 取体质量为95.0~105.0 g的仿刺参10头,于(22± 1)℃下用一次性注射器抽取其体腔液,以3 000 r/min离心15 min,上清即仿刺参体腔液;将体腔液细胞沉淀混合,用超声波破碎,以10 000 r/min离心10 min,上清即仿刺参体腔细胞溶解上清液(CLS)。
1.2.2 PO活性分析 采用分光光度法测定PO活性[11]。在96孔酶标板中加入100 μL体腔液上清或CLS,再加入50 μL L-dopa(3 mg/mL),每隔5 min用酶标仪(Biotek,Epoch)测定波长为492 nm处的OD值,试验设3个平行。采用考马斯亮蓝法测定体腔液上清和CLS中的蛋白浓度。按PO酶活定义1 U=OD492nm/(min·mg蛋白)计算酶活性。
1.2.3 proPO激活及活性测定 取100 μL体腔液或CLS,加入50 μL激活剂,于37℃下水浴15 min,再加入50 μL L-dopa后,按上述方法测定PO活性。激活剂包括CaCl2(100 mmol/L)、MgCl2(100 mmol/L)、LPS(1 mg/mL)、SDS(1 mg/mL)、Trypsin(1 mg/mL)和甲醇(体积分数为50%),每种激活剂设3个平行。对照组加入50 μL灭菌纯水。
1.2.4 不同规格仿刺参体腔液中的PO活性 随机选取体质量规格分别为 52.4~68.5、20.7~24.4、4.9~5.6 g的仿刺参各3头,按上述方法抽取体腔液并离心,收集体腔液,用酶标仪测定其PO活性。
1.3 数据处理
试验数据用SPSS 13.0软件进行分析,利用单因素方差分析法 (ANOVA)进行差异显著性分析,用Duncan法进行多重比较,数据均以平均值±标准差表示,显著性水平设为0.05。
2 结果
2.1 PO活性
仿刺参体腔液与L-dopa反应后OD492nm值持续上升,以OD492nm在90 min中平均增加速率计算PO活性,仿刺参体腔液中的 PO活性为 (146.90± 55.60)U;CLS中的PO活性为31.82 U。本研究结果表明,仿刺参体腔液中的PO主要存在于体腔液中,且个体差异较大。
2.2 激活剂对proPO的作用
体腔液与激活剂作用后,PO活性无明显变化,且未检测到proPO存在。相比未激活的对照组,在100 mmol/L MgCl2作用下,CLS中的PO活性升高, CLS中的 proPO比活为 43.9 U;CLS与 LPS、CaCl2、甲醇作用后PO活性的变化较小,而与SDS及Trypsin作用后PO活性略有降低 (图1)。本研究结果表明,仿刺参体腔液中的体腔细胞含有少量proPO,且可被Mg2+激活。

图1 不同激活剂对仿刺参CLS中PO活性的影响Fig.1 Effects of different activators on phenoloxidase activity in coelomocyte lysate of sea cucumber Apostichopus japonicus
2.3 不同规格仿刺参PO活性的比较
不同规格仿刺参体腔液中的PO活性存在一定差异,体质量规格为52.4~68.5、20.7~24.4、4.9~5.6 g的仿刺参 PO活性分别为(42.18± 7.62)、(34.10±9.28)、(33.29±7.42)U,与体质量为95.0~105.0 g的仿刺参体腔液中的PO活性(146.90 U±55.60 U)相比,不同规格仿刺参体腔液中的PO活性存在一定差异,总体呈现随规格的增大PO活性增强的趋势 (图2)。多重比较结果表明,100 g左右的仿刺参与3个较小规格的仿刺参体腔液中的PO活性存在显著性差异(P<0.05), 3个较小规格之间均无显著性差异(P>0.05)。
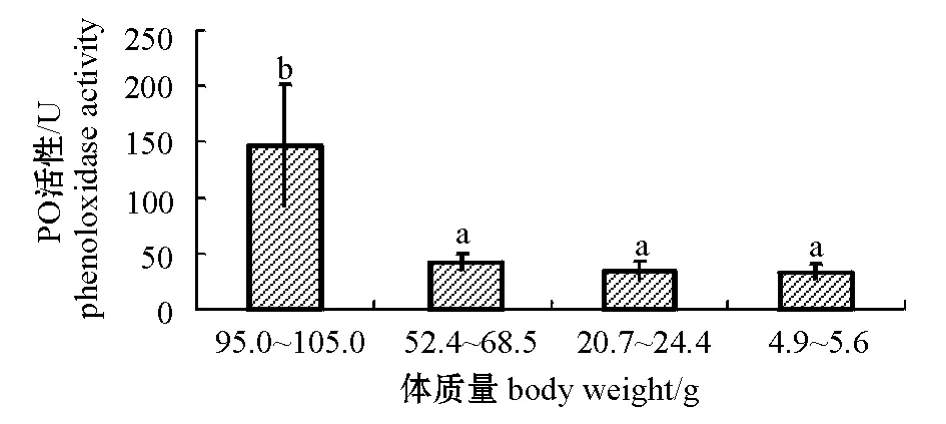
图2 不同规格仿刺参体腔液中PO活性的比较Fig.2 Phenoloxidase activity in sea cucumber individuals with different body weight
3 讨论
3.1 仿刺参体腔液中proPO及PO的定位
用蛋白酶或去污剂激活从贻贝血淋巴中分离血浆和血细胞后发现,血浆中的proPO远低于血细胞中的含量,证明proPO同时存在于贻贝的血浆和血细胞中,而且血细胞是其主要储存场所[12-13]。除了血淋巴外,在受病毒感染的中国对虾不同组织中可检测到不同水平的PO活性[14]。本研究结果显示,仿刺参体腔液中的proPO存在于体腔细胞中,不仅与上述研究结果一致,而且与对虾夷马粪海胆PO定位的研究结果相吻合[11]。关于仿刺参其他组织细胞中是否存在proPO,还有待进一步研究。
中华绒螯蟹血淋巴的血清和血细胞裂解上清液中都存在PO活性,血浆中无PO,血清中的PO来自于血细胞[15]。太平洋牡蛎、扇贝、小狮爪海扇蛤以及江珧4种软体动物成体的血浆和血细胞中均存在PO活性[16]。对虾夷马粪海胆的研究发现,血浆是PO存在的主要场所,CLS中的PO活性很小。本研究结果表明,仿刺参体腔液中的PO既存在于体腔液中也存在于CLS中,与之前研究结果一致。
3.2 仿刺参体腔液中proPO的激活
PO多以酶原形式存在于无脊椎动物的血淋巴中,可被内源性激活系统或外源性激活剂激活[8]。不同激活剂对proPO的激活机理不同,激活方式一般有两种:酶原的蛋白裂解和去污剂 (或变性剂)激活。加热和二价阳离子也对proPO的激活起促进作用[7]。此外,有研究表明,氨氮胁迫对三疣梭子蟹 proPO也会产生影响[17]。不同种类动物的proPO所适应的激活剂也不同,Trypsin对南美白对虾、克氏原螯虾和海胆的proPO有激活作用,而对斑节对虾和凡纳滨对虾的 proPO激活效果不明显[18-20]。在棘皮动物中,Trypsin可以激活管海参体腔液中的proPO,Trypsin和MgCl2可以激活虾夷马粪海胆的proPO。本研究中发现,只有MgCl2对仿刺参体腔液中的proPO具有激活作用,Trypsin则表现出一定的抑制作用,与海胆略有差异。
3.3 仿刺参PO活性及其与个体规格的关系
体质量为18~26 g的虾夷马粪海胆体腔液中的PO活性为 (48.28±6.69)U[11]。本研究中测得体质量为100 g左右的仿刺参体腔液中的PO活性为 (146.90±55.60)U,较小规格的仿刺参体腔液中的PO活性也可达 (33.29±7.42)U。在以往关于棘皮动物体腔液PO活性的研究中,因体腔液与L-dopa作用后OD值变化不明显,其PO活性往往被忽略。这主要是棘皮动物体腔液中的蛋白浓度较低造成的。因涉及物种、规格或成熟度等因素,不同动物之间的PO活性无法做深入比较,但仅就测得的数值而言,棘皮动物的PO活性并不低。南美白对虾血细胞溶解上清液中的PO活性为 (6.19± 3.25)U[21],棉铃虫血细胞中的PO活性相对血浆较高,但也仅为 (0.77±0.10)U[22]。
不同规格仿刺参体腔液中的PO活性不同,总体呈现随体质量的增加活性增强的趋势。有关年龄增长与机体免疫力关系的研究发现,年龄与免疫系统的功能相关联。随着年龄的增长,特异性免疫减弱,而先天性免疫则表现出明显的增强,在无脊椎动物中,细胞免疫、体液免疫以及相关基因的表达都发生相应的变化[23]。与本研究相似,较大规格的切叶蚁Acromyrmex octospinosus的PO活性较小规格的显著升高[24]。此外,雄性红兰虾 Aristeus antenmztus和中国明对虾Fenneropenaeus chinensis的超氧化物歧化酶 (SOD)活性随体长的增加而增大[25];大规格克氏原螯虾 (120 g±20 g)的血蓝蛋白含量以及溶菌酶和SOD活性均大于小规格(27 g±2 g) 的[26];大龄的线虫Caenorhabditis elegans则对病原表现出更强的抵抗力[23]。有些鱼类的免疫功能指标也和体长相关,大西洋鳕和大鳞大麻哈鱼Oncorhynehus tshawytsch免疫参数的大多数指标随体长的增加而增大[27]。
[1] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004.
[2] 李明,马悦欣,刘志明,等.刺参机体酵母菌组成及其拮抗活性的研究[J].大连海洋大学学报,2012,27(5):436-440.
[3] 马悦欣,许珂,王银华,等.K-卡拉胶寡糖对仿刺参溶菌酶、碱性磷酸酶和超氧化物歧化酶活性的影响[J].大连水产学院学报,2010,25(3):224-227.
[4] 李丹彤,宋亮,钟莉,等.刺参凝集素的分离纯化及其性质[J].水产学报,2005,29(5):654-659.
[5] Ana P M,Claudia M,Alicia M S,et al.Patagonicosidea novel antifungal disulfated triterpene glycoside from the sea cucumber Psolus patagonicus[J].J Tetra Hedron,2001,57:9563-9568.
[6] Haug T,Kjuul A K,Styrvold O B,et al.Antibacterial activity in Strongylocentrotus droebachiensis(Echinoidea),Cucumaria frondosa(Holothuroidea)and Asterias rubens(Asteroidea)[J].Invertebr Pathol,2002,81:94-102.
[7] 庞秋香,庞书香,赵博生.酚氧化酶及其酶原的生化特性与分子生物学研究进展[J].现代生物医学进展,2008,8(1):196-200.
[8] 李国荣,张士璀,李红岩,等.酚氧化酶研究概况Ⅰ——特性、功能、分布和在胚胎发育中的变化[J].海洋科学,2003,27 (4):4-8.
[9] 吴曙,王淑红,王艺磊,等.软体动物和甲壳动物酚氧化酶的研究进展[J].动物学杂志,2009,44(5):137-146.
[10] Smith V J,Soderhall K.A comparison of phenoloxidase activity in the blood of marine invertebrates[J].Dev Comp Immunol,1991 (4):251-61.
[11] 王轶南,刘学伟,刘艳萍,等.虾夷马粪海胆Strongylocentrotus intermedius体腔液的酚氧化酶活性分析[J].中国农业科技导报,2011,13(2):116-120.
[12] Coles J A,Pipe R K.Phenoloxidase activity in the haemolymph and haemocytes of the marine mussel Mytilus edulis[J].Fish& Shellfish Immunol,1994,4:337-352.
[13] Asokan R,Arumugam M,Mullainadhan P.Activation of prophenoloxidase in the plasma and haemocytes of the marine mussel Pernaviridis linnaeus[J].Dev Comp Immunol,1997,21(1):1-12.
[14] 刘晓云,张志峰,于利,等.中国对虾组织细胞中酚氧化酶活力的研究[J].高技术通讯,2002(8):89-92.
[15] 陆宏达,刘凯,张明辉.中华绒螯蟹血淋巴中酚氧化酶的部分生化特性[J].上海水产大学学报,2007,16(3):464-471.
[16] Luna G A,Maeda M A,Vargas A F.Phenoloxidase activity in larval and juvenile homogenates and adult plasma and haemocytes of bivalve molluscs[M].Fish&Shellfish Immunol,2003,15(4): 275-282.
[17] 岳峰,潘鲁青,谢鹏,等.氨氮胁迫对三疣梭子蟹酚氧化酶原系统和免疫指标的影响[J].中国水产科学,2010,17(4):761-770.
[18] Aspan A,Huang T S,Cerenius L,et al.cDNA cloning of prophenoloxidase from the freshwater crayfish Pacifastacus leniusculus and its activation[J].Proc Natl Acad Sci,1995,92:939-943.
[19] Sung H H,Chang H J,Her C H,et al.Phenoloxidase activity of hemocytes derived from Penaeus monodon and Macrobrachium rosenbergii[J].Journal of Invertebrate Pathology,1998,71:26-33.
[20] 严芳,章跃陵,罗活强,等.凡纳滨对虾血蓝蛋白酚氧化酶活性的研究[J].水产科学,2008,27(1):5-8.
[21] 刘凯.南美白对虾血细胞中酚氧化酶原系统的激活[J].动物医学进展,2009,30(1):27-32.
[22] 尹丽红,王琛柱,钦俊德.棉铃虫血淋巴酚氧化酶活性的微量测定[J].昆虫知识,2001,38(2):119-122.
[23] DeVeale B,Brummel T,Seroude L.Immunity and aging:the enemy within?[J].Aging Cell,2004,3(4):195-208.
[24] Armitage S A,Boomsma J J.The effects of age and social interactions on innate immunity in a leaf-cutting ant[J].Journal of Insect Physiol,2010,56(7):780-787.
[25] Mourente G,Diaz-salvago E.Characterization of antioxidant systems,oxidation status and lipids in brain of wild-caught size-class distributed Aristeus antennatus(Risso,1816)crustacea,Decapoda [J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1999,124(4):405-416.
[26] 于宁,华雪铭,赵朝阳,等.野生克氏原螯虾的肌肉生化成分、组织消化酶和免疫酶活性分析[J].海洋渔业,2011,33(1): 46-52.
[27] Harrahy L N,Schreck C B,Maulr A G.Antibody-producing cells correlated to body weight in juvenile chinook salmon Oncorhynchus tshawytscha acclimated to optimal and elevated temperatures[J]. Fish&Shellfish Immunology,2001,11(8):652-659.
Analysis of phenoloxidase activity in the coelomic fluid of sea cucumber Apostichopus japonicus
WANG Yi-nan,MU Xiao-hu,FENG Ni-sha,SONG Jian,CHANG Ya-qing
(Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China)
In this study we extracted coelomic fluid of sea cucumber Apostichopus japonicus(95.0-105.0 g),collected plasma and haemocyte lysate(CLS)respectively,measured phenoloxidase(PO)activity and then analysed the induction of different activators to the proPO system.In addition,we compared PO activity of different sizes of sea cucumber.The results showed that PO activities of sea cucumber,varied among differentin dividuals(146.90± 55.60)U.There were no obvious change in PO activity after being inducedby different activities.The PO activity of CLS was 31.82 U,which could be increased by 100 mmol/L MgCl2induction.The activity of proPO was 43.9 U,PO activity had no obvious increase after treatments by LPS,SDS,CaCl2,Trypsin and methanol.SDS and Trypsin even showed inhibition effects.The findings suggested that PO of the coelomic fluid of sea cucumber was mainly distributed in plasma and proPO existed in coelomic cells which were greatly activated by Mg2+.PO activity of different sizes of sea cucumber(52.4-68.5,20.7-24.4 g and 4.9-5.6 g)were(42.18±7.62),(34.10± 9.28)U and(33.29±7.42)U respectively.It suggested that PO activity varied with different size of sea cucumber.Bigger individuals seemed showing higher PO activity.The PO activity of the maximal individuals(about 100 g)was significantly higher than that of the smaller ones(P<0.05).
Apostichopus japonicus;coelomic fluid;polyphend oxidase(PO);proPO
S968.9
:A
2095-1388(2013)04-0319-04
2012-11-30
国家 “863”计划项目 (2012AA100812);国家星火计划项目 (2012GA651002);国家海洋局海洋公益项目 (201105007);辽宁省教育厅科学技术研究项目 (L2012263)
王轶南 (1980-),女,助理研究员。E-mail:wangyinan@dlou.edu.cn
常亚青 (1967-),男,博士,教授。E-mail:yqchang@dlou.edu.cn
