扩张型心肌病大鼠心功能减弱与SIRT1表达下调有关
2013-07-02杜周乾毅李小晶张淑娟朱磊赵运海袁新初袁
刘 杜周乾毅李小晶张淑娟朱 磊赵运海袁新初袁 琼*
(1 武汉科技大学医学院药学系,湖北 武汉 430081;2 武汉科技大学医学院组织胚胎学教研室,湖北 武汉 430081;3 武汉科技大学天佑医院超声影像科,湖北 武汉 430000)
扩张型心肌病大鼠心功能减弱与SIRT1表达下调有关
刘 杜1周乾毅2李小晶3张淑娟1朱 磊1赵运海1袁新初2袁 琼1*
(1 武汉科技大学医学院药学系,湖北 武汉 430081;2 武汉科技大学医学院组织胚胎学教研室,湖北 武汉 430081;3 武汉科技大学天佑医院超声影像科,湖北 武汉 430000)
目的 探讨SIRT1在扩张型心肌病(DCM)大鼠心肌中的表达及其意义。方法 采用腹腔注射阿霉素8周建立大鼠DCM模型,彩色多普勒检测大鼠左心室结构和功能,采用免疫组织化学方法及Western blot技术检测心肌组织中SIRT1蛋白表达水平。结果 与正常组相比,DCM组大鼠左室舒张期末径和左室收缩期末径均明显增大,左室射血分数明显下降;DCM大鼠心肌组织中SIRT1蛋白表达水平明显下调。结论 SIRT1在DCM心肌中表达下调,提示其与DCM的发生与发展相关。
扩张型心肌病;SIRT1
扩张型心肌病(DCM)是以左心室扩张和收缩功能减退为特征的一种慢性充血性心衰疾病。其病理特征为心肌细胞坏死、纤维化、胶原增生。
沉默信息调节因子1(SIRT1)是尼克酰胺依赖性(NAD+)组蛋白去乙酰化酶,具有延缓衰老、调节能量代谢、抗氧化应激等多种生物功能[1-3]。研究证实,SIRT1具备心脏保护功能。在大鼠心衰模型中发现SIRT1参与抑制心脏衰老并增加其抵抗氧化应激能力[4,5]。在糖尿病大鼠模型中SIRT1的激动剂白藜芦醇上调胞浆钙通道相关ATP(SERCA2),改善糖尿病时心脏收缩能力,且SIRT1参与该作用[6]。研究人员在体外培养的心肌细胞实验中证实,SIRT1能通过与过氧化物酶增殖激动受体α(PPAR-α)作用,保护心肌细胞,抑制其肥大、代谢紊乱及验证反应[7]。因此,我们推测DCM的发生与发展与SIRT1表达降低有关。本研究通过腹腔注射阿霉素建立大鼠DCM模型,DCM的发生与发展与SIRT1之间的关系。
1 材料与方法
1.1 实验动物、主要药物、试剂:7周龄SD雄性大鼠18只,体质量(62.5±4.5)g,武汉大学实验动物中心提供。阿霉素购于美国Sigma公司,胞核胞浆抽提试剂盒购于北京博奥森生物公司,SIRT1、α-tubulin、辣根过氧化物酶(HRP)标记二抗均购于美国Santa Cruze公司,S-P试剂盒及DAB显色试剂盒购于北京中杉金桥生物有限公司,DMR+Q550病理图像分析仪购于德国莱卡公司。
1.2 DCM大鼠动物模型建立:将SD大鼠随机分为正常组(n=9)和DCM组(n=9),DCM组大鼠腹腔注射阿霉素2mg/(kg·周),正常组大鼠腹腔注射生理盐水,连续8周用药。
1.3 彩色多普勒超声检查:于第8周末对所有大鼠行彩色多普勒超声。记录大鼠左室舒张期末径(LVDD)、左室收缩期末径(LVDS)和左室射血分数(LVEF)。
1.4 免疫组化SP法检测SIRT1蛋白表达:造模结束后处死大鼠,剪取部分心肌组织,用4%多聚甲醛固定,常规石蜡包埋、切片,采用SP法严格按照说明书操作检测SIRT1蛋白表达,SIRT1一抗稀释度为1∶200,柠檬酸抗原热修复,DAB显色,PBS代替一抗做阴性对照。在图像分析仪上,每个切片随机取5个高倍视野,测定一定面积内阳性信号面积和阳性信号平均灰度值,计算阳性信号指数,5个视野阳性信号指数的平均值为最终阳性信号指数,阳性信号判定标准:SIRT1阳性染色主要集中在细胞核,呈现浅黄色至深棕色。
1.5 Western blot检测SIRT1蛋白表达:大鼠处死后取部分心肌组织,剪碎,按照胞浆胞核抽提试剂盒说明书抽提胞核胞浆蛋白。分别灌注8%SDS-PAGE分离胶和5%浓缩胶。样品上样后4℃电泳,先以90v电泳至样品Lane前沿达分离胶界面时改为120v,至溴酚蓝指示剂离SDSPAGE胶底部约1cm处结束电泳。电泳后将胶起出,用电转膜法将蛋白转移至PVDF膜上,以含5%BSA的TBST室温封闭1h,一抗(rabbit—anti SIRT1抗体,1∶2000稀释,mouse-anti α-tubulin抗体,1∶2000稀释)4℃孵育过夜,TBST洗膜后,二抗(HRP-anti rabbit IgG,1∶2000稀释;HRP-anti mouse IgG,1∶2000稀释)于室温孵育lh,再次洗膜后,按ECL显色试剂盒说明书操作显色。暗室里X线片曝光,灰度分析测定显色面积和灰度。
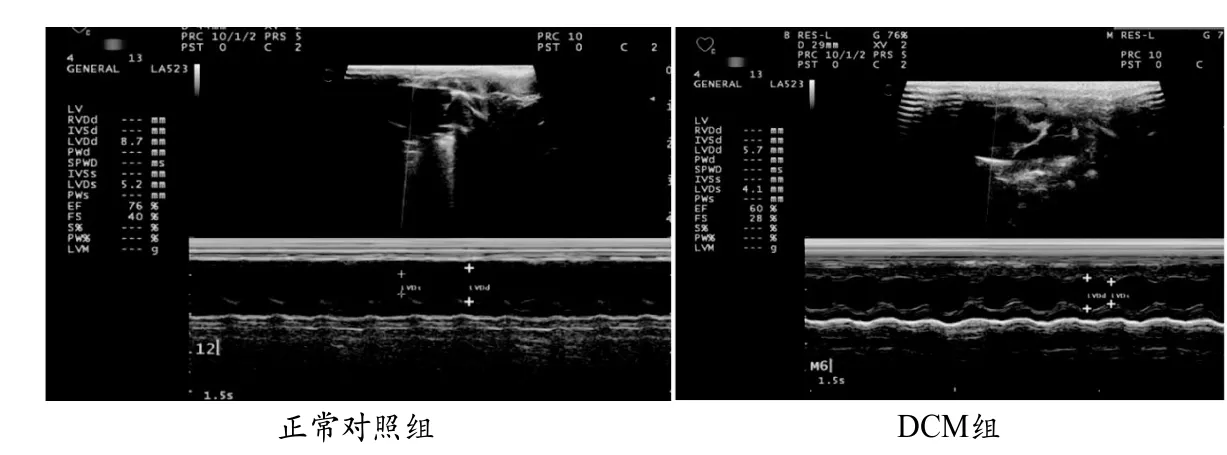
图1 彩色多普勒检测扩张型心肌病大鼠心功能代表性图片
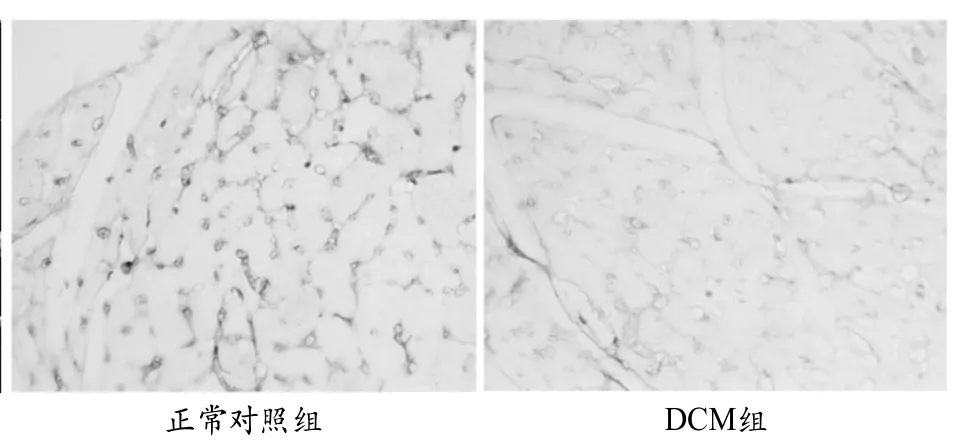
图2 免疫组化检测扩张型心肌病大鼠心脏SIRT1蛋白表达代表性图片(400x)
1.6 统计分析:所有数据均以均数±标准差表示。组间差异采用Student t检验,双侧P<0.05,认为有统计学意义。
2 结 果
2.1 大鼠心脏LVDD、LVDS和LVEF的改变
与正常组相比,DCM组大鼠的LVDD和LVDS明显增大(5.88mm ±0.45mm vs7.01mm±0.73mm,2.85mm±0.49mm vs 3.93mm± 0.34mm),LVEF明显降低(83.77%±4.05% vs 67.77%±4.76%)(P<0.01)。如图1。
2.2 免疫组化检测SIRT1蛋白表达
SP法免疫组化结果显示SIRT1阳性染色主要集中在心肌细胞核,呈浅黄色至深棕色。与正常组大鼠心肌组织相比,DCM组阳性细胞显著减少,如图2。
2.3 Western blot检测SIRT1蛋白表达
与正常对照组相比,DCM组大鼠心肌组织中SIRT1蛋白表达明显降低(1.61±0.39 vs 0.93±0.26),有统计学意义(P<0.01)。该结果与免疫组化结果一致。
3 讨 论
研究人员认为DCM主要由遗传因素和病毒感染引起。光镜下,DCM心肌纤维常明显变粗、变性、坏死及纤维化。电镜下,心肌细胞内肌原纤维含量减少,线粒体增大,增多,嵴断裂或消失,肌浆网扩张,糖原增多。氧化应激被认为是参与DCM心肌损伤的重要机制之一。临床研究发现DCM患者左心室中过氧化氢酶、谷胱甘肽过氧化物酶、Mn-过氧化物歧化酶等活性及基因表达均降低,从而清除氧化自由基能力降低[8]。抗氧化药物依达拉奉能通过抑制还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)亚基表达,抑制氧化应激及自身免疫诱导的心肌凋亡和纤维化,从而缓解DCM进展[9]。
SIRT1是一种新的长寿基因,靶基因包括肿瘤抑制蛋白p53、RNA聚合酶Ⅰ转录因子TAF168、DNA终末结合蛋白Ku70[10-12]。研究发现,SIRT1基因敲除的小鼠胚胎心脏发育停滞[13]。在抗肌萎缩蛋白敲除小鼠模型中,SIRT1激动剂白藜芦醇能改善心肌细胞的病理变化,而该作用由其激动SIRT1抑制p300蛋白表达介导[14]。过表达SIRT1能通过FoxO增加抗氧化蛋白过氧化氢酶表达,从而抑制百草枯引起心脏氧化应激反应[4]。本实验在DCM大鼠心肌组织中证明,SIRT1的表达显著低于正常对照组。我们推测,SIRT1的表达下调参与了DCM的发生与发展,然而其具体作用机制还有待进一步研究。
[1] Huang J,Gan Q.SIRT1 overexpression antagonizes cellular senescence with activated ERK/S6k1 signaling in human diploid fibroblasts[J].PLoS One,2008,3(3):e1710.
[2] Kao CL,Chen LK.Resveratrol protects human endothelium from H(2)O(2)-induced oxidative stress and senescence[J].J Atheroscler Thromb, 2010,17(9):970-979.
[3] Sun C,Zhang F.SIRT1 improves insulin sensitivity under insulinresistant conditions by repressing PTP1B[J].Cell metabolism, 2007,6:307-319.
[4] Alcendor RR,Gao S.Sirt1 regulates aging and resistance to oxidative stress in the heart[J].Circ Res,2007,100(10):1512-1521.
[5] Tanno M,Kuno A.Induction of manganese superoxide dismutase by nuclear translocation and activation of SIRT1 promotes cell survival in chronic heart failure[J].J Biol Chen,2010,285(11): 8375-8382.
[6] Sulaiman M,Matta MJ.Resveratrol,an activator of SIRT1, upregulates sarcoplasmic calcium ATPase and improves cardiac function[J].Am J Physiol Heart Circ Physiol,2010,298(3):H833-843.
[7] Planavila A,Iglesias R.Sirt1 acts in association with PPARalpha to protect the heart from hypertrophy metabolic dysregulation, and infiammation [J]. Cardiovasc Res,2011,90(2):276-284.
[8] Baumer AT,Flesch M.Antioxidative enzymes in human hearts with idiopathic dilated cardiomyopathy[J].J Mol Cell Cardiol, 2000,32:121-130.
[9] Arumugam S,Thandavarayan RA.Beneficial effects of edaravone [J].J Cell Mol Med,2012,16:2176-2185.
[10] Luo J,Li M.Acetylation of p53 augments its site-specific DNA binding both in vitro and in vivo[J]. Proc Natl Acad Sci U S A, 2004,101(8):2259-2264.
[11] Muth V,Nadaud S.Acetylation of TAF(I)68,activates RNA polymerase I transcription[J].EMBO J,2001,20:1353-1362.
[12] Jeong J,Juhn K.SIRT1 promotes DNA repair activity and deacetylation of Ku70[J].Exp Mol Med,2007,39(1):8-13.
[13] Sakamoto J,Miura T.Predominant expression of Sir2alpha,an NAD-dependent histone deacetylase[J].FEBS Lett,2004,556(1-3): 281-286.
[14] Kuno A,Hori YS.Resveratrol Improves Cardiomyopathy in Dystrophin-deficient Mice through SIRT1 Protein-mediated Modulation of p300 protein[J].J Biol Chem,2013,288(8):5963-5972.
Involvement of SIRT1 Expression in Heart Dysfunction from Dilated Cardiomyopathy Rat
LIU Du1, ZHOU Qian-yi2, LI Xiao-jing3, ZHANG Shu-juan1, ZHU Lei1, ZHAO Yun-hai1, YUAN Xin-chu2, YUAN Qiong1
(1 Department of Pharmacology, College of Pharmacy ,Wuhan University Science and Technology, Wuhan 430081, China; 2 Department of Histology and Embryology, Wuhan University Science and Technology, Wuhan 430081, China; 3 Department of Ultrasonic Imaging , Tianyou Hospital, Wuhan University Science and Technology, Wuhan 430000, China)
Objective To demenstrate the relationship of SIRT1 expression and heart dysfunction from dilated cardiomyopathy (DCM) rat.Methods The rat model of DCM was established by intraperitoneal injection of adriamycin once a week for 8 weeks. Left ventricular end diastolic diameter,1eft ventricular end systolic diameter and left ventricular ejection fraction were measured by Doppler. The expression of SIRT1 was detected with immunohistochemistry and Western Blotting,respectively.Results Compared with the normal rats,both the LVDD and LVDS were increased and the LVEF decreased.The expression of SIRT1 was down-regulated significantly in the rats with DCM.Conclusion The expression of SIRT1 downregulation in the cardiomyocytes may be associated with the progression and pathogenesis of DCM.
Dilated cardiomyopathy; SIRT1
R542.2
B
1671-8194(2013)25-0053-02
*通讯作者
