伴大量新月体形成的急性感染后肾小球肾炎
2013-07-01曾彩虹
徐 峰 曾彩虹
·肾活检·
伴大量新月体形成的急性感染后肾小球肾炎
徐 峰 曾彩虹
14岁男性患者,起病前3周出现上呼吸道感染,以急进性肾炎综合征(肉眼血尿、肾功能不全)入院,实验室检查发现补体C3降低、抗链球菌溶血素“O”升高,抗中性粒细胞胞质抗体和抗肾小球基膜抗体阴性;肾活检组织学改变为Ⅱ型新月体肾炎,电镜下上皮侧见“驼峰”样电子致密物。考虑急性链球菌感染后肾小球肾炎。
急性感染后肾小球肾炎 新月体肾炎 肾活检
病例摘要
病史 14岁男性患者,因“肉眼血尿8d,血清肌酐(SCr)进行性升高5d”于2013-09-29入院。
患者起病前3周受凉后出现咽痛、发热,体温38℃,服“安乃静,头孢类抗生素”后好转。2013-09-21腹泻后出现酱油色尿,无发热,未予重视。2013-09-23上午出现纳差、发热,测体温38℃,外院查体发现扁桃体Ⅱ度肿大,予“病毒唑、利巴韦林、头孢类抗生素”抗感染治疗,但体温、血尿均无明显好转,尿液呈浅咖啡色,尿常规示隐血+++、蛋白+++、白细胞++,尿糖阴性,血白细胞(WBC)10.1 ×109/L、中性粒细胞78.4%、淋巴细胞15.4%、血红蛋白(Hb)113 g/L、血小板(PLT)232×109/L,SCr从107μmol/L升至580μmol/L。2013-09-24起持续无尿,胸部CT未见明显异常,粪常规隐血阳性,尿培养阴性,予“青霉素、头孢噻肟”抗感染治疗。2013-09-25、2013-09-26行血液透析(HD)治疗2次,2013-09-27急诊查WBC 10.8×109/L,SCr 721 μmol/L,出血热抗体、抗肾小球基膜(GBM)抗体、抗中性粒细胞胞质抗体(ANCA)均阴性,予“泮托拉唑、维生素C、维生素B6、复合辅酶静脉滴注,低分子肝素抗凝”等,2013-09-28行连续性血液净化(CBP)治疗1次。病程中无四肢皮疹、关节痛,无咳嗽、咯血。目前精神、体力、睡眠正常,食欲欠佳,体重无明显变化,大便正常,无尿。
既往史 自诉3年前接触花粉后全身起皮疹。否认肝炎、结核、疟疾等传染病史,否认手术、外伤及输血史,预防接种史不详。
家族史 父亲体健,母亲有慢性乙型肝炎,否认家族遗传病史。
体格检查 体温36.8℃,血压120/68 mmHg,心率78次/min,体质量指数21.45 kg/m2。发育正常,营养中等,神志清楚。颜面部无水肿,全身浅表淋巴结无肿大。咽部充血,扁桃体Ⅱ度肿大,口腔黏膜无溃疡,牙龈无出血。未触及甲状腺肿大及结节。双肺呼吸音清晰,未闻及干湿啰音和胸膜摩擦音。心律齐,各瓣膜区未闻及心脏杂音。腹部平软,无压痛及反跳痛,未触及包块,肝脾肋下未触及。脊柱、四肢无畸形、压痛、叩击痛。右股静脉置管在位,无渗血、渗液,双下肢无水肿。
实验室检查
血常规 Hb 133 g/L,WBC 10.8×109/L,中性粒细胞比例73.3%,淋巴细胞比例9.3%,PLT 231 ×109/L。
尿液 尿沉渣红细胞计数120万/ml,WBC 12~18/HP(多核尿白细胞 98%,单核尿白细胞2%)。
血生化 白蛋白35.9 g/L,球蛋白31 g/L,尿素氮19.4 mmol/L,SCr 721μmol/L,尿酸329μmol/L,谷丙转氨酶8 U/L,谷草转氨酶14 U/L,三酰甘油1 mmol/L,胆固醇1.9 mmol/L,钠136 mmol/L,钾4.6 mmol/L,氯93 mmol/L,钙2.0 mmol/L,总二氧化碳22 mmol/L,空腹血糖5.3 mmol/L,C反应蛋白8.3 mg/L。
免疫学 抗链球菌溶血素“O”(ASO)1 060.0 IU/m l、IgA 4.930 g/L、IgE>1 000 IU/m l。补体C3 0.4 g/L,补体C4 0.2 g/L,抗核抗体、抗ds-DNA抗体、抗核抗体谱均阴性。出血热抗体、抗GBM抗体、抗肾小管基膜(TBM)抗体、ANCA均阴性。C3肾炎因子、补体H因子、抗补体H因子抗体、淋巴细胞膜辅蛋白(MCP)均正常。淋巴细胞亚群:CD3+706个/μl,CD4+405个/μl,CD8+277个/μl。
传染病四项 阴性。
双肾B超 左120 mm×44 mm×60 mm,右115 mm×51 mm×57 mm,皮质回声稍增强。
其他 心电图及胸部X线未见异常;胸部CT示两侧胸腔积液;副鼻窦 CT示右侧上颌窦囊肿。
肾活检
光镜 皮质肾组织4条,84个肾小球中15个细胞性、62个纤维细胞性、7个纤维性新月体,新月体挤压肾小球致袢塌陷、闭锁,多处见纤维素样坏死(图1A)。残留少量丝球体,系膜区轻度增宽,系膜细胞和基质增多,毛细血管袢开放欠佳,见中性粒细胞聚集(图1B),囊壁增厚分层伴囊周纤维化。PASM-Masson:肾小球毛细血管袢上皮侧见孤立性嗜复红物(图1C)。肾小管间质急性病变重度,片状肾小管上皮细胞刷状缘脱落,散在肾小管上皮细胞小空泡变性,较多蛋白管型和红细胞管型,间质大量单个核细胞、浆细胞浸润(图1D),亦见较多中性粒细胞和散在嗜酸性粒细胞,间质纤维化++。动脉未见明确病变。
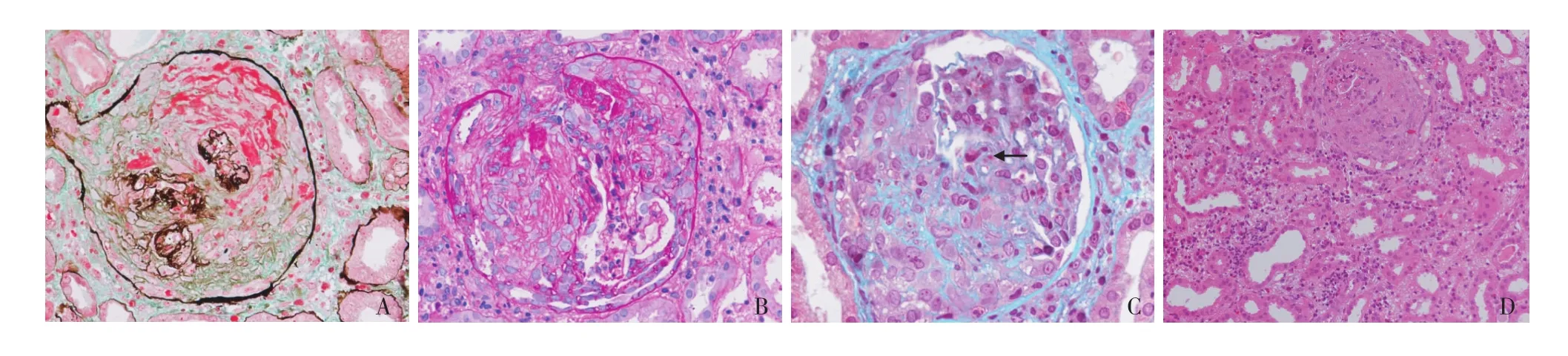
图1 A:新月体挤压肾小球致袢塌陷、闭锁,多处见纤维素样坏死(PASM-Masson,×400);B:少数开放的肾小球毛细血管袢腔内见中性粒细胞聚集(PAS,×400);C:肾小球上皮侧见“驼峰”样嗜复红物(↑)(M asson三色,×600);D:肾间质大量单个核细胞、浆细胞浸润,亦见较多中性粒细胞和散在嗜酸性粒细胞(HE,×200)
免疫荧光 9个肾小球,冰冻切片荧光染色C3++,呈颗粒状弥漫分布于肾小球系膜区及血管袢(图2A)。IgG、IgA、IgM、C1q阴性。多个肾小球新月体Fibrin阳性(图2B)。
电镜 观察2个肾小球,其中1个肾小球见新月体,新月体挤压外周袢致开放欠佳。另1个肾小球无新月体,毛细血管袢内内皮细胞增生,胞质丰富。肾小球系膜区增宽,系膜区及少数节段内皮下可见高电子密度的致密物沉积,多处外周袢上皮侧见“驼峰”样电子致密物分布(图3)。GBM厚约250~350 nm,节段偏薄处约190 nm。肾小球足细胞少数胞质微绒毛化,足突融合20%~30%。
小结:新月体肾炎Ⅱ型(急性链球菌感染后肾小球肾炎)。
入院后予间断CBP,辅以保肾、护胃、补钙、纠正贫血及营养支持治疗。患者间断发热,体温最高38.8℃,予哌拉西林他唑巴坦4.5g 1次/8h静脉滴注,导管感染不排除,予拔除股静脉置管,患者仍有低热、血培养阴性,经肾活检诊断明确后于2013-10-07予甲泼尼龙冲击治疗250 mg×3d、500 mg×1d,排除相关禁忌证后,于2013-10-15、2013-10-16追加甲泼尼龙250 mg×2d冲击,后改为泼尼松60 mg/d口服,间断肾脏替代治疗,患者体温正常,仍持续无尿,予以出院,门诊定期行血液透析(HD)并随访观察。
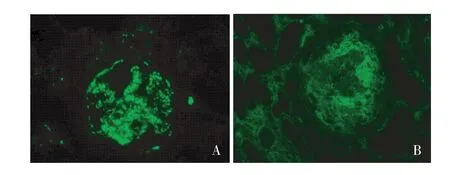
图2 A:C3++,呈颗粒状弥漫分布于肾小球系膜区及血管袢(IF,×400),B:多个肾小球新月体Fibrin阳性(IF,×400)
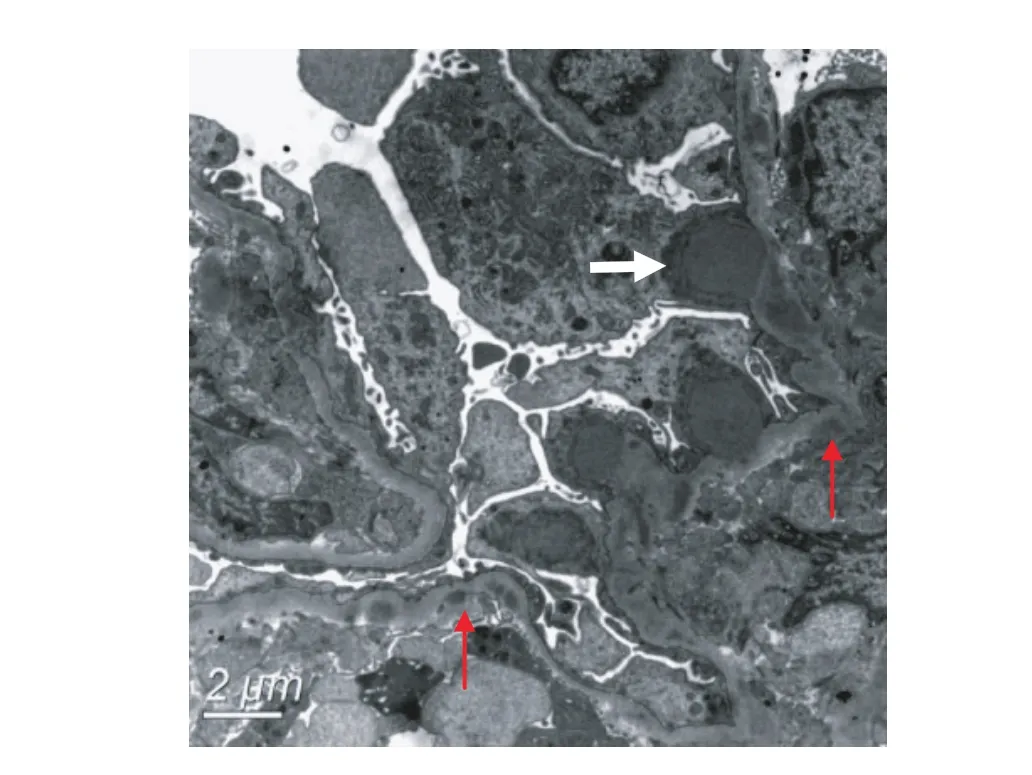
图3 肾小球毛细血管袢上皮侧()见“驼峰”样致密物,系膜区和少数基膜内皮下()少量电子致密物沉积,足细胞足突融合20%~30%(EM)
讨 论
临床病理特点 患者为少年男性,临床表现急进性肾炎综合征,伴无尿,无水肿和高血压,实验室检查见大量镜下血尿,ANCA、抗GBM抗体阴性,补体C3降低,ASO显著升高。肾活检组织学示新月体肾炎(新月体形成100%),新月体挤压肾小球毛细血管袢至闭锁,个别开放尚好的肾小球毛细血管袢内可见中性粒细胞聚集,上皮侧见“驼峰”样嗜复红物,免疫荧光仅见C3沉积,超微结构亦见肾小球上皮侧见“驼峰”样电子致密物。
该患者符合新月体肾炎诊断。新月体肾炎为病理表现相似但病因不同的一组疾病,按照免疫病理特征和发病机制不同,主要分为三型[1,2]:Ⅰ型,免疫荧光见IgG沿GBM线性沉积,循环抗GBM抗体阳性;Ⅱ型,免疫荧光见肾小球系膜区和毛细血管袢大量免疫复合物和补体呈颗粒状沉积,见于多种原发性和继发性肾小球疾病;Ⅲ型,免疫荧光肾小球内无或仅少量免疫复合物沉积,大多数与ANCA相关,临床表现ANCA相关性系统性血管炎,也有少部分ANCA阴性或ANCA和抗GBM抗体双阳性。该患者免疫荧光示弥漫C3肾小球颗粒状沉积,需要考虑是否为Ⅱ型或Ⅲ型新月体肾炎。
Ⅲ型新月体肾炎多数可检出ANCA阳性,少部分ANCA阴性,临床以老年患者多发,除肾脏损害外,同时存在肾外血管炎改变,如肺部、鼻窦等[3]。由于血管炎病情易反复,光镜主要见肾小球节段性新月体,新月体形态多样,细胞性、纤维细胞性和纤维性新月体往往同时存在,肾小球节段坏死和瘢痕病变常见,且无嗜复红物,电镜下罕见电子致密物沉积。而该患者为少年男性,ANCA阴性,影像学检查肺部、鼻窦无明显炎症,光镜下肾小球新月体较大,较多为环状体,以细胞性和纤维细胞性新月体为主,新月体内较多纤维素样坏死。光镜和电镜下可观察到上皮侧孤立的颗粒状沉积物,呈“驼峰”样,因此可排除Ⅲ型新月体肾炎。
免疫荧光见C3在肾小球沉积的Ⅱ型新月体肾炎包括急性链球菌感染后肾小球肾炎和C3肾病。该患者发病前有明确的上呼吸道感染史,临床ASO升高,补体C3降低,需重点考虑急性链球菌感染后肾小球肾炎。急性链球菌感染后肾小球肾炎急性期常表现毛细血管内增生性肾小球肾炎,恢复期以系膜增生性病变为主,免疫荧光IgG和C3肾小球颗粒状沉积,有时仅C3沉积,急性链球菌感染后肾小球肾炎有时可表现为Ⅱ型新月体肾炎,但新月体比例通常不高[4],可出现上皮侧“驼峰”样免疫复合物。该患者新月体比例达100%,肾小球皱缩明显,免疫荧光C3弥漫分布于血管袢和系膜区,光镜和超微结构均见上皮侧“驼峰”样沉积物,因此该患者符合急性链球菌感染后肾小球肾炎,组织改变学为新月体肾炎。本例患者C3肾炎因子、补体H因子、抗补体H因子抗体均为阴性,结合临床和病理表现,排除C3肾病。
该患者除新月体比例达100%外,多处见纤维素样坏死,毛细血管袢腔内大量中性粒细胞聚集,且血液和尿液中性粒细胞比例高,提示中性粒细胞渗出明显,破坏GBM,导致纤维蛋白原逸出和凝血系统活化,形成大量纤维素,而大量纤维素的形成刺激了单核-巨噬细胞和内皮细胞的增生,导致大量新月体的形成。
本例患者肾小管间质急性病变显著并出现慢性化趋势,提示预后不佳。Neild等[5]回顾分析11篇针对共200例急进性肾炎的患者研究,认为新月体的比例越高,肾功能恢复的概率越低。其他系列研究也发现无论是新月体肾炎还是感染后肾炎[6-9],新月体比例与肾脏的预后密切相关。
急性链球菌感染后肾小球肾炎可表现为新月体肾炎。Tang等[10]对中国172例新月体肾炎患者的研究中Ⅱ型新月体肾炎占68.6%,其中2例为链球菌感染后肾小球肾炎。Dewan等[11]报道的22例新月体肾炎的儿童患者中7例为感染后肾小球肾炎,其中1例新月体比例达100%。El-Husseini等[12]对23例急性链球菌感染后新月体肾炎患者进行了平均41月的随访观察,其中男性12例,女性11例,平均年龄12.35岁,其中儿童占70%。87%的患者出现少尿(或无尿)和肉眼血尿,83%的患者出现中~重度高血压,65%的患者接受HD治疗。病理形态学观察发现新月体以细胞性新月体为主,其中40%的患者新月体的比例>75%,4例节段毛细血管袢坏死,10例患者肾功能恢复正常,7例患者肾功能不全,3例进展至终末期肾病,3例死亡。单因素分析发现年龄、新月体比例、间质纤维化、高血压和肾病范围内的蛋白尿是影响患者预后的危险因素,而多因素分析发现仅高血压和肾病范围的蛋白尿是影响预后的危险因素。该研究还对感染后继发的新月体肾炎和其他因素导致的新月体肾炎的病例进行比较发现,感染后新月体肾炎发病年龄小,无尿或少尿、高血压和肉眼血尿的比例更高,但是预后无显著差异。伴大量新月体形成的急性感染后肾小球肾炎,应争取早期诊断,及时治疗。
本例患者临床和实验室检查提示存在急性链球菌感染后肾小球肾炎,但组织学表现弥漫新月体形成,肾小球皱缩,上皮侧见“驼峰”样电子致密物,且肾小管间质病变重,诊断时需要紧密结合临床,寻找能够提示诊断的线索,在积极免疫抑制治疗的基础上加强随访、观察患者预后。
1 唐政,黎磊石.新月体肾炎//黎磊石,刘志红.中国肾脏病学.北京:人民军医出版社,2008:422.
2 Jennette JC.Crescentic glomerulonephritis.In:Jennette JC,Olson JL,Schwartz MM,Silva FG (eds)Lippincott-Ravels,Philadelphia,1998:625-656.
3 Jennette JC,Thomas DB.Crescentic glomerulonephritis.Nephrol Dial Transplant,2001,6(Suppl 6):80-82.
4 Roy S 3rd,Murphy WM,Arant BS Jr.Poststreptococcal crescenteric glomerulonephritis in children:comparison of quintuple therapy versus supportive care.JPediatr,1981,98(3):403-410.
5 Neild GH,Cameron JS,Ogg CS,et al.Rapidly progressive glomerulonephritis with extensive glomerular crescent formation.Q J Med,1983,52(207):395-416.
6 Jardim HM,Leake J,Risdon RA,et al.Crescentic glomerulonephritis in children.Pediatr Nephrol,1992,6(3):231-235.
7 Southwest Pediatric Nephrology Study Group.A clinico-pathologic study of crescentic glomerulonephritis in 50 children.A report of the Southwest Pediatric Nephrology Study Group.Kidney Int,1985,27(2):450-458.
8 Clark G,White RH,Glasgow EF,et al.Poststreptococcal glomerulonephritis in children:clinicopathological correlations and long-term prognosis.Pediatr Nephrol,1988,2(4):381-388.
9 Sotsiou F.Postinfectious glomerulonephritis.Nephrol Dial Transplant,2001,16(Suppl6):68-70.
10 Tang Z,Wu Y,Wang Q,et al.Clinical spectrum of diffuse crescentic glomerulonephritis in Chinese patients.Chin Med J(Engl),2003,116(11):1737-1740.
11 Dewan D,Gulati S,Sharma RK,et al.Clinical spectrum and outcome of crescentic glomerulonephritis in children in developing countries. Pediatr Nephrol,2008,23(3):389-394.
12 El-Husseini AA,Sheashaa HA,Sabry AA,et al.Acute postinfectious crescentic glomerulonephritis:clinicopathologic presentation and risk factors.Int Urol Nephrol,2005,37(3):603-609.
Crescenteric formation in patient w ith poststreptococcal glomerulonephritis
XU Feng,ZENG Caihong
Research Institute ofNephrology,Jinling Hospital,Nanjing University School ofMedicine,Nanjing 210016,China
A 14-year-old boy presented with gross hematuria and renal insufficiency for 8 days.There was the onset of upper respiratory tract infection history three weeks before.Laboratory examination revealed decreased serum complement C3,increased ASO and ANCA as well as anti-GBM antibody negative.Renal biopsy showed crescentic nephritis.Electronicmicroscope indicated subepithelial“hump-like”electron-dense deposits.The final diagnosiswas acute post-streptococcal glomerulonephritis.
acute post-streptococcal glomerulonephritis crescentic glomerulonephritis renal biopsy
2013-11-11
(本文编辑 律 舟)
南京军区南京总医院全军肾脏病研究所(南京,210016)
