人参皂苷Rh2逆转MCF-7/ADM多药耐药性的研究
2013-07-01萍陈
李 萍陈 善
(1 吉林亚泰制药股份有限公司研发部,吉林 长春 130033;2 总后卫生部药品仪器检验所,北京 100071)
人参皂苷Rh2逆转MCF-7/ADM多药耐药性的研究
李 萍1陈 善2
(1 吉林亚泰制药股份有限公司研发部,吉林 长春 130033;2 总后卫生部药品仪器检验所,北京 100071)
目的 观察人采用人参苷Rh2对逆转人乳腺癌多药耐药细胞株MCF-7/ADM的分子机制。方法 采用MTT比色法对不同浓度下人参皂苷Rh2对MCF-7/ADM的阿霉素(ADM)以及氟尿嘧啶(Fu)耐药逆转指标检测,同时使用多功能酶标仪检测人参皂苷Rh2干预对细胞内罗丹明123荧光强度以反映其对细胞多药耐药蛋白P-gp活性的影响。结果 经过人参皂苷Rh2的干预,MCF-7/ADM对ADM以及Fu两种临床常用化疗的敏感性增强。另外,人参皂苷Rh2还对细胞的罗丹明123外排有显著的浓度依赖性抑制作用。结论 人参皂苷Rh2能够有效逆转MCF-7/ADM多药耐药性,其作用机制可能主要为抑制了细胞多药耐药蛋白P-gp的活性。
人参皂苷Rh2;人乳腺癌多药耐药细胞株;多药耐药性
乳腺癌是所有女性肿瘤发病率中最高的一类恶性肿瘤,化疗是目前针对中晚期乳腺癌患者的临床治疗首选[1]。但随着研究的增加,发现治疗一段时间后,患者的化疗效果开始出现下降趋势。研究认为[2],其主要原因为肿瘤细胞产生了耐药性。多药耐药(MDR)是最为常见的一种根据耐药谱划分的一种耐药[3]。MDR产生的主要机制和多药耐药基因编码P-gp的表达存在密切关系,P-gp高表达,能够与用于肿瘤细胞的化疗药物进行结合,最终使得化疗药物排出细胞外,降低化疗的作用[4-6]。人参皂苷Rh2是中药人参的提取物,临床研究认为其有提高患者自身免疫力,增强抗瘤能力的作用[7]。本研究就人参皂苷Rh2对经阿霉素(ADM)以及氟尿嘧啶(Fu)干预下人乳腺癌多药耐药细胞株MCF-7/ADM的生长进行了观察,试图阐述人参皂苷Rh2逆转MCF-7/ ADM多药耐药性的分子作用机制。现报道如下。
1 材料与方法
1.1 一般材料
实验材料主要包括ADM,10mg/支,购自深圳万乐药业有限公司提供;Fu,0.25g/10mL,购自南通精华制药股份有限公司;人参皂苷Rh2,纯度>98%,使用二甲基亚砜(DMSO)对其进行溶解,配置成为20mg/mL规格的稀释液待用;罗丹明123以及四甲基偶氮唑盐(MTT) 购自美国Sigma公司;人乳腺癌多药耐药细胞株MCF-7/ADM,由中南大学湘雅医学院细胞中心所提供。
1.2 实验方法
1.2.1 MCF-7/ADM细胞培养
将MCF-7/ADM放置于10%小牛血清的RPMI 1640培养基中,培养基中适当加入青霉素,剂量为100U/L。培养条件为5%CO2浓度以及37℃下。对MCF-7/ADM细胞中的ADM浓度进行每日一次的检测,维持ADM浓度在1.0mg/L。当浓度不足时,进行适当加药,以维持细胞的耐药性。MCF-7/ADM细胞两天进行一次培养液的更换,另外,3~4d进行一次传代。进行实验前两周,撤除ADM的干预,使得MCF-7/ADM细胞处于化疗药物的培养基中,两周后即可使用。
1.2.2 MTT检验
MTT检验能够对MCF-7/ADM中的存活细胞数进行检测,使用方法如下:对对数期生长的MCF-7/ADM细胞进行收集,选择100μL的移液枪进行吸取,吸取量为100μL,大约含有1×104个MCF-7/ADM细胞。吸取细胞后接种于96孔的培养板内,培养板静置培养12h。12h后,如见孔底基本被细胞单层所铺满时,即可进行分组加药。加药组分为不同浓度的ADM以及Fu组(浓度分别为2.50,5.00,10.00,20.00以及40.00mg/L)以及不同浓度的人参皂苷Rh2组(浓度分别为5、10、20以及40μmol/)。同时设立不加任何药物的对照组,每组均设置复孔5个,使用200μL的移液枪吸取细胞培养液,吸取量为200μ。细胞培养液加入结束后,将培养板继续培养48h。48h后使用移液枪吸入20μL的MTT溶液,加入每个孔内,MTT溶液的浓度为5g/L。之后将培养板放入5%CO2浓度以及37℃下的培养箱中,进行4h的培养。4h后拿出,并吸出每个孔内的细胞培养液,然后使用移液枪吸取150μL的DMSO加入到每个孔内。完成后将培养板放置于摇床上,进行10min的低速摇动、振荡,让每个孔内产生的结晶得到完全的溶解。采用酶标仪进行各孔吸光度(OD值)的测定,波长设置为578nm。对每个孔内的MCF-7/ADM细胞抑制率,具体计算方法如下:细胞抑制率(%) =(1-实验孔OD值/对照孔OD值)×100%。
1.2.3 罗丹明123排出实验
罗丹明123属于P-gp的一类特异性较高的荧光底物,因此,可以通过对MCF-7/ADM细胞内罗丹明123的含量进行测定,以确定人参皂苷Rh2对P-gp活性抑制的作用及具体效率。检测主要通过使用荧光光度计对MCF-7/ADM细胞内的荧光强度进行测定,通过公式计算出罗丹明123外排抑制的情况。公式如下:人参皂苷Rh2对罗丹明123外排抑制效率(%)=(经人参皂苷Rh2处理的荧光强度-对照组的荧光强度)/对照组的荧光强度×100%。具体的检查方法如下:①对对数期生长的MCF-7/ADM细胞进行收集,选择100μL的移液枪进行吸取,吸取量为200μL,大约含有1×104个MCF-7/ADM细胞。吸取细胞后接种于96孔的荧光板内,荧光板板静置培养24h。24h后每孔均加入罗丹明123,浓度为1mg/L。之后将荧光板放置于5%CO2浓度以及37℃下的培养箱中培养20min左右。根据人参皂苷Rh2浓度的不同进行分组观察。实验组设置7个小组,为不同浓度的人参皂苷Rh2组(浓度分别为1,5,10,20,50以及100μmol/L)。对照组加入等体积的RPMI 1640培养液。每个小组均设置5个复孔。之后将荧光板放置于5%CO2浓度以及37℃下的培养箱中培养4h左右。4h后采用D-Hanks清洗液加入每个荧光孔内,静置1min后倒出,相同方法再进行一次清洗。清洗后将荧光板放入0.3mol/L HCl以及50%乙醇配制而成的消化液中,并放置于4℃冰箱中过夜。荧光强度的测定利用多功能酶标仪进行,激发波长设定在485nm,发射波长设定在538nm。
1.3 统计学方法
上述实验方法重复进行3次,应用SPSS 14.0软件。计量资料以(χ—±s)表示,均数比较采用t检验、方差因素分析,以P<0.05为差异具有统计学意义。
2 结 果
2.1 人参皂苷Rh2干预ADM抑制MCF-7/ADM细胞生长情况
结果表明,随着ADM药物浓度的提高,可以发现对MCF-7/ ADM细胞生长的抑制情况明显的上升。对人参皂苷Rh2干预前后相同浓度的ADM对MCF-7/ADM细胞的抑制率进行分析,可以发现结果人参皂苷Rh2进行干预后对细胞的抑制率显著上升(P<0.01)。数据见表1。
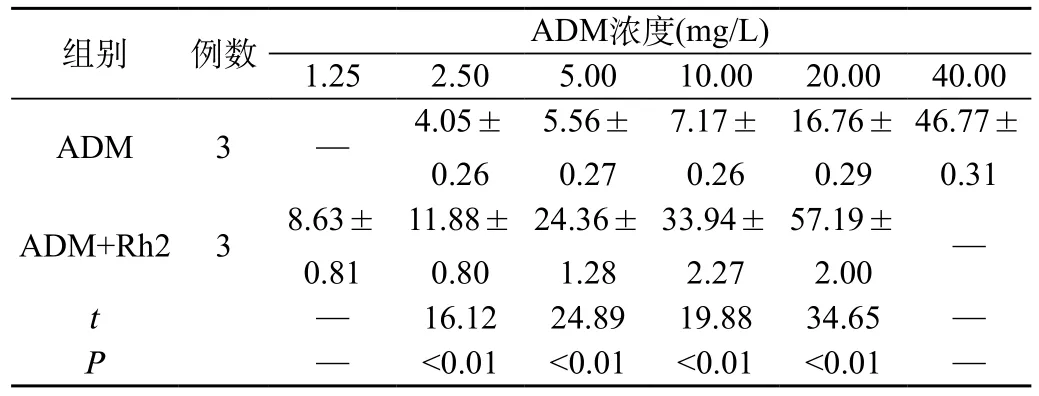
表1 人参皂苷Rh2干预ADM抑制MCF-7 /ADM细胞生长情况(例,χ—±s)
2.2 人参皂苷Rh2干预Fu抑制MCF-7/ADM细胞生长情况
结果表明,随着Fu药物浓度的提高,可以发现对MCF-7/ADM细胞生长的抑制情况明显的上升。对人参皂苷Rh2干预前后相同浓度的Fu对MCF-7/ADM细胞的抑制率进行分析,可以发现Fu(5,10mg/L)对进行干预后对细胞的抑制率显著上升(P<0.01)。数据见表2。
2.3 罗丹明123排出实验分析
结果表明,当人参皂苷Rh2>10μmol/L时,干预组的荧光强度明显高于对照组(P<0.01)。数据见表3。
3 讨 论
3.1 MDR发生机制
MDR是目前临床治疗各类恶性肿瘤患者最为严重的疗效问题,也是严重影响恶性肿瘤患者生存率的问题。因此,降低MDR的发生,提高肿瘤细胞对化疗的敏感程度,就成为了当前肿瘤研究最主要的方向[8-9]。目前国内外的研究均认为[10-11],多药耐药基因(MDR1)编码的P-gp蛋白是MDR产生的重要机制。P-gp蛋白的主要功能是转运细胞内部的多种物质,例如内源性激素、异生物以及肽类等。另外,P-gp蛋白还具有氯离子通道的作用。因此当某些带有阳离子的化疗药物进行已经产生耐药性的细胞时,P-gp可以和相关化疗药物进行一系列化学结合,最终在相邻的两个蛋白之间形成一个离子通道。该离子通道对正电荷有不同的反应,当负电荷的Cl-进入肿瘤细胞时,离子通道会识别并让其通过。而当正电荷的化疗药物进入肿瘤细胞时,离子通道同样会识别,通过ATP水解后得到的能量将带有正电荷的化疗药物排出到肿瘤细胞外。最终的结果就是细胞内的化疗药物浓度较低,对肿瘤细胞的杀伤能力有限,并使得肿瘤细胞得到一定的耐药性[12]。

表2 人参皂苷Rh2干预Fu抑制MCF-7/ADM细胞生长情况(例,χ—±s)
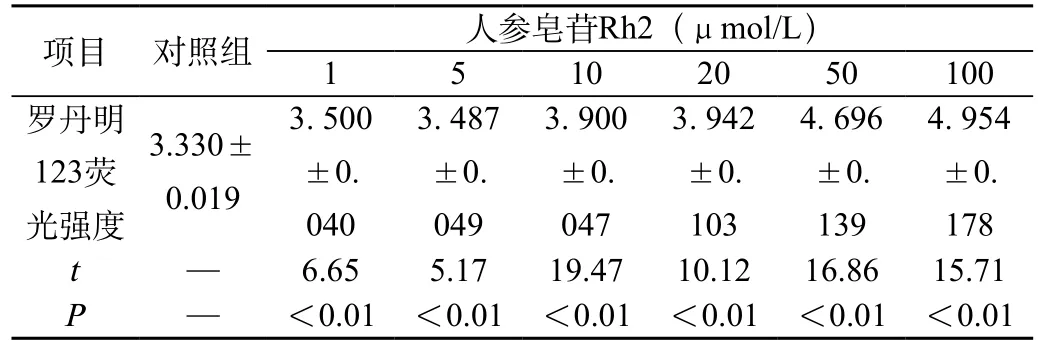
表3 罗丹明123排出实验分析(例,χ—±s)
3.2 MDR抑制研究
P-gp蛋白的高表达被认为是MDR发生的高危因素,因此,如果对P-gp介导的MDR进行抑制就成为治疗各类恶性肿瘤的关键。国内外已有文献表明[13-14],目前已经发现了多种天然或人工合成的化合物有一定的抑制P-gp蛋白表达能力。人参皂苷Rh2属于天然植物人参的根部提取物,有学者在对人口腔上皮癌(KBV20C)进行人参皂苷Rh2干预,发现经过人参皂苷Rh2干预后的KBV20C细胞对化疗药物的敏感程度明显得到增强。并认为是通过和P-gp底物(化疗药物)发生了竞争性结合,从而降低了P-gp与化疗药物的结合,从而达到逆转耐药性的作用[15]。本研究就人参皂苷Rh2对逆转人乳腺癌多药耐药细胞株MCF-7/ADM的分子机制进行实验研究,结果表明,人参皂苷Rh2+ADM组和ADM组比较,MCF-7/ADM细胞的生长得到了明显的抑制(P<0.01)。另外,当Fu(5,10mg/L)+人参皂苷Rh2,与不加人参皂苷Rh2的对照组比较,MCF-7/ADM细胞的生长得到了明显的抑制(P<0.01)。均提示人参皂苷Rh2是一种较好的MDR逆转剂。另外,我们采用罗丹明123排出实验对P-gp的特异性荧光底物进行检测。结果发现加入人参皂苷Rh2后,能够明显提高MCF-7/ADM细胞中罗丹明123的浓度。结果与MTT检验的结果相一致,均说明人参皂苷Rh2能够逆转MCF-7/ADM细胞的耐药性,从而增加化疗药物对肿瘤的杀伤作用。
综上所述,人参皂苷Rh2能够明显逆转体外培养的MCF-7 /ADM细胞的化疗药物耐药性,并且知道其机制是通过抑制P-gp蛋白的表达来达到。因此,人参皂苷Rh2有望成为临床新型的抗肿瘤药物。
[1] 朱君荣,孙建国,谢海棠,等.人参皂苷-Rh2对人乳腺癌T47D细胞的生长抑制作用及对Caspase-3表达的影响[J].中国临床药理学与治疗学,2007,12(6):630-634.
[2] 黄景嘉.人参皂苷Rh2及其新型衍生物诱导乳腺癌MCF-7细胞凋亡的分子调控机制[D].长沙:中南大学,2010.
[3] 李罗丝.人参皂苷Rh2诱导HL-60细胞凋亡的信号转导机理[D].长沙:中南大学,2006.
[4] Li Yu,Peng S.A Variant of Human Estrogen Receptor-α,hER-α36 Weakens Docetaxel Drug Efficacy against Human Breast Cancer Cell Line MCF-7[J].中国癌症研究(英文版),2009,21(4):325-332.
[5] Han WD,Wu ZQ,Zhao YL,et al.FHL2 Antagonizes Idl-Promoted Proliferation and Invasive Capacity of Human MCF-7 Breast Cancer Cells[J].中国癌症研究(英文版),2011,22(3):194-200.
[6] Chen YH,Wu ZQ,Zhao YL,et al.FHL2 inhibits the Id3-promoted proliferation and invasive growth of human MCF-7 breast cancer cells[J].中华医学杂志(英文版),2012,125(13):2329-2333.
[7] Han WD,Wu ZQ,Zhao YL,et al.FHL2 Antagonizes Id1-Promoted Proliferation and Invasive Capacity of Human MCF-7 Breast Cancer Cells[J].中国癌症研究(英文版),2010,22(3):194-200.
[8] 刘玉华,洪理泉,於王骐,等.miR-15a诱导人乳腺癌细胞MCF-7凋亡的作用机制[J].中华肿瘤杂志,2011,33(11):827-830.
[9] 芦金荣,桂力,沙磊,等.具有选择性雌激素受体调节活性的大豆苷元衍生物的合成及生物活性研究[J].有机化学,2011,31(11): 1852-1863.
[10] 葛雅琨,张元新,陈云鹏,等.Nutlins类似物NL-608诱导人乳腺癌MCF-7细胞凋亡[J].中华肿瘤杂志,2012,34(2):100-103.
[11] 林芳,钱之玉,薛红卫,等.青蒿素和青蒿琥酯对人乳腺癌MCF-7细胞的体外抑制作用比较研究[J].中草药,2003,34(4):347-349.
[12] 肖锡岗,房林,李华,等.酪蛋白激酶Ⅱ抑制剂促进MCF-7乳腺癌细胞凋亡[J].中华实验外科杂志,2011,28(12):2121-2123.
[13] 黄瀚,李兵,欧阳林旗,等.叶酸受体及二氢叶酸还原酶与人乳腺癌细胞MCF-7/ADR多药耐药的关系[J].中国药理学通报,2011, 27(1):99-103.
[14] 王秀丽,孔力,赵瑾瑶,等.三氧化二砷逆转人乳腺癌MCF-7/ADM细胞耐药的机制研究[J].中华肿瘤杂志,2002,24(4):339-343.
[15] 王妍,张莲芬,冯磊,等.人乳腺癌细胞系MCF-7/W和MCF-7/ADM细胞中阿霉素结合蛋白的分析[J].中国药理学通报,2007,23(9): 1188-1193.
Study of the Ginsenoside Rh2 Reversal MCF-7/ADM Multidrug Resistance
LI Ping1, CHEN Shan2
(1 Department of Research and Development, Jilin Yatai Pharmaceutical Incorporated Company, Changchun 130033, China; 2 The Ministry of Health Bureau Drug Inspection Instrument, Beijing 100071, China)
Objective To observe the molecular mechanism of the ginsenoside Rh2 to reverse the multidrug resistance of human breast cancer cell lines MCF-7/ADM. Methods Using MTT colorimetric method to test the resistance reversal index of MCF-7/ADM to adriamycin (ADM) and fluorouracil (Fu) by different concentrations of ginsenoside Rh2.,at the same time use muti-function eliasa to detect ginsenoside Rh2 intervention on cellular rhodamine 123 to reflect the fluorescence intensity of drug-resistant cell protein P - gp active influence. Results After ginsenoside Rh2 intervention, sensitivity of MCF - 7 / ADM to ADM and Fu which were two clinical commonly used chemotherapy medicines had been enhanced. In addition, the cell effluen of rhodamine 123 was significantly inhibited by the ginsenoside Rh2 with concentration dependence. Conclusion The ginsenoside Rh2 can effectively reverse the multidrug resistance of MCF-7/ADM,and its mechanism may mainly for the inhibition of the activity of drug resistance protein P-gp.
Ginsenoside Rh2; Human breast cancer multidrug resistant cell line; Multidrug resistance
R737.9
B
1671-8194(2013)21-0008-03
