布朗葡萄藻脂质含量的荧光光谱检测方法的改进
2013-06-30刘新颖汪志平于金鑫吕蓓芬马丽芳陈子元
刘新颖,汪志平,于金鑫,吕蓓芬,马丽芳,陈子元
浙江大学原子核农业科学研究所农业部核农学重点开放实验室,浙江杭州 310029
微藻因光合效率高、生长周期短、脂质产率高、不占用耕地,且可高效利用多种污水和废气,而被国内外公认为第三代生物液体燃料的主要生产者之一,并可望通过发挥其超强的生物转化功能最终实现环境与能源相和谐[1-3]。布朗葡萄藻Botryococcus braunii 因其脂质含量高(可达细胞干重85%),而被国内外视为具重大研究与开发前景的能源微藻之一[4-5]。与其他能源微藻一样,建立快速、微量、可靠的脂质含量检测技术是开展葡萄藻种质改良和培养模式优化等研发的基础。目前国内外普遍采用尼罗红荧光光谱法快速检测微藻等生物细胞中的脂质含量,其主要原理是当亲脂性的噁嗪类染料——尼罗红(9-(diethylamino) benzo[a]phenoxazin-5(5H)-one)
进入细胞后能与胞内脂质结合并发出荧光,进而通过测定荧光强度即可表征被测样品的脂质含量[6-8]。该方法的原理与步骤虽简单,但必须针对被测生物样品的形态和结构等特殊性解决以下两方面的关键前提问题才可能奏效。一方面,绿藻等生物坚厚的细胞壁会阻碍尼罗红进入细胞,而胞内尼罗红的量不足必然会导致检测灵敏度降低、测量值偏小[9]。近年来,Chen 等[9]研究发现二甲基亚砜能有效辅助尼罗红进入普通小球藻细胞。随后,一些学者通过优化二甲基亚砜浓度等条件,有效解决了尼罗红不易进入微拟球藻[10]、单针藻[11]、斜生栅藻[12]、小球藻[13]、细菌[14]及酵母菌[15]等细胞的难题。另一方面,分光光度法测量要求被测样品呈溶液或均匀悬浮液[16],但葡萄藻等一些微藻,其细胞不同于小球藻和微拟球藻等微藻呈分散状态,而是通常呈簇状或集落态,这导致藻细胞不能均匀分布于检测液中而严重影响测量[4]。Lee 等[17]虽于1998年就曾报道可利用尼罗红荧光光谱法检测葡萄藻的脂质含量,但也许因未能有效解决上述两方面关键问题,致使该方法至今尚未在葡萄藻研发中得以广泛应用,而仍多沿用样品用量大、前处理复杂、耗时耗力的称重测量法[18-19]。
为此,本文拟通过超声波技术分散葡萄藻集落、二甲基亚砜辅助尼罗红进入藻细胞、优化染色条件等,有效改进现有的尼罗红荧光光谱法检测布朗葡萄藻脂质含量的方法,以期为葡萄藻育种与培养等研发提供快速、灵敏的脂质含量检测技术。
1 材料与方法
1.1 藻株与培养条件
B.braunii ZJU3001为本实验室2003年从云南抚仙湖分离并纯化。采用BG-11培养基[20]培养,接种时藻液的初始OD560为0.1。培养温度为25℃,光暗周期比12 h∶12 h,光照强度60μmol/(m2·s),藻液每天摇匀2~3次。试样均采用处于对数生长期的藻液。藻细胞干重参照黄峙等[21]方法测定。
1.2 超声波处理
取4 mL葡萄藻液转入5 mL离心管并置于冰水浴中,设定JY92-Ⅱ型超声仪(新芝,中国)的频率为20 kHz,发射功率为100 W,变幅杆伸至藻液面下1 cm,以1 s/1 s (开/关)间歇处理藻液20 s。
1.3 光谱检测
参照Wang 等[22]方法,用Ultrospec 2000型紫外−可见分光光度计(Pharmacia 公司,美国)检测样品在400~750 nm 的吸收光谱,其中OD560可反映藻液的藻细胞密度;参照Lee 等[17]方法,用RF-5000型荧光分光光度计(Shimadzu 公司,日本)检测经尼罗红(NR)染色样品的荧光发射光谱。将样品置于黑体微量比色皿中,使在490 nm 激发光下扫描500~700 nm 的荧光发射光谱,并将在540~628 nm 范围内获得一个特征性的发射峰,其峰值可反映藻液的脂质荧光强度[9]。
1.4 尼罗红染色条件的优化
[9-13,23],设定DMSO 终体积分数、NR 终质量浓度以及染色时间和温度的优化范围,并依次进行优化。不同浓度的DMSO 溶液和NR 溶液分别由去离子水稀释DMSO (分析纯)和10µg/mL NR (Sigma 公司)丙酮储液配制而成。脂质检测方法为:将葡萄藻液先按1.2方法进行超声波处理,而后依次加入等体积不同浓度的DMSO 溶液和NR 溶液,充分混匀后置于黑暗的恒温箱内进行一定温度和时间的染色反应,再按1.3方法检测其荧光发射光谱。藻细胞脂质的相对荧光强度值为染色液的相对荧光强度值分别减去NR与DMSO混合液及藻液在相应波长的相对荧光强度值。数据采用SAS 等软件进行统计分析。
2 结果与分析
2.1 葡萄藻光谱检测样品的制备
在自然条件下,葡萄藻细胞通常聚集成簇,由几十至上百个细胞组成串状集落,因此藻细胞在培养液中的分散度和均匀性不佳(图1,A-1),影响了光谱检测的灵敏度和稳定性[15]。我们经研究发现,用频率为20 kHz、发射功率为100 W 的超声波,1 s/1 s (开/关)间歇处理藻液20 s 能有效分散集落,使细胞呈均匀分布(图1,A-2)。处理后藻液的可见光吸收值增大了近1倍,680 nm 附近的叶绿素吸收峰更加明显;因处理前、后藻液上清液的吸光值均几乎为零,说明并未因超声使细胞破碎进而导致叶绿素等色素渗漏到藻液而产生相应的吸收峰(图1B)。同时,由OD560的时间驱动扫描曲线(图1C)可知,未经超声波处理的藻液因细胞呈集落状、易下沉而导致OD560从样品放入检测池即开始明显波动,约40 s 后呈线性下降,至第5 min 时已只有原来起初的1/3左右;而处理后藻液的OD560能在2 min 内保持稳定,至第5 min 时也仍基本保持不变。对超声波处理前、后藻液细胞干重与OD560的回归分析结果(图1D)显示,处理组具有更好的重复性,且检测灵敏度比对照组的提高了52.7%,相关性系数也由0.988提高到0.998。以上结果表明,合适的超声波处理条件不仅能够保持葡萄藻细胞的完整性,而且能有效分散集落细胞,使藻细胞在溶液中得以均匀悬浮,满足了光谱检测的要求,这为葡萄藻生物量和脂质含量的光谱法测量打下了基础。
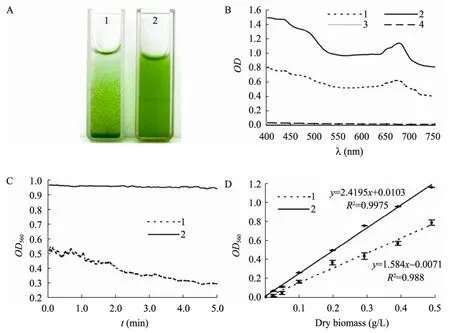
图1 超声波处理对藻细胞状态及光谱检测的影响Fig.1 Effects of ultrasonic treatment on the cell states and spectrum detection.(A) Cell states.(B) Visible spectra.(C)Time driving scanning spectra at 560 nm.(D) Regression curves of dry weight and OD560 of algal samples.1:algal suspension without ultrasonic treatment;2:algal suspension with ultrasonic treatment;3:algal supernatant without ultrasonic treatment;4:algal supernatant with ultrasonic treatment.
2.2 二甲基亚砜对尼罗红染色的辅助作用
适当浓度的DMSO可辅助NR进入藻细胞进而提高脂质检测的灵敏度,但其适宜浓度因藻种差异而从1%到30%不等[9-13,23]。实验考察了DMSO 终体积分数分别为0、2%、5%、8%、15%、22%、28%时对葡萄藻脂质含量检测的影响,其他条件为:NR 终浓度为1.3µg/mL,40℃染色10 min。荧光发射光谱显示(图2),B.braunii ZJU3001的脂荧光发射峰出现在568 nm 附近。随着DMSO 浓度的提高,脂发射荧光先增强后减弱,当DMSO 为5%时荧光值最大,比不加时提高了67.4%。值得注意的是,当DMSO 浓度过高(终浓度大于15%)时,不仅脂发射荧光强度减弱,而且在640 nm 附近会出现NR 自发荧光发射。可见,对于葡萄藻,DMSO能够明显提高其脂质含量检测的灵敏度,但需要确定最适浓度,浓度过高反而会对脂质检测产生不利影响。本实验中,DMSO 终浓度以5%为佳,不宜超过15%。
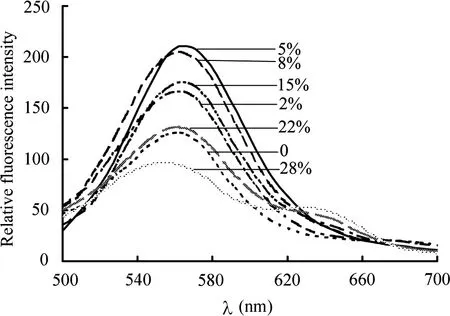
图2 二甲基亚砜质量分数对脂质含量检测的影响Fig.2 Effect of DMSO concentrations on lipid content determination of B.braunii.
2.3 尼罗红浓度对脂质含量检测的影响
NR 的浓度是影响其染色效果的关键因素,不同微藻的使用浓度差别很大(0.01~100µg/mL),已报道绿藻的NR 终浓度一般为0.3~2.0µg/mL[9-13,17,23]。实验考察了NR 终浓度为0.2~2.0µg/mL 时对葡萄藻脂质含量检测的影响,其他条件为:DMSO 终浓度为5%,40℃染色10 min。荧光发射光谱(图3)显示,脂荧光发射峰的波长在 NR 浓度较低时稍有红移(555~568 nm),而浓度较高时基本保持不变,这与胡小文等[22]报道的相似。随NR 浓度的提高,脂发射荧光先增强后减弱,最大荧光值出现在终浓度为1.0µg/mL 时。当终浓度大于1.3µg/mL 时脂发射荧光逐渐减弱,NR 发射荧光逐渐增强。当终浓度为2.0µg/mL 时,NR 的荧光发射峰甚至会高于并严重干扰脂荧光发射峰。因此对于葡萄藻,NR 终浓度以1.0µg/mL 为佳,不宜超过1.7µg/mL。

图3 尼罗红浓度对脂质含量检测的影响Fig.3 Effect of Nile red concentrations on lipid content determination of B.braunii.
2.4 染色时间和温度对脂质含量检测的影响
染色时间和温度是影响染色效果的两个重要因素,已报道的时间和温度通常分别为1~10 min、25℃~40℃,条件太低时染色效果不佳,太高时则可能造成荧光淬灭[9-13,23]。如图4所示,实验考察了染色时间为1~30 min 及温度为20℃~60℃时对葡萄藻脂质含量检测的影响。脂发射荧光强度随染色时间的延长和温度的提高都呈先增强后减弱的趋势。随染色时间延长,脂荧光发射峰波长在564~571 nm 范围内发生蓝移,相对荧光强度在染色1 min 时最低,5 min和10 min 时显著提高,20 min 及更长时间则显著减弱。随染色温度的提高,脂荧光发射蜂的波长基本保持不变,相对荧光强度在温度为40℃时达到最大值,而后显著减弱,60℃时荧光值已降低了83.5%。因此,葡萄藻的染色时间和温度以10 min、40℃为佳,这与Chen 等[9]以小球藻为材料的研究结果一致。

图4 染色时间(A)和温度(B)对脂质含量检测的影响Fig.4 Effect of staining time (A) and temperature (B) on lipid content determination of B.braunii.
2.5 藻细胞密度对脂质含量检测的影响
考察被测藻液的细胞密度与相对荧光强度间的相关性,不仅可检验测量方法的可靠性,而且可确定适于检测的细胞密度范围,有利于脂质含量的准确测定和不同藻样脂质含量的比较研究[23]。采用上述改进方法测定不同细胞密度(OD560)藻液的相对荧光强度,并对二者进行回归分析。结果显示(图5),随着藻细胞密度,即脂质含量的增加,脂发射荧光强度逐渐增加,藻液OD560在检测范围内(OD560为0.1~1.1)与藻液相对荧光强度呈良好的正相关关系,R2高达0.997。可见,藻液细胞密度OD560为0.1~1.1时均可利用该方法直接进行检测。
2.6 改进方法与传统方法的比较

图5 藻细胞密度与相对荧光强度的关系Fig.5 Relationship of OD560 and relative fluorescence intensity.

表1 改进方法与传统尼罗红染色方法的比较Table 1 Comparison of modified and traditional Nile red methods
为进一步检验本文超声波处理及染色条件优化对葡萄藻脂质检测的效果,对改进方法(MethodⅠ)、改进方法中不包括超声波处理(MethodⅡ),以及Lee 等[17]的传统方法(MethodⅢ)进行了比较。实验设置6个重复,各参数及结果见表1。可以看出,改进方法的灵敏度最高,重复性也最好,相对荧光强度较其他两种方法分别提高了12.4%和196.6%,反映重复性的相对标准偏差(RSD)分别由13.60%和10.91%降至1.84%。比较MethodⅠ和Ⅱ可以看出,利用合适的超声条件对藻液进行前处理能够明显提高检测的重复性。由图1可知,这主要是因超声波处理提高了藻细胞的分散度和均匀性,从而提高了藻细胞定量的准确性、光谱检测的稳定性和灵敏度等。比较MethodⅡ和Ⅲ可以看出,染色条件的优化显著提高了葡萄藻脂质含量检测的灵敏度(P<0.05)。优化的染色条件与传统方法相比在体系中加入了5% DMSO,并将染色温度由25℃提高至40℃,由前面结果可知,染色体系中加入5% DMSO 可使检测灵敏度提高约67.4%(图2),而染色温度由20℃提高至40℃仅使其提高约16.8%(图4B),因此主要是DMSO 的加入使灵敏度得以显著提高。综上可知,改进方法能更准确、灵敏地反映葡萄藻的脂质含量。
3 讨论
布朗葡萄藻是一种世界广布的能源微藻,因能合成大量的脂类物质而早已引起国内外的极大关注。在已有研究中,葡萄藻脂质含量的测定通常涉及有机试剂提取脂质及称重测量,进而可采用各类色谱法进行组分分离和分析。应用这一程序虽能获得脂质以及其含量、组成、结构等较多信息,但必须确保脂质提取完全,同时避免其分解和/或氧化,前处理复杂且样品用量大,在高通量检测方面受到明显制约[9-10]。尼罗红染色荧光光谱法因其灵敏、简便的特点成为目前国内外普遍采用的快速检测方法,然而葡萄藻因其特殊的细胞结构特点,导致传统检测方法的灵敏度和重复性不甚理想而尚未能在其研发中得以广泛应用。本研究发现,引进超声波技术分散葡萄藻集落细胞以及二甲基亚砜(DMSO)辅助NR 进入细胞,能够显著改善上述问题(表1),尤其对于细胞聚集群体较大、细胞壁较坚厚的藻株具有重要意义。
超声波技术在生命科学领域已得到广泛的应用和发展,其通过空化作用产生冲击波和高温高压,甚至产生电离效应和放电,导致空泡周围的细胞的胶质鞘、壁和质膜的击穿而产生较强的生物学效应[24]。目前在葡萄藻的研发中,超声波技术多用于辅助脂质的提取[17,25],而用于制备光谱检测样品还鲜见报道。由图1和表1可知,利用超声波处理葡萄藻液能够显著提高细胞的分散度和均匀性,使取样时藻细胞定量的准确性、光谱检测的稳定性和灵敏度得以提高,对利用光谱法准确测定葡萄藻生物量和脂质含量起到重要作用。这一结果对其他以细胞群体状态存在的单细胞或多细胞藻类同样具有参考意义。
适宜的NR 染色条件是提高微藻脂质检测灵敏度的关键。本文优化的DMSO 和NR 的终浓度分别为5%和1.0µg/mL,染色时间和温度分别为10 min、40℃。与已报道的一些微藻的染色条件(表2)相比,DMSO 和NR 的浓度具有明显差异。采用表2中浓度条件进行葡萄藻脂质含量检测时,其灵敏度仅为优化浓度时的一半左右,浓度过高(>15%)时还会产生NR 荧光发射峰而对检测结果造成影响(图2~3)。Doan 等[10]认为藻种间因细胞形态和结构及胞内脂滴大小等差异,而导致染色条件不尽相同,这也提示在用尼罗红荧光光谱法检测并比较不同藻种的脂质含量时,宜采用各自适合的染色条件。
另外,图2~3表明,DMSO 和NR 浓度对葡萄藻脂质检测具有很大影响,因而它们在测量体系中的量必须尽可能准确。先前报道方法通常在藻液中加入高浓度、微小体积的NR 或DMSO[10,12-13,23],致使加样时的随机误差较大,难以准确定量。改进方法通过设定染色体系中藻液、DMSO 溶液和NR 溶液的体积比为1∶1∶1,扩大了二者的加样体积,使检测结果更加准确和稳定。
综上所述,本改进方法有助于快速、灵敏的进行布朗葡萄藻脂质含量的测定,这对于葡萄藻优良藻株和培养模式等的快速筛选,以及阐明其脂质积累规律和机理等研究具有重要意义,为布朗葡萄藻及其他藻类的研究提供了必要的技术支撑。

表2 几种微藻的尼罗红染色条件Table 2 Nile red staining conditions of several microalgae
[1]Zhao ZB,Hu CM.Progress in bioenergy-oriented microbial lipid technology.China J Biotech,2011,27(3):427−435(in Chinese).赵宗保,胡翠敏.能源微生物油脂技术进展.生物工程学报,2011,27(3):427−435.
[2]Huang YM,Wang WL,Li YG,et al.Strategies for research and development and commercial production of microalgae bioenergy.China J Biotech,2010,26(7):907−913(in Chinese).黄英明,王伟良,李元广,等.微藻能源技术开发和产业化的发展思路和策略.生物工程学报,2010,26(7):907−913.
[3]Scott SA,Davey MP,Dennis JS,et al.Biodiesel from algae:challenges and prospects.Curr Opin Biotechnol,2010,21:277−286.
[4]Wang XY.A review of studies on the hydrocarbon——rich microalga Botryococcus braunii.Acta Microbiol Sin,1997,27(5):405−409(in Chinese).王修垣.高产烃丛粒藻的研究概况.微生物学报,1997,27(5):405−409.
[5]Metzger P,Largeau C.Botryococcus braunii:a rich source for hydrocarbons and related ether lipids.Appl Microbiol Biotechnol,2005,66:486−496.
[6]Greenspan P,Fowler SD.Spectrofluorometric studies of the lipid probe,Nile Red.J Lipid Res,1985,26:781−789.
[7]de la Jara A,Mendoza H,Martel A,et al.Flow cytometric determination of lipid content in a marine dinoflagellate,Crypthecodinium cohnii.J Appl Phycol,2003,15:433−438.
[8]Eltgroth ML,Watwood RL,Wolfe GV.Production and cellular localization of neutral long-chain lipids in the haptophyte algae Isochrysis galbana and Emiliania huxleyi.J Phycol,2005,41:1000−1009.
[9]Chen W,Zhang CW,Song L,et al.A high throughput Nile red method for quantitative measurement of neutral lipids in microalgae.J Microbiol Methods,2009,77:41−47.
[10]Doan TTY,Obbard JP.Improved Nile red staining of Nannochloropsis sp..J Appl Phycol,2011,23(5):895−901.
[11]Yang X,Liu PH,Hao ZD,et al.Study on isolation of Monoraphidium sp.with rich lipid and its lipid extraction technology monoraphidium.J Anhui Agri Sci,2011,39(32):19988−19990,20124(in Chinese).杨勋,刘平怀,郝宗娣,等.富油微藻Monoraphidium sp.的分离及其油脂提取工艺研究.安徽农业科学,2011,39(32):19988−19990,20124.
[12]Zhang JJ,Lü XJ,Li AF,et al.Rapid estimation of lipids in microalgae cells.China Biotechnol,2012,32(1):64−72(in Chinese).张敬键,吕雪娟,李爱芬,等.微藻细胞油脂含量的快速检测方法.中国生物工程杂志,2012,32(1):64−72.
[13]Wang HY,Fu R,Huang BX.Rapid determination of lipid in Chlorella base on Nile red fluorescence.China Oils and Fats,2012,37(3):78−81(in Chinese).王海英,符茹,黄宝祥.基于尼罗红荧光染色的小球藻脂质快速检测方法研究.中国油脂,2012,37(3):78−81.
[14]Pinzon NM,Aukema KG,Gralnick JA,et al.Nile red detection of bacterial hydrocarbons and ketones in a high-throughput format.MBIo,2011,2(4):e00109-11.
[15]Sitepu IR,Ignatia L,Franz AK,et al.An improved high-throughput Nile red fluorescence assay for estimating intracellular lipids in a variety of yeast species.J Microbiol Methods,2012,91(2):321−328.
[16]Shen PP,Wang CH,Qi YZ,et al.An optical density method for determination of microalgal biomass.J Jinan Univ:Nat Sci,2001,22(30):115−119(in Chinese).沈萍萍,王朝晖,齐雨藻,等.光密度法测定微藻生物量.暨南大学学报:自然科学版,2001,22(30):115−119.
[17]Lee SJ,Yoon BD,Oh HM.Rapid method for the determination of lipid from the green alga Botryococcus braunii.Biotechnol Tech,1998,12(7):553−556.
[18]Ge YM,Liu JZ,Tian GM.Growth characteristics of Botryococcus braunii 765 under high CO2concentration in photobioreactor.Biores Technol,2011,102(1):130−134.
[19]Deng LP,Senseman SA,Gentry TJ.Effect of selected herbicides on growth and hydrocarbon content of Botryococcus braunii (Race B).Ind Crops Prod,2012,39:154−161.
[20]Stanier RY,Kunisawa R,Mandel M,et al.Purification and properties of unicellular blue-green algae (order Chroococcales).Bacteriol Rev,1971,35(2):171−205.
[21]Huang Z,Zhen WJ,Guo BJ.Optimization of cultivation conditions in Se-enriched Spirulina platensis.China J Biotech,2002,18(3):273−276(in Chinese).黄峙,郑文杰,郭宝江.钝顶螺旋藻富硒培养条件的优化.生物工程学报,2002,18(3):273−276.
[22]Wang ZP,Zhao Y.Morphological reversion of Spirulina (Arthrospira) platensis (cyanophyta):from linear to helical.J Phycol,2005,40:622−628.
[23]Hu XW,Ma S,Gong SF,et al.Determination of microalgae lipids by fluorescent spectrometry.China Oils Fat,2011,36(4):70−73(in Chinese).胡小文,马帅,弓淑芬,等.荧光光谱法检测微藻中油脂.中国油脂,2011,36(4):70−73.
[24]Ahmadi F,Mcloughlin IV,Chauhan S,et al.Bio-effects and safety of low-intensity,low-frequency ultrasonic exposure.Prog Biophys Mol Biol,2012,108(3):119−138.
[25]Sakamoto K,Baba M,Suzuki I,et al.Optimization of light for growth,photosynthesis,and hydrocarbon production by the colonial microalga Botryococcus braunii BOT-22.Biores Technol,2012,110:474−479.
