枯草芽胞杆菌168不对称转化产生磷霉素的蛋白质组学分析
2013-06-30解复红钞亚鹏石家骥张国青杨敬钱世钧
解复红,钞亚鹏,石家骥,张国青,杨敬,钱世钧
1 中国科学院微生物研究所传感技术联合国家重点实验室,北京 100101
2 河南省科学院生物研究所河南省工业酶工程技术研究中心,河南郑州 450008
磷霉素(图1)是一种由Streptomyces[1]和Pseudomonas[2]产生的抗生素,它的分子结构简单,有一个环氧环和一个天然产物中不常见的C-P 键。磷霉素具有抑制革兰氏阳性菌和革兰氏阴性菌的活性,现在被广泛用于治疗细菌感染疾病。
磷霉素与细菌细胞壁合成的必需物磷酸烯醇式丙酮酸的空间结构相似,可与丙酮酰转移酶共价结合,使其不可逆失活,从而抑制细菌细胞壁的合成,因此,它对革兰氏阳性菌和阴性菌均具有杀灭作用。由于临床上对抗生素的大量使用,导致了一些病源细菌对传统的抗生素产生了抗药性。如发现病原菌肺炎链球菌Streptococcus pneumoniae 对头孢菌素(Cephalosporin)具有抗药性,金黄色葡萄球菌Staphylococcus aureus 对二甲氧基青霉素(Methicillin)具有抗药性,屎肠球菌 Enterococcus faecium 对万古霉素(Vancomycin)具有抗药性等。这一方面提高了治疗成本,另一方面也加大了治疗的难度。由于磷霉素的结构和作用位点与其他常用的抗生素有很大的不同,因此无交叉耐药性而有协同作用,磷霉素对这些抗药的致病菌具有很好的杀灭作用[3-6]。因此,在目前致病菌耐药性日益增多的情况下,磷霉素具有不可替代的临床应用价值和理论研究意义。

图1 磷霉素的分子结构Fig.1 Structure of fosfomycin.
由于磷霉素的化学结构简单,目前工业上以化学全合成法生产,在化学合成中磷霉素的直接前体物质是顺丙烯磷酸(cis-propenylphosphonic acid,cPPA)。顺丙烯磷酸经环氧化产生左旋和右旋磷霉素。由于只有左旋体才有生物活性,右旋体全部废弃,整个生产工艺中磷霉素的收率不到20%。因此,化学法生产磷霉素造成了巨大的资源浪费,同时由于化学拆分等试剂的大量使用,产生严重的环境污染问题。实现磷霉素的不对称合成,是降低磷霉素的生产成本、提高产值、减少污染物排放的一项迫切需求。
由磷霉素合成的中间体顺丙烯磷酸出发,利用微生物环氧化得到磷霉素,则是另一种有效的途径。White 等首次发现青霉属Penicillium 等属的一些菌株能将顺丙烯磷酸立体选择性地环氧化成有生物活性的磷霉素[7]。从此以后,几个研究组分别筛选到一些具有转化活力的菌株[7-11],其中石家骥等[10]筛选到的一株青霉属菌株Penicillium sp.F5,当底物浓度为0.3%时,培养6 d,产物浓度达到2.2 mg/mL,转化率为41%,这是到目前为止生物转化产生磷霉素产量最高的报道。
Itoh 等[8]研究了脂香黄杆菌Flavobacterium esteroaromaticum IFO3751菌株的环氧化机制,通过试验,他们提出了一种可能的转化机理,认为顺丙烯磷酸在溴过氧化物酶的作用下,转化成中间物溴代醇,然后在溴代醇环氧化酶的作用下,将溴代醇环氧化成磷霉素。Watanabe 等[11]用蛋白质组学方法,从斜卧青霉 Penicillium decumbens 中找到了一种氧化酶(EpoA),并且克隆出了该酶的基因,将该酶的基因同源克隆到原始菌株中,菌株的转化能力提高了4倍。在本研究中,我们发现B.subtilis 168能将顺丙烯磷酸不对称转化成磷霉素,其遗传背景也比较清楚。因此,以B.subtilis 168为出发菌株,用蛋白质组方法研究其不对称将顺丙烯磷酸转化为磷霉素的机理,对进一步揭示微生物不对称将顺丙烯磷酸转化为磷霉素的机理有很强的启示意义。
1 材料与方法
1.1 材料
1.1.1 菌种
B.subtilis 168购自中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center,CGMCC)。
1.1.2 主要试剂
磷霉素购自中国药品生物鉴定所(National Institute for the Control of Pharmaceutical and Biological Products,NICPBP);左旋、右旋磷霉素和顺丙烯磷酸,购自东北制药总厂;N,O-双(三甲基硅基)乙酰胺(Bis-trimethylsilylacetamide)、BSA 和三甲基氯硅烷(Trimethylchlorosilane,TMCS)购自Merck 公司(Darmstadt,Germany);尿素、3-[(3-cholamidopropyl) dimethylammonio]-1-propanesulfonate (CHAPS)、IPG strips (17 cm),Dithilthreitol (DTT)、Bio-Lyte Carrier Ampholyte(3-10,4-7)和mineral oil 购自Bio-Rad 公司(Hercules,CA,USA);其他所用均为分析纯试剂。
1.1.3 转化培养基(g/L)
葡萄糖,15;胰蛋白胨,10;cPPA,2;MgSO4·7H2O,1.5; Na3VO4·12H2O ,0.1;CoCl2·6H2O,0.5;pH 8.5。
1.2 方法
1.2.1 磷霉素活力的测定
转化产物磷霉素用气相色谱(Gas chromatography,GC)检测,并将结果同标准的左旋磷霉素对比。用于GC 检测的样品按照Xie的方法[12]处理。将100μL 培养后的发酵液用氮气流吹干,加入100μL 硅烷化试剂(47.5μL BSA,47.5μL 二氯甲烷和5μL TMCS),充分混匀,然后放于60℃的水浴中反应15 min,气相色谱中上样1μL。GC 检测的条件是:分流比为20:1,开始柱箱的温度控制在105 3 min℃,然后以0.8℃/min的速率升温,直到115℃,维持5 min。
定量检测磷霉素也是用GC 的方法进行。分别将200 mg、400 mg、600 mg、800 mg 和1000 mg 标准磷霉素,在温箱中烘干至恒重。向各个重量的磷霉素加入1 mL 硅烷化试剂(47.5μL BSA,47.5μL 二氯甲烷和5μL TMCS),充分混匀,置于60℃的水浴中反应15 min。将处理好的样品进行气相色谱分析,上样量为1μL。根据各个磷霉素峰的峰面积和其对应的磷霉素的浓度绘制标准曲线。测发酵液中磷霉素的浓度时,根据磷霉素峰的峰面积和标准曲线推算出磷霉素的浓度。
1.2.2 细胞裂解液的制备
8 mol/L 尿素4.805 g,4%(W/V) CHAPS 0.4 g,65 mmol/L DTT 0.098 g,2%(V/V) Bio-Lyte(3-10)200μL,加MilliQ 水定容至10 mL,分装每管1 mL,−20℃保存。
1.2.3 菌株的培养
将B.substilis 168的单菌落接种于LB 培养基中,摇床培养(30℃,200 r/min)24 h。分别取1 mL 培养液接种于含有顺丙烯磷酸和不含有顺丙烯磷酸的转化培养基中(500 mL 三角瓶,装培养基50 mL;每种培养基接种3瓶作平行样),摇瓶培养48 h (30℃,200 r/min)。
1.2.4 蛋白样品的制备
将发酵液离心(10000 r/min,10 min,4℃),收集细胞,用缓冲液(50 mmol/L Tris-HCl,1 mmol/L EDTA,pH 7.5)洗涤菌体3次。称量湿菌重,每1.5 mL 离心管中装菌体100 mg,然后每管加1 mL 细胞裂解液,10μL 100 mmol/L苯甲基磺酰氟(Phenylmethanesulfonyl fluoride,PMSF),混匀后,在冰浴条件下采用超声破碎仪进行细胞破碎。在细胞破碎液中加入DNaseⅠ(终浓度为15μg/mL)和RNase A (终浓度为15μg/mL),4℃反应60 min 以除去其中的核酸。4℃、20000×g 离心15 min,收集上清蛋白溶液。
1.2.5 蛋白质浓度测定
根据Bradford 方法[13],对蛋白质溶液的浓度进行定量测定。
1.2.6 双向凝胶电泳
等电聚焦电泳:双向电泳主要参考Görg A等提出的方法[14]及Bio-Rad 仪器操作手册进行,重复3次。蛋白上样量为300μg,与上样缓冲液充分混合,总体积均为350μL。干胶条水化和聚焦在20℃条件下进行。50 V 主动水化12 h后进行等电聚焦,设置等电聚焦的程序达到65 kVh。等电聚焦结束后,取出胶条,准备进行第二向电泳。
第二向SDS-PAGE:用湿的滤纸将等电聚焦后的胶条上的矿物油吸干。将胶条转移至水化盘中。每根胶条中加入6 mL 胶条平衡缓冲液Ⅰ(6 mol/L 尿素,2.5% SDS,50 mmol/L Tris-HCl,pH 8.8,30%甘油,1% DTT,0.002%溴酚蓝),在水平摇床上缓慢摇动,平衡15 min。第一次平衡结束后,倒掉平衡缓冲液Ⅰ,用MilliQ 水冲洗胶条背面。再加入6 mL 胶条平衡缓冲液Ⅱ(将平衡缓冲液Ⅰ中的1% DTT 替换成4%碘乙酰胺),继续在水平摇床上缓慢平衡15 min。将平衡好的胶条转移至proteanⅡ xi cell 垂直电泳槽中进行SDS-PAGE,垂直电泳分离胶的浓度为12.5%。在电泳槽中加入1×电泳缓冲液后,接通电源,起始时用20 mA/gel 的低电流电泳30 min,使样品完全走出IPG 胶条,并浓缩成一条线。然后加大电流至30 mA/gel,直到溴酚蓝指示剂达到底部边缘时即可停止电泳。取出凝胶,进行考马斯亮蓝G-250染色。
1.2.7 图像采集和分析
将凝胶小心地放置在UMAX Powerlook 1120扫描仪上,以600 dpi 的分辨率,合适的对比度和清晰度,对胶图进行扫描。用ImageMasterTM2D Platinum 6.0(GE Healthcare,USA)软件对蛋白图像进行分析。通过设置参数(Smooth 3,Min Area 50,Saliency 3.0),检测胶图上的蛋白点,每个胶点的体积通过与一块胶内所检测到的所有蛋白点总体积的比值再乘以100进行标准化(Normalization)。用同样的方法处理每张胶图。通过选定若干个蛋白点作为Landmark,以定义的Landmark 为坐标,将不同培养条件下培养的菌体胶图之间的蛋白点作匹配(Matching),通过对3次重复的胶图进行比对后,进行统计学分析。蛋白点标准化体积(vol %)的变化在2倍以上为差异显著。
1.2.8 差异蛋白点的胶内酶解
用刀片从凝胶上挖取差异蛋白点,置于Eppendorf 管中,并记录点号和相应的位置。加入200μL 脱色液(100 mmol/L NH4HCO3/50%乙腈),置于30℃摇床中振荡脱色,中间换1~2次脱色液,直至蓝色完全褪去。用去离子水洗蛋白点3次。加10 mmol/L DTT (10μL 1 mol/L DTT 加990μL 25 mmol/L NH4HCO3)50μL,56℃反应1 h。冷却到室温后,吸干,快速加55 mmol/L 碘乙酰胺(55μL 1 mol/L 碘乙酰胺加945μL 25 mmol/L NH4HCO3)50μL,放置在黑暗中反应45 min。用去离子水洗蛋白点3次。用真空离心浓缩仪将胶颗粒彻底抽干。加入25µg/µL的测序级胰蛋白酶(Promega 公司产品,按说明书配制)3~10µL (酶量的多少视蛋白多少而改变),在4℃放置1 h,使胶颗粒充分溶胀。待溶液被胶颗粒完全吸收,加适量25 mmol/L NH4HCO3覆盖胶颗粒,酶解消化过夜(12~15 h)。加入1%三氟乙酸终止反应,使三氟乙酸终浓度为0.1%,将液体取出放入干净的Eppendorf管(可能含有超过70%的肽片段),加入5%三氟乙酸/50%乙腈100µL,37℃保温1 h,将提取液放入装有含肽覆盖液的Eppendorf 管中。将肽提取液用Speed Vac 彻底抽干,用于质谱分析。
1.2.9 MALDI-TOF/TOF 质谱分析
加入3μL 的matrix 基质溶液(10 mg/mL α-氰基-4-羟基肉桂酸,50%乙腈)到装抽干的肽提取物的管子中,充分混合,然后取1μL 点到anchorchip 上,室温干燥。然后在质谱仪(4700Proteomics Analyzer,Applied Biosystems,Foster City,CA 94404,U.S.A)上进行一级质谱或二级质谱(MS,MS/MS)分析。
1.2.10 蛋白质鉴定
获得了一级质谱(Peptide Mass Fingerprint,PMF)和二级质谱(MS/MS)的结果后,利用MASCOT 软件将质谱结果在NCBInr database 数据库(http://www.matrixscience.com)中进行蛋白质同源查询,获取差异表达的蛋白质信息。
2 结果
2.1 B.subtilis 168不对称将顺丙烯磷酸转化成磷霉素
将B.subtilis 168接种到转化培养基中,摇床培养2 d,用GC 法测磷霉素的活性(图2),发现发酵液的上清液中有816.6μg/mL 的磷霉素,转化率为36.05%。这说明B.subtilis 168能不对称将顺丙烯磷酸转化成磷霉素,是研究转化机理的理想材料。
2.2 蛋白质差异表达的图谱分析
用含有底物顺丙烯磷酸培养的菌体和不含底物的培养基培养的菌体蛋白提取液分别用pH 4~7胶条进行等电聚焦,然后经过SDS-PAGE分离,每种培养条件重复做3次,得到6块2-DE图谱。结果发现3次重复试验得到的2-DE 图谱的重复性非常高,这就说明这6块2-DE 图谱能真实反映细胞体内参与环氧化反应和其他代谢的蛋白状态。用ImageMaster 软件对这些胶图进行统计分析,结果发现有底物和没有底物的两个样品的胶图在蛋白点的分布、表达数目和表达量方面差异点非常明显。当B.subtilis 168在没有底物时,在pH 4~7的范围内检测到527个蛋白点;在有底物时,检测到562个蛋白点。
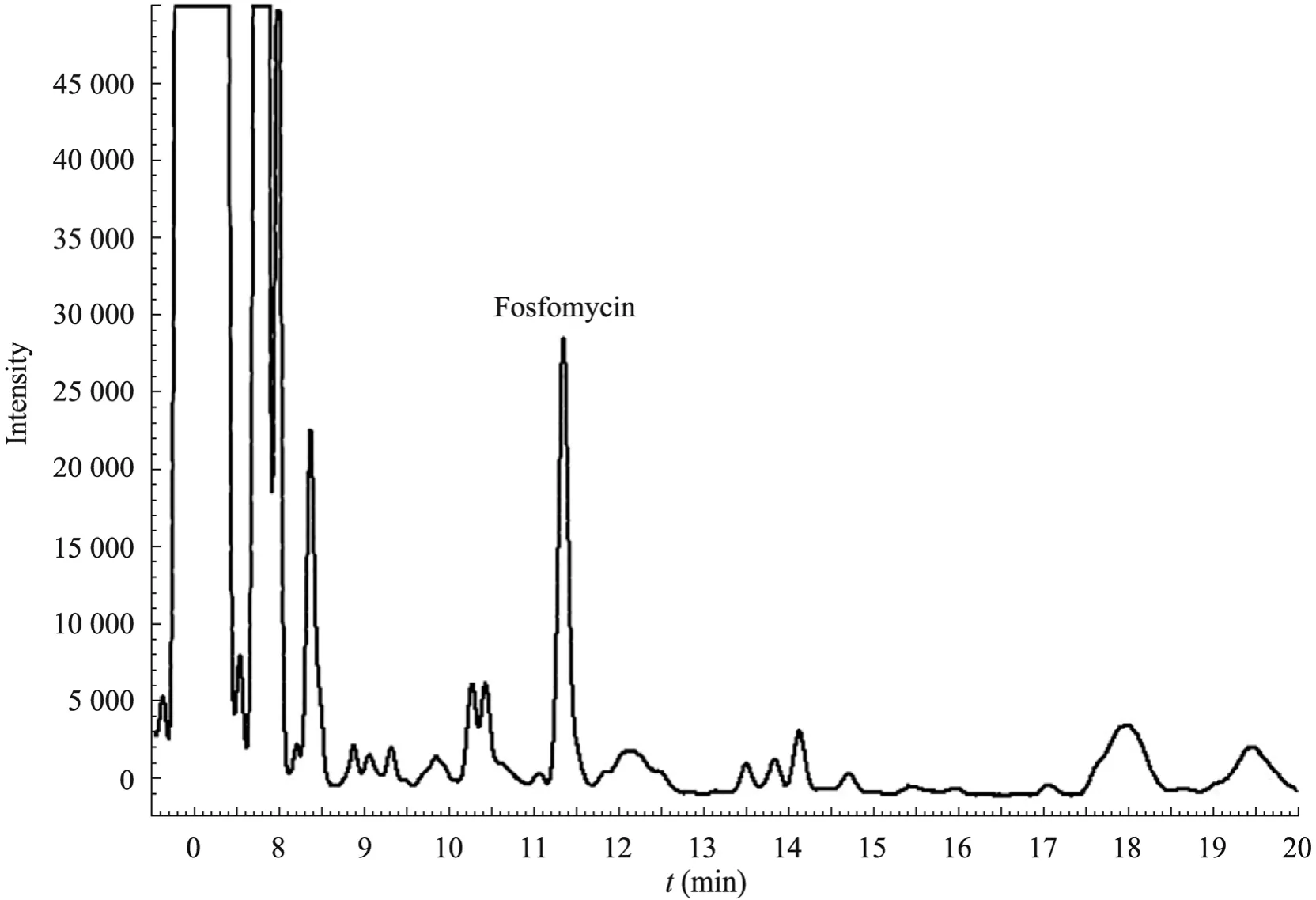
图2 B.subtilis 168将顺丙烯磷酸转化成磷霉素Fig.2 Transformation of cis-propenylphosphonic acid to fosfomycin by B.subtilis strain 168.
将有底物的2-DE 图谱和没有底物的2-DE图谱进行比较。我们规定,差异值大于2的为差异表达蛋白。结果发现有98个差异表达蛋白(图3)。其中在有底物存在时,表达量下调的点有20个,表达量上调的点52个,底物特异性表达的点有26个。
2.3 差异表达蛋白的质谱鉴定结果
将差异表达的蛋白点从2-DE 胶上切下来,进行胶内酶解。用4700 Proteomics Analyzer 质谱仪对酶解肽段进行MALDI-TOF 质谱分析,获得的肽指纹图谱用MASCOT 软件检索NCBInr 数据库。经过肽指纹图谱未能够得到鉴定的蛋白点,继续进行了MALDI-TOF/TOF 二级质谱测定。
经质谱鉴定,共鉴定到80个差异表达蛋白点(表1),其中鉴定出上调的点45个,下调的点17个,顺丙烯磷酸诱导表达的特异性蛋白点18个。按照蛋白功能进行分类,这些蛋白分别参与胞内的不同代谢过程。其中10个参与对抗胁迫反应,11个蛋白参与合成胞内酶促反应的辅助因子,3个蛋白点与氧化还原反应有关,5个蛋白与物质转运有关,5个点与核苷酸代谢有关,20个蛋白点参与糖代谢,16个点参与氨基酸和蛋白质的代谢,10个点参与其他的代谢途径。没有鉴定出来的蛋白点有18个。
2.3.1 底物顺丙烯磷酸所引起的胁迫反应
顺丙烯磷酸对菌株B.subtilis 168来说是一种异源物质,当该菌株在含有顺丙烯磷酸的培养基中生长时无疑会诱导大量的胁迫反应蛋白的产生。这些胁迫蛋白分为热胁迫蛋白和氧化胁迫蛋白。热胁迫蛋白包括:60 kDa chaperonin、Chaperone protein dnaK、Trigger factor 和Stress response protein SCP2。氧化胁迫蛋白包括:Superoxide dismutase 、 Thiazole biosynthesis protein thiG、Alkyl hydroperoxide reductase 和Pyridoxal biosynthesis lyase pdxS。但有趣的是,在有底物存在时,胁迫反应蛋白 Chaperonin GroEL 和NH3-dependent NAD+synthetase 的表达量却下降了,这种表达量的变化的原因尚不清楚。菌株能在顺丙烯磷酸和生成的抗生素磷霉素的发酵液中生长,可能与这些胁迫蛋白的差异表达有关。
2.3.2 顺丙烯磷酸对转运蛋白表达的影响
当菌株B.subtilis 168在含有顺丙烯磷酸的培养基中生长时,其ABC 转运系统的组分都上调表达,如Oligopeptide ABC transporter (Binding protein)总共上调表达9.79倍,这意味着顺丙烯磷酸向胞内转运和新生成的磷霉素的向胞外转运可能都依靠ABC 转运系统完成。
2.3.3 糖代谢蛋白的差异表达
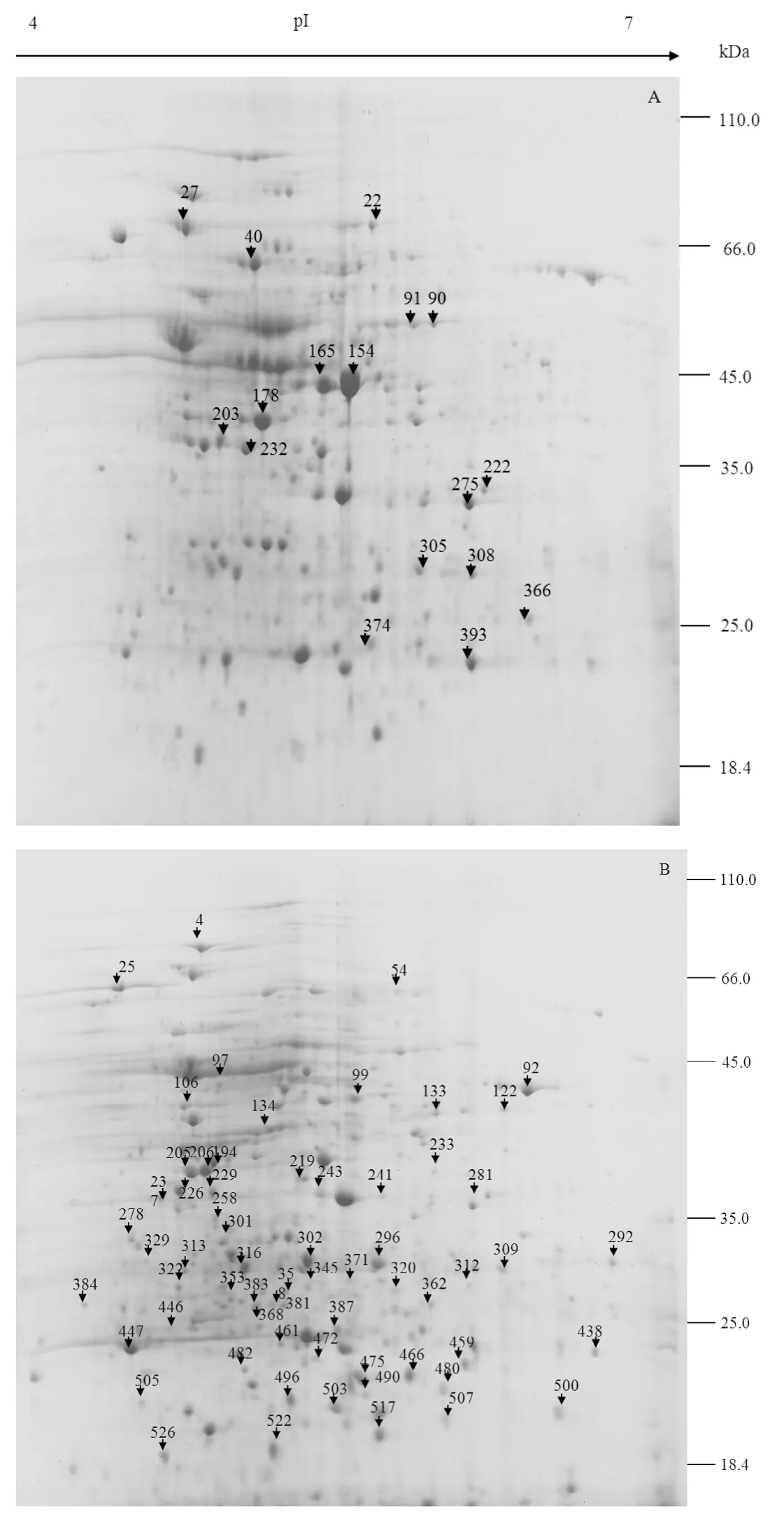
图3 B.subtilis 168在无底物的培养基(A)和有底物的培养基(B)中培养后细胞质中的可溶性蛋白双向电泳图谱分析Fig.3 2-DE gels of total cytoplasmic proteins of B.subtilis strain 168 in transformation medium without substrate cis-propenylphosphonic acid (A) and with substrate cis-propenylphosphonic acid (B) in the pH 4−7 range.The numbers present in (A) indicate the down-regulated proteins,while the numbers present in (B) indicate the proteins that are up-regulated and those induced by the substrate.

表1 B.subtilis 168在不同培养基(含有顺丙烯磷酸和不含顺丙烯磷酸)中生长时差异蛋白点的鉴定Table 1 Identified proteins from B.subtilis strain 168 cells grown in the presence of cis-propenylphosphonic acid in the medium and in the absence of cis-propenylphosphonic acid in the medium
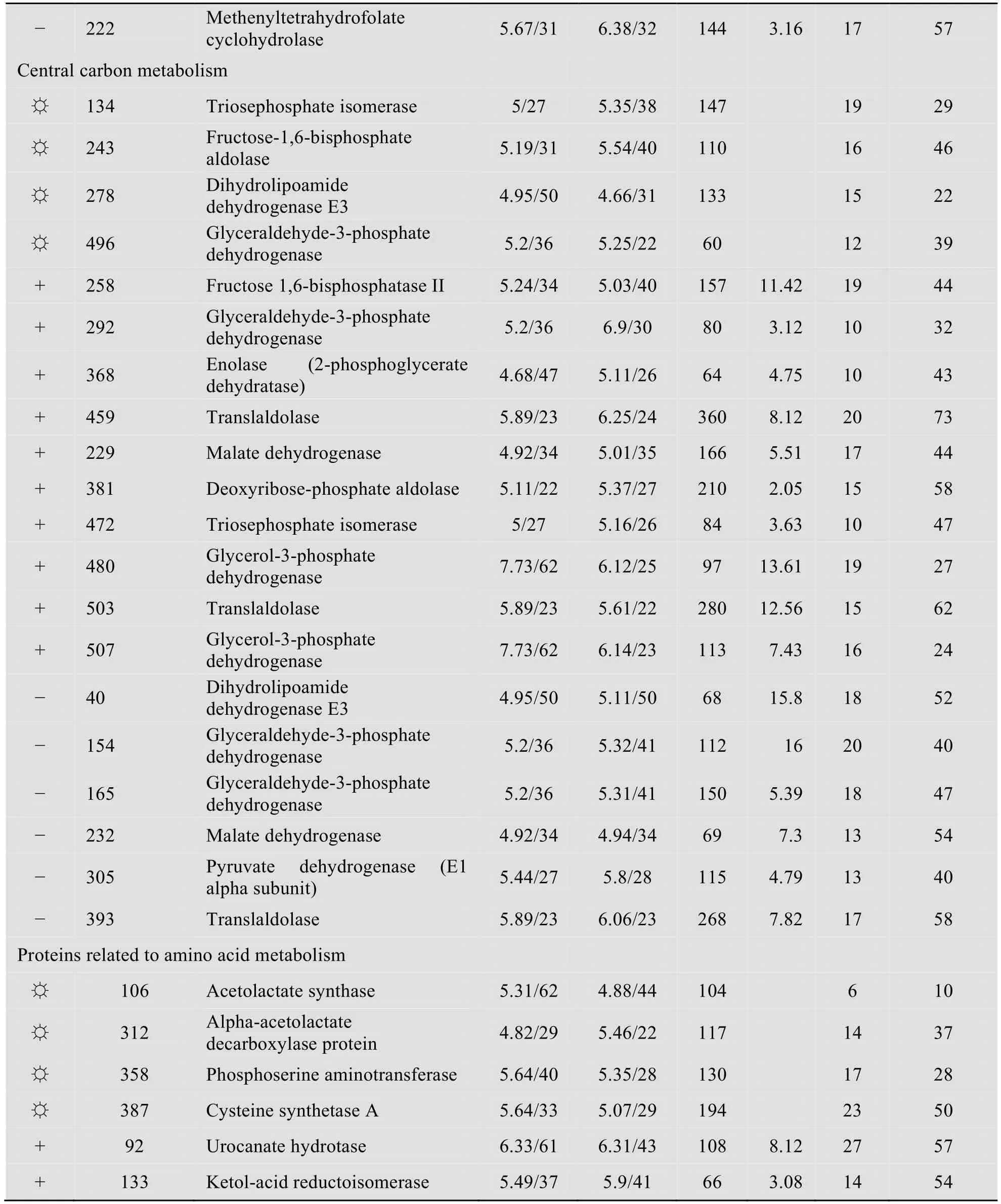
续表1
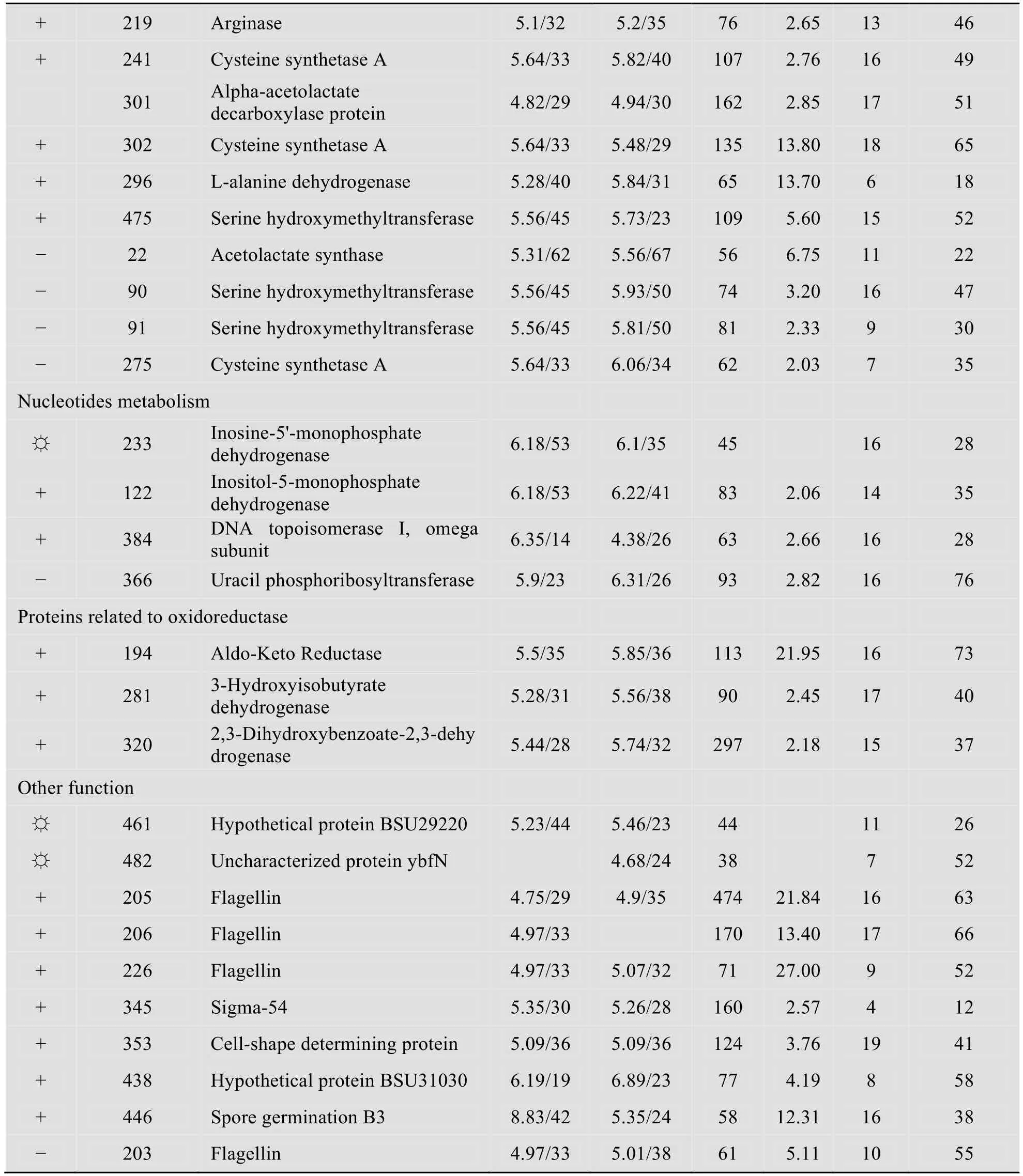
续表1
这类差异表达的蛋白几乎涉及到了糖代谢所有的途径。包括糖酵解途径,如磷酸甘油醛异构酶(Triosephosphate isomerase)、3-磷酸甘油醛脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase)、果糖二磷酸醛缩酶(Fructose-1,6-bisphosphate aldolase)等;参与磷酸戊糖途径的酶包括转醛酶(Translaldolase)和脱氧核糖磷酸醛缩酶(Deoxyribose-phosphate aldolase),其中后者上调表达2.05倍,该酶将脱氧核糖磷酸转化成3-磷酸甘油醛和乙醛,3-磷酸甘油醛进入糖酵解途径;参与三羧酸循环途径的酶包括二氢硫辛酰胺脱氢酶E3(Dihydrolipoamide dehydrogenase E3)、苹果酸脱氢酶(Malate dehydrogenase);参与糖异生途径的酶包括1,6二磷酸果糖酶Ⅱ(Fructose 1,6-bisphosphataseⅡ)等。其中,在培养基中有底物存在时,3-磷酸甘油醛脱氢酶的表达量下调了21.39倍。在差异表达的糖代谢蛋白中,参与甘油代谢的关键酶都上调表达,如3-磷酸甘油脱氢酶(Glycerol-3-phosphate dehydrogenase)上调表达量达21.04倍,2-磷酸甘油酸脱氢酶(Enolase,2-phosphoglycerate dehydratase)上调表达4.75倍。在底物顺丙烯磷酸的诱导下,与糖代谢相关的酶的差异表达多样、复杂。这一方面说明与糖有关的代谢很活跃,另一方面,底物顺丙烯磷酸分子是一个三碳骨架分子,其进入菌体细胞以后,一部分会被转化成磷霉素,而另一部分可能在与糖代谢有关的酶的作用下进入糖代谢。
2.3.4 参与氨基酸代谢的差异表达
检测到很多参与氨基酸和蛋白代谢的差异表达的酶。菌株B.subtilis 168在有底物顺丙烯磷酸的培养基中生长时,诱导表达乙酰乳酸合成酶(Acetolactate synthase)、α-乙酰乳酸脱羧酶(Alpha-acetolactate decarboxylase)、磷酸丝氨酸转氨酶(Phosphoserine aminotransferase)、半胱氨酸合成酶A (Cysteine synthetase A)等,同时,尿刊酸水合酶(Urocanate hydrotase)、酮醇酸还原异构酶(Ketol-acid reductoisomerase)、精氨酸酶(Arginase)、半胱氨酸合成酶A、α-乙酰乳酸脱羧酶和L-丙氨酸脱氢酶(L-alanine dehydrogenase)等酶上调表达。其中变化最大的是半胱氨酸合成酶A,它的表达水平上调了14.53倍以上;磷酸丝氨酸转氨酶是丝氨酸合成途径中的一个关键酶,它的上调表达意味着胞内丝氨酸水平的上升;丙氨酸脱氢酶的表达量上调了6倍,该酶涉及到丙氨酸的降解。总的来看,这些参与氨基酸代谢的酶表达量的变化量最大的几种是涉及到三碳骨架的氨基酸的代谢,而底物顺丙烯磷酸和产物磷霉素也都是三碳结构分子,因此,它们的转化与代谢可能与这些酶的表达水平有关。
2.3.5 顺丙烯磷酸对核苷酸代谢的影响
当菌株B.subtilis 168在有底物顺丙烯磷酸的培养基中生长时,次黄嘌呤核苷酸脱氢酶(Inosine-5'-monophosphate dehydrogenase)和DNA 拓扑异构酶Ⅰ(DNA topoisomeraseⅠ)上调表达。DNA 拓扑异构酶Ⅰ的上调表达可能是在底物顺丙烯磷酸和一定浓度的产物磷霉素存在的条件下菌体形成的一种胁迫反应。
2.3.6 顺丙烯磷酸对辅酶合成的影响
在底物顺丙烯磷酸的诱导下,参与合成很多辅酶合成的酶的表达量都发生了很大的变化。如双功能核黄素激酶(Bifunctional riboflavin kinase)的表达量上调了13.21倍,该酶催化将核黄素和ATP 转化成FMN,FMN 是很多酶的辅酶,参与很多代谢过程。磷酸甲基嘧啶激酶(Phosphomethylpyrimidine kinase)表达量上调,该激酶将硫胺素(Thiamine)磷酸化,形成硫胺素焦磷酸(TPP),它是涉及到糖代谢中羰基碳(醛和酮)合成与裂解反应的辅酶,如α-酮酸的脱羧和α-羟酮的形成与裂解都依赖于硫胺素焦磷酸。此外,核黄素合成酶(Riboflavin biosynthesis protein)的表达量上调7.9倍;1-吡咯啉-5-羧酸脱氢酶(1-Pyrroline-5-carboxylate dehydrogenase)的表达量上调。
2.3.7 参与氧化反应的酶的表达量的变化情况
在底物顺丙烯磷酸的诱导下,参与异源物质氧化还原反应的酶的表达量发生了很大的变化。其中3-羟基异丁酸脱氢酶(Hydroxyisobutyrate dehydrogenase)的表达量上调了2.45倍;2,3-二羟基苯甲酸脱氢酶(2,3-Dihydroxybenzoate-2,3-dehydrogenase)的表达量上调了2.18倍;Aldo-Keto Reductase酶的表达量上调了21.95倍,这是一种能催化很多的不同底物发生氧化还原反应的酶。
2.3.8 顺丙烯磷酸对其他功能的酶和蛋白的影响
由于底物顺丙烯磷酸的存在,诱导了参与一些决定细胞形态和其他功能蛋白的差异表达。包括鞭毛蛋白(Flagellin)、转录因子sigma-54、决定细胞形态的蛋白(Cell-shape determining protein)、芽胞萌发蛋白(Spore germination B3)等。
2.3.9 顺丙烯磷酸诱导的蛋白翻译后修饰情况
当菌株B.subtilis 168在有底物顺丙烯磷酸的培养基中生长时,有11个蛋白在2-DE 图谱上表现出两个以上的点,它们分别是蛋白点309和383所代表的 Oligopeptide ABC transporter(Binding protein),99和308代表的Phosphomethylpyrimidine kinase,466和500代表的Bifunctional riboflavin kinase,154和165代表的 Glyceraldehyde-3-phosphate dehydrogenase,393和503所代表的Translaldolase,229和232代表的Malate dehydrogenase,241和387所代表的Cysteine synthetase A,301和312代表的Alpha-acetolactate decarboxylase,90和91代表的Serine hydroxymethyltransferase,122和233代表的Inosine-5'-monophosphate dehydrogenase,206和226代表的Flagellin。虽然它们在双向电泳图谱上的位置明显不同,但质谱结果显示它们为相同的蛋白。这种现象在许多已经报道的双向电泳过程中经常出现[15-16]。产生这种现象的原因可能有以下几种:由于蛋白质翻译后的修饰作用所引起的蛋白质等电点的变化;尿素引起的蛋白质氨甲酰化作用;蛋白质中的谷氨酰胺和天冬酰胺的脱氨基作用,引起蛋白质等电点的偏移;蛋白的断裂、降解、糖基化、甲基化、乙酰基化等因素会导致蛋白的分子量的变化。这些变化导致一种蛋白可能出现多个蛋白点。
3 讨论
B.subtilis 168的基因组已经测序[17],对该菌株的生理生化背景已经研究得非常清楚了,同时该菌株能将顺丙烯磷酸不对称地环氧化成磷霉素,因此将该菌株作为出发菌株,用蛋白质组学方法研究顺丙烯磷酸不对称环氧化成磷霉素的转化机理和转化步骤是可行的。
在本研究中,我们通过蛋白质组学的方法,分析和揭示了B.subtilis 168在有底物顺丙烯磷酸的培养基中生长时,细胞内代谢过程发生的变化。结果显示,在菌株将顺丙烯磷酸转化成磷霉素的同时,胞内很多的代谢过程都发生了变化,包括糖代谢、氨基酸代谢、核苷酸代谢等,这说明顺丙烯磷酸转化成磷霉素的途径和其他的代谢途径是相互联系的,它们之间形成一个很大的代谢网络。
B.subtilis 168在没有底物和有底物的培养基中生长后,菌体蛋白的2-DE 图谱差异很大。分析原因,一方面是由于在底物顺丙烯磷酸的诱导下,很多蛋白的表达量发生了很大的变化,有的上调了,有的下调了,同时产生了很多底物诱导的特异表达的蛋白;另一方面,当培养基中含有底物时,很多蛋白发生了翻译后修饰,经过修饰后的蛋白所带的电荷数和分子量都可能发生变化,导致了它的电泳行为也发生变化,因此在试验中的很多蛋白同时有几个点。这对蛋白质组的分析带来了很大的干扰,对分析形成了很大的困难。
顺丙烯磷酸对B.subtilis 168来说是一种异源物质,当菌株在含有顺丙烯磷酸的培养基中生长时,一方面会诱导或上调代谢顺丙烯磷酸的酶或蛋白,另一方面会产生保护自身细胞的机制。在本实验中,我们发现顺丙烯磷酸诱导表达和上调表达很多热激蛋白,这种异源物质诱导产生热激蛋白的现象在微生物中是非常普遍的。热激蛋白分为6个不同的家族:Hsp100s、Hsp90s、Hsp70s、Hsp60s、Hsp40s 和small Hsps[18],它们是分子伴侣系统的组成成分,每个家族的热激蛋白都有许多的生理功能,如可以帮助蛋白复性,降解和修复受损蛋白,阻止由于胁迫反应所引起的蛋白质聚集,确保膜蛋白的正确定位以及控制蛋白之间的相互作用等[19-21]。当B.subtilis 168的细胞在含有顺丙烯磷酸的培养基中生长时,大量热激蛋白的诱导表达有利于维持胞内酶的正常活性,抵抗顺丙烯磷酸和磷霉素所引起的胁迫。在将顺丙烯磷酸氧化成磷霉素的过程中,肯定会产生副产物活性氧(Reactive oxygen species,ROS),如过氧化物离子和过氧化氢,这些物质都会损伤细胞[22]。超氧化物歧化酶、碱性过氧化氢还原酶AhpC 等都会修复由活性氧产生的损伤。此外,对B.subtilis 来说,还普遍存在另外一种修复机制,那就是将酶蛋白的半胱氨酸巯基化,这样可以防止含有半胱氨酸的酶由于半胱氨酸残基的氧化而失活[23-25]。
到目前为止,文献中关于用微生物转化的方法将顺丙烯磷酸转化成磷霉素的报道非常少,关于其转化机理的研究也很有限。在本研究中,在用蛋白质组学的方法研究B.subtilis 168菌株将顺丙烯磷酸氧化成磷霉素的过程中,我们开始希望从胞内蛋白中找到与转化相关的氧化酶,但如结果所示,没有氧化酶诱导表达或上调表达,也没有溴过氧化物酶和溴代醇环氧化酶的诱导表达。这说明,在不同的微生物中,将顺丙烯磷酸氧化成磷霉素的过程和机理是不一样的。对B.subtilis 168的蛋白质组学的研究中,在有底物顺丙烯磷酸时,我们发现了一种水合酶,那就是92号蛋白点代表的尿刊酸水合酶的表达量上调了8.12倍,推测它在催化组氨酸代谢的同时,还可能催化一个水分子加成到一分子的底物顺丙烯磷酸上,形成丙醇磷酸;在底物顺丙烯磷酸的诱导下,有很多脱氢酶上调表达,在这些脱氢酶中,281号蛋白点3-羟基异丁醇脱氢酶作用底物与丙醇磷酸的结构相近,推测在3-羟基异丁醇脱氢酶的作用下,丙醇磷酸发生脱氢作用,环氧化成磷霉素。因此,结合转化的特点和蛋白质组学结果,我们认为,转化分两步进行,第一步,在一种水合酶的作用下,顺丙烯磷酸被转化成丙醇磷酸;第二步,在脱氢酶的催化下,丙醇磷酸被脱氢,环氧化成磷霉素(图4)。我们下一步的工作将对这两种酶的基因进行克隆和过表达,以验证上述转化机理的推论。
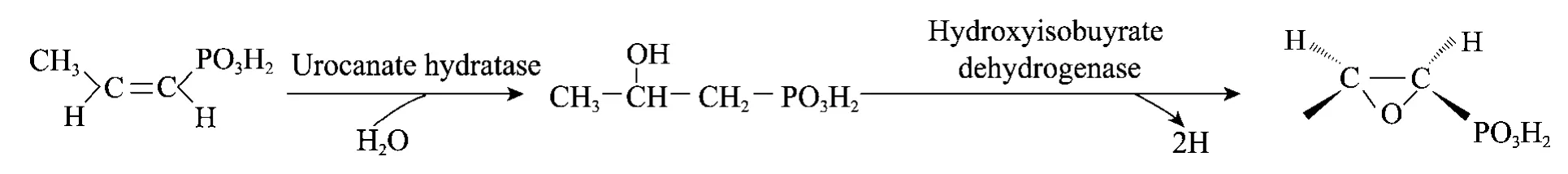
图4 B.subtilis 168将顺丙烯磷酸转化成磷霉素的可能机制Fig.4 Hypothesized mechanism of transformation of cis-propenylphosphonic acid to fosfomycin.
[1]Hendlin D,Stapley EO,Jackson M,et al.Phosphonomycin,a new antibiotic produced by strains of Streptomyces.Science,1969,166(3901):122−123.
[2]Shoji J,Kato T,Hinoo H,et al.Production of fosfomycin (phosphonomycin) by Pseudomonas syringae.J Antibiot,1986,39(7):1011−1012.
[3]Ribes S,Taberner F,Domenech A,et al.Evaluation of fosfomycin alone and in combination with ceftriaxone or vancomycin in an experimental model of meningitis caused by two strains of cephalosporin-resistant Streptococcus pneumoniae.J Antimicrob Chemother,2006,57(5):931−936.
[4]Apisarnthanarak A,Mundy LM.Successful treatment of disseminated methicillin-resistant Staphylococcus aureus with fosfomycin,cefoperazone/sulbactam and rifampin followed by fusidic acid and rifampin.Int J Infect Dis,2007,11(3):283−284.
[5]Higgins LJ,Yan F,Liu PH,et al.Structural insight into antibiotic fosfomycin biosynthesis by a mononuclear iron enzyme.Nature,2005,437(7060):838−844.
[6]Cilli F,Pullukcu H,Aydemir S,et al.In vitro activity of fosfomycin tromethamine and linezolid against vancomycin-resistant Enterococcus faecium isolates.Int J Antimicrob Agents,2008,31(3):296−298.
[7]White RF,Birnbaum J,Meyer RT,et al.Microbial epoxidation of cis-propenylphosphonic to(-)-cis-1,2-epoxypropylphosphonic acid.Appl Microbiol,1971,22(1):55−66.
[8]Itoh N,Kusaka M,Hirota T,et al.Microbial production of antibiotic fosfomycin by a stereoselective epoxidation and its formation mechanism.Appl Microbiol Biotechnol,1995,43(3):394−401.
[9]Aisaka K,Ohshiro T,Uwajima T.Optimum culture conditions for the epoxidation of cis-propenylphosphonate to fosfomycin by cellvibrio gilvus.Appl Microbiol Biotechnol,1992,36(4):431−435.
[10]Shi JJ,Cui FM,Ge M.the epoxidation of cis-propenylphosphonic acid to fosfomycin by Penicilliium sp..Acta Microbiol Sin,2001,41:353−356(in Chinese).石家骥,崔福绵,葛猛.青霉菌立体选择性环氧化顺丙烯磷酸产生磷霉素.微生物学报,2001,41:353−356.
[11]Watanabe M,Sumida N,Murakami S,et al.A phosphonate-induced gene which promotes Penicillium-mediate bioconversion of cis-propenylphosphonic acid to fosfomycin.Appl Environ Microbiol,1999,65(3):1036−1044.
[12]Xie F,Chao Y,Xue Z,et al.Stereoselective epoxidation of cis-propenylphosphonic acid to fosfomycin by a newly isolated bacterium Bacillus simplex strain S101.J Ind Microbiol Biotechnol,2009,36(5):739−746.
[13]Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal Biochem,1976,72:248−254.
[14]Gorg A,Obermaier C,Boguth G,et al.The current state of two-dimensional electrophoresis with immobilized pH gradients.Electrophoresis,2000,21(6):1037−1053.
[15]Büttner K,Bernhardt J,Scharf C,et al.A comprehensive two-dimensional map of cytosolic proteins of Bacillus subtilis.Electrophoresis 2001,22:2908−2935.
[16]Eymann C,Dreisbach A,Albrecht D,et al.A comprehensive proteome map of growing Bacillus subtilis cells.Proteomics,2004,4:2849−2876.
[17]Kunst F,Ogasawara N,Moszer I,et al.The complete genome sequence of the gram-positive bacterium Bacillus subtilis.Nature,1997,390:249−256.
[18]Morimoto R,Tissieres A,Georgopoulos C,et al.Progress and Perspectives on the Biology of Heat Shock Proteins and Molecular Chaperones.New York:Cold Spring Harbor Laboratory Press,1994.
[19]Ellis RJ,Hemmingsen SM.Molecular chaperones:proteins essential for the biogenesis of somemacromolecular structures.Trends Biochem Sci,1989,14:339−342.
[20]Hendrick JP,Hartl FU.Molecular chaperone functions of heat-shock proteins.Annu Rev Biochem,1993,62:349−384.
[21]Thirumalai D,Lorimer GH.Chaperonin-mediated protein folding.Annu Rev Biophys Biomol Struct,2001,30:245−269.
[22]Godon C,Lagniel G,Lee J,et al.The H2O2stimulon in Saccharomyces cerevisiae.J Biol Chem,1998,273:22480−22489.
[23]Hochgrafe F,Mostertz J,Pother D-C,et al.S-Cysteinylation is a general mechanism for thiol protection of Bacillus subtilis proteins after oxidative stress.J Biol Chem,2007,282(36):25981−25985.
[24]Das KC,White CW.Redox systems of the cell:possible links and implications.Proc Natl Acad Sci USA,2002,99:9617−9618.
[25]Michelet L,Zaffagnini M,Marchand C,et al.Glutathionylation of chloroplast thioredoxin f is a redox signaling mechanism in plants.Proc Natl Acad Sci USA,2005,102:16478−16483.
