含自杀基因回路的大肠杆菌的生长和变异规律
2013-06-30高祺郑雪松
高祺,郑雪松
上海应用技术学院香料香精技术与工程学院,上海 201418
合成生物学中核心元件(如基因线路、酶、代谢途径等)的标准化以及合理组装方式,是建立具有可预测性和调控性的代谢途径,构建具有特定功能的新生物体必不可少的基础性工作[1-7]。近几年来已经设计了多种基因控制模块,包括开关[8-11]、脉冲发生器[12-13]、振荡器[14-17]等,这些模块化的生物部件可以有效调节基因表达、蛋白质功能、细胞代谢或细胞间相互作用。
群体感应(Quorum sensing)是细胞间通讯的重要方式。它是指单个细胞通过一种自身合成的自诱导剂分子(Autoinducer)的富集来感知菌群密度的现象。当自诱导剂的浓度随着细菌密度的增加达到特定阈值时,某些基因像开关一样被打开,启动后续一系列基因的表达。基于群体感应的基因回路能够实现细胞行为的同步化,因此在合成生物学研究中被大量使用[18-21]。
基于群体感应的自杀基因回路能赋予宿主菌在一定密度时启动自杀的特性。在连续培养条件下可以形成菌群密度的周期振荡。这样的振荡作为基因组件,在合成生物学上有重要用途。美国杜克大学的You 等建立起了自杀菌群模型并对其振荡规律进行了初步的研究[22-23],其建立的基因回路反映在质粒pPopctrl 上,如图1所示。
该基因回路所利用的群体感应原理是AHL-LuxR 这一对自诱导剂-转录因子分子。在图中,由luxI 基因编码的酶催化合成一种高丝氨酸内酯分子(Acyl-homoserine lactone,AHL),它可以在细胞内外自由扩散。随细胞密度增加,AHL 浓度也将随之上升,达到一定阈值时与luxR基因编码的R 蛋白结合,生成活化R 蛋白——R*。作为转录因子的R*可启动Plux启动子的转录,使CcdB 蛋白得以表达,CcdB 抑制DNA 复制,从而杀死细胞。图中的luxR 和luxI 基因都在lac启动子的控制之下,可以被IPTG 诱导。
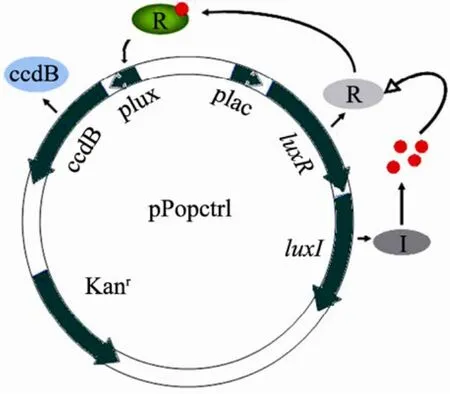
图1 pPopctrl 质粒结构示意图Fig.1 Structure of plasmid pPopctrl.
可以预见的是,在这一自杀回路的运行过程中,特别是自杀行为启动以后,由于基因突变能逃避自杀的变异个体会很快出现,这将破坏基因回路的连续稳定运行,振荡信号将随之迅速衰减。
文中以 pPopctrl 质粒转化的大肠杆菌top10F’为研究对象,以不同浓度的IPTG 诱导,观察宿主菌的生长和自杀特征以及在自杀过程中突变菌产生的规律,并通过基因测序确定变异位点。结果将为抑制突变个体产生,构建更具鲁棒性(Robustness)的自杀基因回路提供思路。
1 材料与方法
1.1 质粒、菌株和试剂
质粒pPopctrl 由美国Duke 大学Lingchong You 博士惠赠。宿主大肠杆菌Top10F’菌株由本实验室保藏。按照上海捷瑞生物技术有限公司的一步法质粒转化试剂盒说明操作,构建工程菌(此菌株即为本文所说的野生型菌株wild type)。
试剂:胰蛋白胨购自美国BD 公司;MOPS(Free acid 3-(N-吗啡啉)丙磺酸,BBI)、硫酸镁、氯化钠、IPTG、Kanamycin、LB 培养基、LB 琼脂培养基、矿物油、琼脂糖、溴化乙锭均购自上海生工生物工程有限公司。质粒小量提取试剂盒(离心柱型)购自上海捷瑞公司,质粒全测序和测序引物合成委托上海迈浦生物科技有限公司。
1.2 细菌扩大培养
从甘油冻存管中刮取含有pPopctrl 质粒的top10F’菌株,接种于 LB (含50μg/mL 的Kanamycin)培养基中,37℃、200 r/min 振荡培养过夜,倍比稀释后涂布LB 平板,37℃温育24 h,用接种环挑取单菌落接种于5 mL LB (含50μg/mL 的Kanamycin)培养基中,37℃、200 r/min 振荡培养15 h,作为实验接种液。
1.3 细菌的生长特征监测和生长-自杀曲线的绘制
细菌的自杀实验在TBK 培养基中进行。TBK培养基组成为:10 g/L 胰蛋白胨(BD 公司)、7 g/L氯化钾、20.93 g /L MOPS 缓冲盐,用5 mol/L 氢氧化钾溶液调节pH 至6.0,灭菌后备用。将9μL接种液分别接种于9 mL TBK 培养基(含50μg/mL 的Kanamycin)中,培养基中IPTG 浓度分别为0.01、0.05、0.08、0.1、1 mmol/L,并以不加IPTG 的培养基作为对照。30℃、250 r/min振荡培养,间隔1.5~2 h 取样200μL 于96孔板中先后测定OD600和CFU,绘制生长-时间曲线。
OD600测定使用 Perkin-Elmer Multi-label Plate Reader V3。
1.4 突变菌株的筛选和鉴别
为了鉴别不同时间点样品中的野生型和突变型,利用二者生长曲线的不同加以区分。具体做法是:培养过程中不同时间点取样,倍比稀释涂布90 mm LB 平板,培养后从中随机挑取30个单菌落,接种于96孔板中,每孔中加200μL TBK 培养基,其中含Kanamycin 和1 mmol/L IPTG,接种后每孔再加50μL 矿物油封顶以防蒸发。预留2孔,其中TBK 分别含或不含IPTG,此2孔接种野生型菌株分别作为阳性、阴性对照。将该96孔板置于Plate Reader V3中30℃孵育,每隔10 min 振板30 s 并测定OD600,连续测定18 h 以上。绘制30个孔中30个单菌落的OD-时间生长曲线,与对照孔相比较,确定其中野生型和突变型的数量。
1.5 突变菌株的质粒提取和测序
为了研究突变发生的位点,在不同时间点和不同IPTG 浓度的菌液样品中随机挑选6株突变菌,LB 扩大培养后用试剂盒抽提质粒,电泳检测后送上海迈浦生物技术有限公司测定质粒全长序列。测序结果用Vector NTI 软件与pPopctrl质粒原始序列比对。
1.6 突变质粒转化不含任何质粒的top10F’菌株后的生长曲线测定
为了研究是否质粒上的突变足以使宿主逃脱群体感应自杀行为,文中选择将2个已被证实的并已测序的突变质粒重新转化到不含任何质粒的野生型top10F’宿主菌中去,构建只有质粒突变的准野生型细菌,按照1.3中的方法测定CFU 生长曲线。
2 结果与分析
2.1 不同IPTG 条件下野生型的生长曲线和自杀强度
含有pPopctrl 自杀质粒的top10F’细菌在含有不同浓度IPTG 的培养基中的生长曲线如图2、3所示。从OD600曲线(图2)可见,IPTG 的浓度对菌群密度有十分明显的影响,特别是在12 h以后,添加IPTG 的样品管中浊度呈现显著差异。但是由于CcdB 蛋白的细胞毒性体现在抑制了DNA 复制,而细胞并不裂解,因此CFU 曲线(图3)比OD600曲线更能准确地反映菌群的生长特征。从图3可以看出,6 h 以前,各管细菌正常生长,而6 h 以后,细菌开始大量自杀,CFU值迅速下降,在12 h 前后降至最低值,而细菌的自杀率与IPTG 浓度呈正相关。当IPTG 浓度为1 mmol/L 时,在短短6 h 时间里,99.8%的细菌死亡,而IPTG 浓度为0.05 mmol/L 时,这一数值为98%,对于IPTG 为0.01 mmol/L 的样品管,其菌群密度一直低于对照管,但在整个实验周期内,观察不到明显的自杀现象。在12 h 以后,菌群密度逐步缓慢回升,但在15 h 后,由于营养条件的限制,菌群密度趋于稳定。

图2 野生型细菌在不同IPTG 浓度TBK 培养基中的生长曲线(OD600曲线)Fig.2 Growth curves (OD600) of the wild type at various IPTG concentrations.
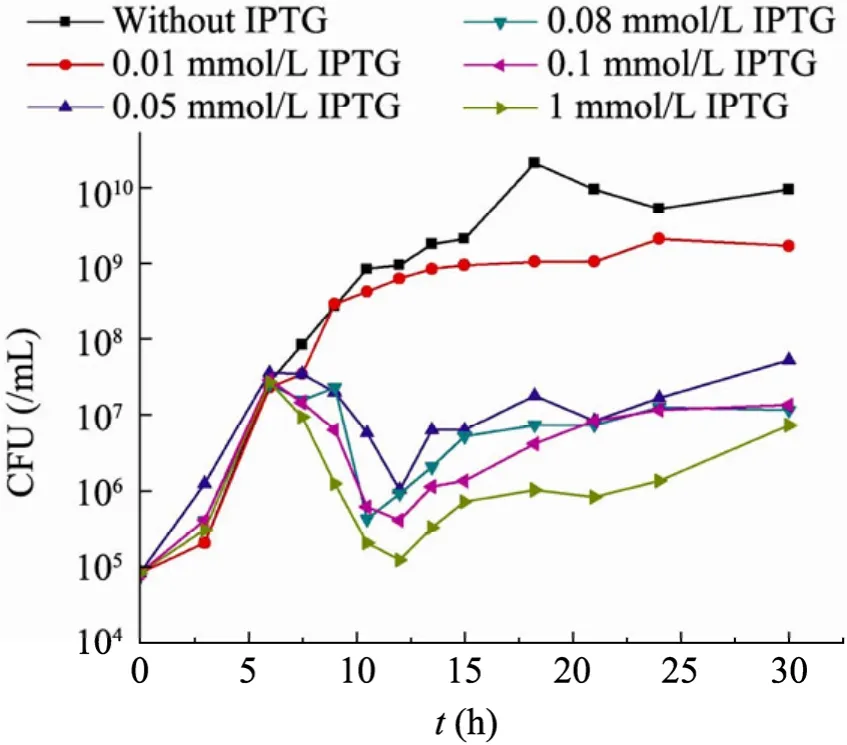
图3 野生型细菌在不同IPTG 浓度TBK 培养基中的生长曲线(CFU 曲线)Fig.3 Growth curves (CFU-time) of the wild type at various IPTG concentrations.
图3还显示细菌开始自杀的时间与IPTG 浓度无关。在本文的实验条件下,群体感应发生作用或者说AHL 分子达到阈值所需的菌群密度约为5×107个/mL。
上述现象可以根据自杀基因回路的设计原理得到合理的解释。IPTG 浓度越大,lac 启动子被诱导生成的R 蛋白越多,AHL 分子达到阈值后,被激活的R*也就越多,从而使lux 启动子被更频繁地启动,大量的CcdB 蛋白引起细菌自杀。而AHL 浓度的累积仅仅与菌群密度有关,在其浓度达阈值前,所有样品管中的细菌生长速率相同,因此在同一时刻启动自杀。
2.2 突变菌株的筛选和自杀过程中突变种群的蔓延
按照1.4中的方法,在每一个时间点取样涂布平板后随机挑选30个单菌落接种96孔板,绘制生长曲线并与阴性(Wild type,no IPTG)、阳性(Wild type with 1 mmol/L IPTG)对照比较。以0.1 mmol/L IPTG 管13.5 h 的样品为例,曲线如图4所示。
以图4为例,随机挑选的30个单菌落中,有15个的生长曲线与阴性对照即不加IPTG 的野生型一致,说明这些菌株不再被IPTG 诱导自杀,属于突变型个体,因此确定在 IPTG 浓度0.1 mmol/L 的样品管13.5 h 的菌液中突变型比例为50%。
按照这一方法,我们研究了突变型个体随时间产生并逐渐蔓延的趋势(图5)。

图5 不同IPTG 条件下突变型个体随时间产生和蔓延的趋势Fig.5 Tendency of the mutant ratios in different IPTG tubes with time.
从图3可知,6 h 时细菌已经开始自杀;而通过图5可见,对于1、0.1、0.08 mmol/L IPTG的3个试管,突变型个体在9 h 时才被筛选出来;而对于0.05 mmol/L 的试管,则到12 h 才有突变型出现。突变型个体的蔓延也与IPTG 浓度密切相关。IPTG 浓度越大,突变型个体蔓延得越快,伴随着野生型个体的大量自杀,突变型将迅速统治整个种群。
这一结果暗示:如果采用连续培养模式,利用6~9 h 之间的窗口期,就有可能实现菌群密度的连续振荡而不被突变型个体所破坏。另一方面,如果将以IPTG 浓度为参数的选择压力控制在一个合适水平,有可能实现野生型和突变型和平共存的稳态群落结构。
2.3 质粒基因测序寻找变异位点
从IPTG 为0.1 mmol/L 的试管所涂布的12 h、14 h 和24 h 的平板上已经鉴定为突变型的菌落中,分别随机挑选2个,共6个菌落,于LB 培养基中扩大后提取质粒,电泳验证后送测序。结果表明:6个质粒中有3个序列完全相同,因此可以归并为4种质粒,代表着4种突变个体,将其分别命名为1227、1408、2407和2412。
这些突变质粒上都有外部片段插入,并且插入位点基本一致,都在luxR 基因第565~577位核苷酸之间。插入片段长度为505~628 bp 不等。把插入片段序列在GenBank 中Blast 发现:这些片段与大肠杆菌IS 家族转座酶基因(IS family transposase gene)高度相似(≥99%),意味着这是一段转座子。上述4个质粒中,1227的插入片段还破坏了664~844 bp 之间的原有序列,其余3个质粒都是在一个位点很整齐地插入,且插入位点两侧有重复序列,这符合转座子插入的一般特征。图6展示了luxR-luxI 基因的结构及以1227为例的外源片段插入。
对这些质粒而言,外源片段的插入直接破坏了luxR 基因的完整性。突变型个体可能正是借此脱离了群体感应并进而逃避自杀的。因为所有的序列结果表明:除了这一区域外源片段的插入,质粒上其他区域的序列没有变化。
2.4 转座子的插入足以使突变型避免自杀
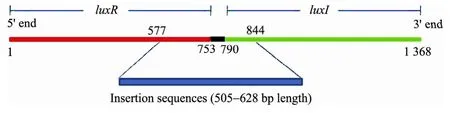
图6 突变型菌株1227的质粒上外源片段的插入Fig.6 Insertion of a fragment intervening the luxR gene of plasmid in the mutant 1227.
为了证明质粒上发生的上述插入突变是否足以使细菌逃脱自杀基因回路控制,以及确定是否突变型个体的染色体上也发生了相关突变,我们以不含有任何质粒的野生型top10F’为宿主,将1408和2412两个突变株的质粒分别转化进去,将之命名为1408´和2412´。这两株菌的染色体与野生型一样,而只有质粒发生了转座子插入。它们在含有1 mmol/L IPTG 的TBK 培养基中的生长曲线如图7所示。
结果显示:与野生型细菌明显的自杀行为不同,1408´和2412´对IPTG 均不敏感,没有自杀现象发生,其生长曲线与1408和2412没有显著差异。这说明突变型个体摆脱群体感应、逃避自杀回路控制是由于外源片段插入luxR 基因造成的。
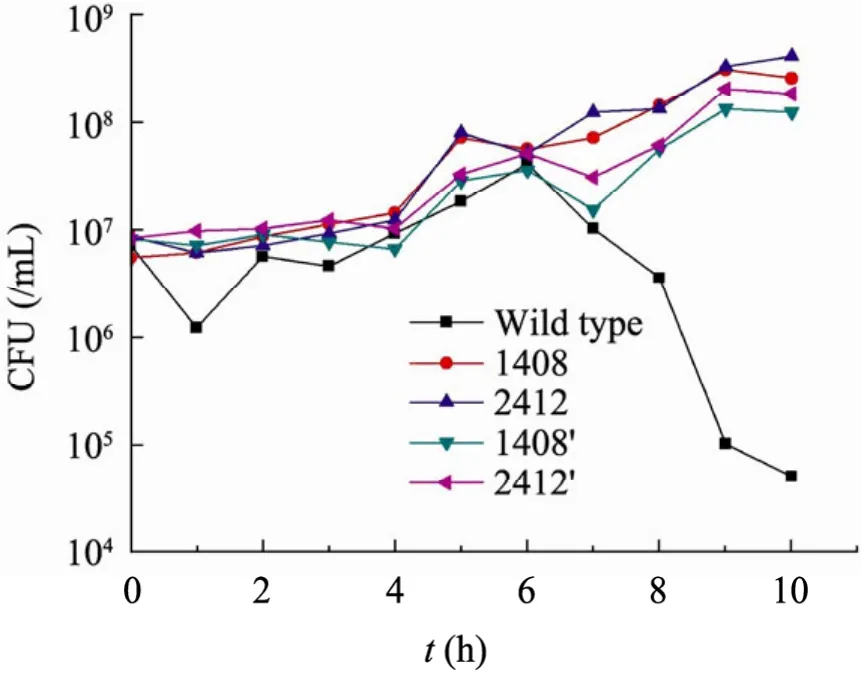
图7 野生型、突变型和只有质粒突变的准野生型的生长曲线比较Fig.7 Growth curves of the wild type,mutants and the top10F’ with mutated plasmid in 1 mmol/L-IPTG TBK media.
3 讨论
通过基于群体感应的自杀回路,可以赋予宿主菌群在达到一定密度后自杀的特性。这样的工程化细菌在以细菌为载体的靶向给药、生态环境修复和污染治理等方面有潜在的应用价值。在连续培养条件下,细菌密度的连续振荡可以成为合成生物学中的一个重要部件。在基础研究方面,这样的细菌模型对自然状态下菌群的自杀现象进行了简化,有利于排除各种噪信号干扰,探究群体感应现象和自杀基因的进化问题。
本研究发现与细菌生死存亡相关的选择压力越大,亦即对细菌的杀伤力越大,突变型个体产生得越早蔓延得也越迅速。这方面的深入研究对总结杀菌型药物的给药剂量和频率有启示作用。
本研究发现群体感应自杀行为产生的突变个体都是由于转座子插入luxR 基因造成的。这一方面暗示了基因转座现象在生物适应性进化方面的作用远大于点突变,另一方面也暗示:当群体感应的效应蛋白,如本研究的CcdB,对细菌个体不利时,进化最优先的途径是逃脱群体感应,变成“自私”个体,而不是优先去破坏效应蛋白。
在发现转座子破坏了luxR 基因完整性以后,我们还研究了突变个体是否仍然产生AHL。初步结果(本文未提供)显示结果是否定的,这符合“转座子会破坏其后面基因的表达”的既有结论。AHL 是群体感应的主要介质,没有它,意味着群体感应系统难以为继。
以上研究结论提示:可以从以下3方面入手限制突变型个体的产生蔓延,进而维持自杀基因回路的稳定。首先,利用细菌启动自杀到突变型个体被筛选出来之间的时间差,在这个时间窗口里稀释菌体、转接种或补料培养,都会保持单一野生种群的稳定。第二,细菌自杀的强度不能太大,在本文的基因回路中,即IPTG 的浓度不能太高。野生型个体生存的空间过小,突变型个体被筛选出来的概率就越大。第三,研究发现,所有的突变个体转座子都插入在一个基本相同的区域,暗示着这是转座的一个“热点”。下一步对该区域的DNA 序列的深入分析,特别是对该区域表达的肽段在整个LuxR 蛋白中所起的作用进行研究,将有助于揭示LuxR-AHL 系统分子进化的规律,对该序列优化后可以限制转座子插入,有助于构建更具鲁棒性的基因回路。
[1]Voigt CA.Genetic parts to program bacteria.Curr Opin Biotechnol,2006,17(5):548−557.
[2]Alterovitz G,Muso T,Ramoni MF.The challenges of informatics in synthetic biology:from biomolecular networks to artificial organisms.Brief Bioinf,2010,11(1):80−95.
[3]O’Shaughnessy EC,Sarkar CA.Analyzing and engineering cell signaling modules with synthetic biology.Curr Opin Biotechnol,2012,23:1−6.
[4]Slusarczyk AL,Lin A,Weiss R.Foundations for the design and implementation of synthetic genetic circuits.Nat Rev Genet,2012,13(6):406−420.
[5]Zhu XX,Luo YL,Wang J,et al.Synthetic biology-progress and application.Int J Genet,2008,31(4):281−283(in Chinese).朱新星,罗永伦,王晶,等.合成生物学进展与应用.国际遗传学杂志,2008,31(4):281−283.
[6]Wang JS,Qi QS.Synthetic biology for metabolic engineering?a review.Chin J Biotech,2009,25(9):1296−1302(in Chinese).王俊姝,祁庆生.合成生物学与代谢工程.生物工程学报,2009,25(9):1296−1302.
[7]Wang QF,Yan X,Wei W,et al.Screening,modification and standardization of biological parts for synthesis biology.Chin Bullet Life Sci,2011(9):860−868(in Chinese).王钱福,严兴,魏维,等.生物元件的挖掘、改造与标准化.生命科学,2011(9):860−868.
[8]Williams JW,Cui X,Levchenko A,et al.Robust and sensitive control of a quorum-sensing circuit by two interlocked feedback loops.Mol Syst Biol,2008,4:e234.
[9]Gordon AJE,Halliday JA,Blankschien MD,et al.Transcriptional infidelity promotes heritable phenotypic change in a bistable gene network.PLoS Biol,2009,7(2):e44.
[10]Ayukawa S,Kobayashi A,Nakashima Y,et al.Construction of a genetic AND gate under a new standard for assembly of genetic parts.BMC Genomics,2010,11(Suppl 4):S16.
[11]Tashiro Y,Fukutomi H,Terakubo K,et al.A nucleoside kinase as a dual selector for genetic switches and circuits.Nucleic Acids Res,2011,39(3):e12.
[12]Danino T,Mondragón-Palomino O,Tsimring L,et al.A synchronized quorum of genetic clocks.Nature,2010,463:326−330.
[13]Lou CB,Liu XL,Ni M,et al.Synthesizing a novel genetic sequential logic circuit:a push-on push-off switch.Mol Syst Biol,2010,6:e350.
[14]Stricker J,Cookson S,Bennett MR,et al.A fast,robust and tunable synthetic gene oscillator.Nature,2008,456:516−519.
[15]Tigges M,Marquez-Lago TT,Stelling J,et al.A tunable synthetic mammalian oscillator.Nature,2009,457:309−312.
[16]Kim J,Winfree E.Synthetic in vitro transcriptional oscillators.Mol Syst Biol,2011,7:e465.
[17]Mondragón-Palomino O,Danino T,Selimkhanov J,et al.Entrainment of a population of synthetic genetic oscillators.Science,2011,333:1315−1319.
[18]Ng W,Bassler BL.Bacterial quorum-sensing network architectures.Annual Rev Genet,2009,43:197−222.
[19]Tanouchi Y,Pai A,You L.Decoding biological principles using gene circuits.Mol BioSystems,2009,5(7):695−703.
[20]Pai A,You L.Optimal tuning of bacterial sensing potential.Mol Syst Biol,2009,5:e286.
[21]Hong SH,Hegde M,Kim J,et al.Synthetic quorum-sensing circuit to control consortial biofilm formation and dispersal in a microfluidic device.Nat Commun,2012,3:e613.
[22]You L,Cox RS,Weiss R,et al.Programmed population control by cell-cell communication and regulated killing.Nature,2004,428:868−871.
[23]Balagaddé FK,You L,Hansen CL,et al.Long-term monitoring of bacteria undergoing programmed population control in a microchemostat.Science,2005,309:137−140.
[24]Zhu YX.Modern Molecular Biology.3rd ed.Beijing:Higher Education Press,2008:54−59(in China).朱玉贤.现代分子生物学.3版.北京:高等教育出版社,2008:54−59.
[25]Stokes HW,Gillings MR.Gene flow,mobile genetic elements and the recruitment of antibiotic resistance genes into Gram-negative pathogens.FEMS Microbiol Rev,2011,35:790−819.
