锂-二氧化锰电池中关键材料的研究进展
2013-06-27邓一凡
邓一凡
(海军驻712所军事代表室,武汉 430064)
锂-二氧化锰电池中关键材料的研究进展
邓一凡
(海军驻712所军事代表室,武汉 430064)
锂-二氧化锰(Li/MnO2)一次电池在民用、军用领域都有着广泛的应用。它具有自放电率低、高比能、高功率、廉价、环保等特点。本文对锂-二氧化锰一次电池的嵌锂机制、正极材料、电解液、负极材料等关节环节的研究现状和发展进行了阐述,并对其不足与发展方向进行了分析。
锂锰原电池 MnO2电解液 金属锂
0 引言
锂系列电池(含一次锂电池和锂离子蓄电池)具有比能高、环保、自放电率低、使用方便等优点。这些传统水系电解液体系电池无法比拟的优点已使其成为当今世界化学电源研究的热点。自然界金属元素中锂元素比重最轻、标准电极电位最负,所以锂电池比其他传统材料体系电池具有更高的能量和功率密度。因而早在1970年美国军方和日本Matsuchita公司就几乎同时独立研制出来第一代的锂电池,Li/(CF)n一次锂电池。1973年[1-2],性能更好、价格更低的锂-二氧化锰(Li/MnO2)体系的一次锂电池(简称锂-二氧化锰电池,下同)由日本三洋公司研发成功,并逐渐代替了Li/(CF)n体系电池。随着设计、材料和工艺水平的进步,锂-二氧化锰电池不断适应多样化的用电需求。时至今日,其已经成为世界上应用最为广泛一次锂电池。其典型应用集中于电压维持微功率型、能量型(如内置医疗器械、无线射频标签RFID)和功率型(如煤矿便携仪器仪表)三个方向。而它在军事上的地位更为重要:用做多种类型的声纳干扰器、水雷引信、自毁装置的电源。该类军用装备都需要供电电池具有长的存储寿命、宽的温度适应、体积小、比能量大等特性。锂-二氧化锰电池均能较好地满足这些需求。
1 锂-二氧化锰电池原理、制作方法及特点
该类电池的正极一般为电解二氧化锰(EMD),负极为金属锂,正负极之间的电解液为1摩尔/升的高氯酸锂有机溶液。其工作原理表达式如下:

锂-二氧化锰电池工作时,金属锂失去电子,变成锂离子溶解到电解液中,然后在电场和浓度梯度场的驱动下扩散到正极的表面,穿过活性物质二氧化锰(EMD)表面的固体电解质膜(SEI),在EMD表面发生电荷转移,使得Mn4+还原成Mn3+,并嵌入到EMD的晶格中,形成MnOOLi[3-5]。锂-二氧化锰电池的工作电压在2.8左右。该类电池的开路电压一般在3.3 ~3.6 V之间,通常在3.1 ~2 V间进行放电,其能量密度可达到300 Wh/kg。
锂-二氧化锰(Li/MnO2)电池的基本结构类似于传统板栅结构:隔膜隔开正负极活性物质,浸泡的电解液提供离子传输的环境,集流体负责外电场的沟连和电能导出。目前,依不同的用电需求设计的电池主要有三种形式,由小到大可分为:钮扣型、圆柱型和矩形。还可以根据电池内部极片的制作工艺分为卷积式和叠片式。
现代工艺制造的锂-二氧化锰电池总结起来具有以下几个特点[6]:能量密度高,功率密度高;储存时间长,自放电率低;原材料廉价,电池成本低;对环境友好,适合推广使用。
工程实践上进一步的提高锂-二氧化锰电池体系的综合性能有两个方面,一方面是优化制造工艺,另一方面主攻方向是提升电池材料本生的安全性和比能。以进一步拓展该体系电池的应用范围。概括起来主要改进手段包括正极二氧化锰的优化改性、电解液配方的优化改进、负极金属锂的特殊处理三个方面,本文将对前两个方面进行具体的介绍。
2 正极二氧化锰的研究
1) 二氧化锰(MnO2)的嵌锂机理
锰的化学价态多,可以形成多种氧化物,并且合成工艺简单,价格低廉,一直以来都是电极材料研究的热点。锰的多价态使得锰氧化物的储锂机制复杂,研究起来十分困难,因此对二氧化锰的储锂机制的研究非常少。中科大的陈春华教授等研究发现二氧化锰嵌锂后的最终产物为LiMn3O4,而且当二氧化锰放电到0 V时,仍然没有探测到金属态的锰。但是Reddy等人却认为二氧化锰的反应机理应为:

因此二氧化锰完全放电至零伏后的理论比容量应为1233 mAh/g。中科院物理所的王兆祥研究员等认为二氧化锰的储锂机制为相转变反应,在其不断放电过程中有如下反应发生:

王兆祥团队通过第一性原理对二氧化锰的反应电压进行了计算,如(1)~(3)所示。括号内后面的电压值为实验值。实验值和理论值的差别主要来自于二氧化锰材料的形貌和结构不同所带来的动力学差异。二氧化锰放电时,随着锂离子的嵌入变成不同的锂锰氧化物,其结构变化如图1所示:
2)二氧化锰的结构
目前市面上的二氧化锰材料包括天然锰矿和合成二氧化锰,而用在锂原电池中的为后者中的电解二氧化锰(EMD)。按照空间结构的不同,二氧化锰可分为三大类:一维隧道、二维层状以及三维网状。具体又包括α-MnO2,γ-MnO2,δ-MnO2,ε-MnO2,β -MnO2,λ-MnO2等30晶体结构。不同的晶型在不同的温度下可以互相转化。文献报道显示在锂-二氧化锰电池中最适合的、电化学活性最高的二氧化锰材料为γ/β型二氧化锰。其次是β -MnO2、γ-MnO2,最差的为α-MnO2[3-5]。EMD中主要成分为γ-MnO2、少量的β -MnO2和少量的结合水,通常在出厂前经过热处理得到γ/β的混合相,尤其是将二氧化锰中的结合水除去,才能保持电池的良好性能。 因为结合水使锂离子嵌入的过程中在MnO2的扩散变慢,从而降低了二氧化锰的活性。受热时电解二氧化锰的颗粒空腔中结合水的随着温度的变化如图2所示。

3)二氧化锰材料的优化
电解二氧化锰的热处理温度对材料的晶型起着至关重要的影响。天津大学的杨建峰等认为对于中小负载场合下使用的电解二氧化锰材料,最佳热处理温度为400°C,20小时;对于大负载场合下使用的电解二氧化锰最佳热处理温度为380°C,20小时。继续升温时,随着热处理温度的升高,输出功率下降。而张晶等认为使用于原电池中的电解二氧化锰在300°C~380°C 热处理后的性能最优。

纳米材料由于具有表面效应、尺寸效应等特点往往具有特殊的电化学性能,因而制备纳米级电解二氧化锰也是提高锂-二氧化锰电池的手段之一。夏熙等人制备的粒径在6~90 nm的纳米γ-MnO2具有良好的放电性能。另外,对二氧化锰进行碳掺杂和在其表面镀银都是有效提高其电导率的方法,使得电池的性能明显提高。研究表明将热处理的电解二氧化锰倒入银液中,真空干燥后制成的MnO2/Ag的复合材料大大改进了正极的电导率,提高的电池的放电电流,从而增强电池的综合性能。
在对二氧化锰材料的优化设计总结起来主要包括两个方面:1)采用热处理、体相掺杂、纳米化等手段来优化其晶体结构和表面形貌,使得嵌锂的动力学过程更为容易。2)采用掺杂、包覆等手段来提高其电导率,使得原电池具有更高的功率和比容量。
3 锂-二氧化锰电池电解液的研究
1) 传统电解液体系
锂一次电池和二次电池中的采用的电解液均为有机溶剂体系。该体系通常由提供锂离子的锂盐和作为锂盐载体的有机溶剂组成。为提高离子化率,有机溶剂通常选用介电常数高、易于溶解锂盐的环形碳酸酯类溶剂。但由于该类有机溶剂往往具有很高的粘度,会降低电解液的电导率,所以通常将介电常数低但粘度也低的线性碳酸酯、醚类、烷烃类有机溶剂和环形碳酸酯混合使用。目前在一次电池中应用最广泛的电解液体系主要成分为1M LiClO4PC/DME (丙烯碳酸酯:1,2-二甲氧基乙烷,1:1), 还有THF(四氢呋喃)、DOL(1,3-二氧戊环)、GBL(γ-丁内酯)等也是锂原电池中常用的溶剂。
除了LiClO4外,可应用在一次电池中的锂盐还有LiPF6、LiBF4、LiCF3SO3等。LiPF6与LiClO4都具有较高的电导率,但LiPF6热稳定性差,遇痕量的水分便容易分解;LiBF4与LiCF3SO3体系的电解液电导率则较前两者低,并且LiCF3SO3体系电解液在电池过充的情况下腐蚀集流体铝箔严重。所以相对廉价、对水分不敏感、不腐蚀铝箔、电导率高的LiClO4体系一直以来在Li/MnO2电池电解液市场上占据统治地位。
2)新型电解液的研究

锂盐是锂电池电解液中的最重要有效成分,起到提供电解液中锂离子的作用,锂盐的选择严格制约了与之匹配的溶剂和添加剂的选型。锂盐诱发的副反应往往也是电解液失效的主要原因。LiClO4是锂电池中研究、应用最早的锂盐。其致命的弱点是高氯酸根阴离子的氧化性强。在高温、高电流密度等极端条件下使用时,高氯酸根阴离子与有机溶剂发生剧烈的化学反应,存在爆炸隐患。因而目前大型锂一次电池的要求中,安全标准一般注明不能使用含有高氯酸锂的电解液。但同时综合性能与之相媲美的更安全的电解液体系尚无规模商用,研发出新的电解液体系刻不容缓。锂一次电池电解液的研究面临着新的机遇和挑战,目前有希望取代LiClO4的锂盐,主要包括以下三大类:
a)LiPF6的衍生物
目前,研究的LiPF6的衍生物通常是用其他键来代替原有的P-F键,主要有两类: P-O键代替P-F键与P-C键代替P-F键。两种代替方式均为部分取代或者全部取代。例如新型锂盐LTBP(图3),将邻苯二酚代替LiPF6中的6个F,是第一类取代的代表。该盐不易水解,热稳定性、安全性等明显优于LiPF6、LiClO4等传统锂盐,但该盐分子量大,使得电解液体系粘度增加、电导率降低。Li(C2F5)3PF3(LiFAP)是另一类的代表,该盐的电解液体系电导率较高(7×10-3s/cm),并且在痕量水分时不易生成HF,闪点提高,电池安全性大大提高。
b)LiBOB的衍生物
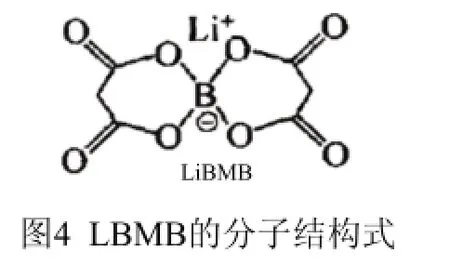
有机硼酸锂盐比LiClO4具有更好的安全性和更宽的耐压范围。它最大的缺点是溶解度和电导率较低。其衍生物也有两类:烷基硼酸锂与芳基硼酸锂,它们的取代基不同。前者的代表为双丙二酸硼酸锂(LiBMB)。其结构如图4所示。而双(邻苯二酚)硼酸锂(LBBB)、双(水杨酸)硼酸锂(LBSB)、双(2,2’-联苯二氧基)硼酸锂(LBBPB)、双(2,3萘二酚)硼酸锂(LBNB)等都是后者的典型代表,如图5所示其分子结构式。芳基硼酸锂的氧化分解电位较低,一般只有3.5~4.0 V之间,因而离锂二次电池的实际应用还有一定差距,但在锂原电池中的仍有良好的应用前景。
2006年已有研究报道显示草酸二氟硼酸锂(LiODFB)兼顾了LiBOB和LiBF4的优势,该体系电解液耐高温,更具有优良的低温性能,在-30°C时电池还可保持室温容量的65%。

c)LiTFSI改性的锂盐
以LiTFSI分子中的N原子为中心来改进的磺酸亚胺锂盐系列虽然分子量大,电解液粘度高,但普遍具有较高的热稳定性和溶解度,是当下研究较多、最有望商品化的锂盐。 M. Armand于1999年报道的双氟磺酰亚胺锂(LiFSI)在该系列的盐中具有最高的电导率。FSI离子的结构如图6所示,由于LiFSI的分子量为该体系盐中最小的,分子链柔顺度相对较高。黄学杰、周志彬等人研究发现LiFSI所组成的电解液在EC/DMC体系中具有极高的迁移数和电导率,在低水分含量、电解液纯度高时无腐蚀集流体铝箔的现象。因此LiFSI作为锂盐应用于锂电池中具有巨大的潜力。

华中科技大学周志彬课题组2011年报道的(氟磺酰)(正全氟丁基磺酰)亚胺锂(LiFNFSI)的热分解温度高达220°C,惰性电极作为工作电极时,分解电压超过5.7 V。LiFNFSI体系电解液与隔膜具有更好浸润性、高温稳定性,表现出优良的综合性能和应用潜力。
4 锂-二氧化锰电池存在的问题和展望
由于锂-二氧化锰电池中,金属锂和电解液均为有燃爆倾向的材料。金属锂熔点只有180°C,具有极强的还原性,因而设计不当或安全措施不到位的电池在滥用的情况下易导致热失控,进而发生燃烧、爆炸。这也是目前限制锂原电池发展的主要技术门槛。
虽然目前锂-二氧化锰电池的各方面技术日趋成熟,但是该电化学体系的相互作用还不够完备,基元反应仍未研究透彻。在电池制备上,国内材料、工艺装备水平仍然和日本等发达国家存在一定的差距,限制了电池性能的发挥。相关领域的技术力量有必要在该体系电池安全性、储存性、低温性等方面进一步的研究和探索,以促进我国锂电行业在民用、军用的高科技产业方面的长足发展。
[1] Watanabe N, Fukuba M. U.S. Patent 3536532, 1970.
[2] Braeuer K, Moyes K R. U.S Patent 3514337, 1970.
[3] 吕鸣祥等. 化学电源,天津:天津大学出版社,1992.
[4] 宋文顺. 化学电源工艺学. 北京:中国轻工业出版社,1998.
[5] 郭炳焜,李新海,杨松青. 电池原理及制造技术. 化学电源, 长沙:中南工业大学出版社,2000.
[6] 张增照. 以可靠性为中心的质量设计、分析和控制.质量管理,北京:电子工业出版社,2010.
Review of the Key Materials in Li/MnO2Batterie0000s
Deng Yifan
(Naval Representatives Office in Wuhan Institute of Marine Electric Propulsion, Wuhan 430064, China)
The non-aqueous Li/MnO2battery systems are widely used in civil and military markets. Li/MnO2batteries have many features with low self discharge rate, high energy density, high power density, low cost, friendly to environment and so on. This paper discusses the investigation progress in the key materials in Li/MnO2batteries: cathodes, electrolytes, membranes, anodes and the study of the mechanism of lithium insertion at discharge processes. Finally, the disadvantages and expectations are analyzed.
Li/MnO2battery; MnO2; electrolyte; lithium metal
TM911
A
1003-4862(2013)05-0047-04
2012-10-31
邓一凡(1978-),男,工程师。研究方向:电化学。
