黄芩根围AM真菌优势种
——网状球囊霉的培养
2013-06-23贺学礼王蒙
贺学礼,王蒙
(河北大学生命科学学院,河北保定 071002)
黄芩根围AM真菌优势种
——网状球囊霉的培养
贺学礼,王蒙
(河北大学生命科学学院,河北保定 071002)
为建立网状球囊霉的最佳培养体系,利用盆栽培养法研究了不同条件对黄芩根围AM真菌优势种——网状球囊霉(Glomusreticulatum)繁殖的影响.结果表明,不同宿主植物、基质以及接种量对网状球囊霉繁殖有显著影响,在以黑麦草为宿主、基质为基质Ⅲ、接种量为50/盆时,孢子密度35.3/g,总定殖率83.9%,泡囊与丛枝定殖率分别为64.8%和4.7%,琥珀酸脱氢酶(SDH)活性显著高于其他处理.随接种量增加,SDH活性、孢子密度、定殖率、宿主植物黄酮含量显著提高.明确了网状球囊霉的最佳培养体系为:黑麦草为宿主植物,沙、土、草炭、陶粒体积比2∶2∶1∶2为基质,孢子接种量50/盆.此外,对网状球囊霉与宿主植物生长的相关性进行分析表明,网状球囊霉孢子密度、总定殖率与地下干质量和黄酮含量、易提取球囊霉素(EEG)、总提取球囊霉素(TEG)正相关,说明AM真菌繁殖直接影响宿主植物生长,并有促进植物生长的作用.
黄芩;网状球囊霉;中间宿主;培养基质;孢子接种量
AM真菌是生物界最广泛、最重要的一类共生真菌,能够促进植物生根,增强植物抗逆性,调节宿主体内代谢活动,提高植物产量和品质[1-8].因其对植物有诸多有益作用,被誉为“生物肥料”.目前,对于AM真菌的研究主要集中在AM真菌对植物生长、抗逆性方面[1-8],而对如何提高AM真菌繁殖量,国内外研究主要集中在基质对AM真菌繁殖量的影响.刘广福[5]等研究发现,草炭土、田间土、河沙体积比为2∶2∶1是摩西球囊霉的优良繁殖基质;陈宁等[6]以高粱为宿主接种摩西球囊霉,发现最佳培养基质是加入沙与壤土体积比为1∶1;曾瑞香等[8]研究显示,栽培基质为泥炭、珍珠岩、河沙体积比1∶1∶1,侵染率、侵染强度、菌丝长度最高;Gaur and Adholeya[9]等在基质中加入沙、珍珠粉、木炭粉、黏性砖粉,发现AM真菌繁殖体数量增加了40%~50%.而有关宿主植物、基质、接种量三者组合对AM真菌生长和繁殖的影响研究未见报道.
黄芩(ScutellariabaicalensisGeorgi)为唇形科黄芩属草本植物,药用其根,具有清热解毒,燥湿泻火,止血安胎的功效.目前,由于用药范围扩大,黄芩野生资源供不应求,已变野生为人工栽培.研究表明,AM真菌能与黄芩根系形成良好共生关系,促进黄芩生长[4,10].本文通过盆栽实验,研究了培养基质、中间载体和孢子接种量等因素对黄芩AM真菌优势种——网状球囊霉生长的影响,以便建立网状球囊霉培养体系,为进一步研制高效菌根制剂和菌根生物技术应用提供依据.目前,关于网状球囊霉扩繁的研究未见报道.
1 材料与方法
1.1 材料
1.1.1 网状球囊霉
用湿筛法[11]从河北安国市中药材种植基地黄芩(ScutellariabaicalensisGeorgi)根围土壤中分离网状球囊霉(Glomusreticulate)孢子作为接种剂.实验设置3个接种量,即10,30,50/盆.
1.1.2 宿主植物
选取三叶草(TrifliumrepensL.)、苜蓿(MedicagosativaL.)和黑麦草(LoliumperenneL.)3种植物为AM真菌中间繁殖载体,种子购于河北省保定市农贸市场.
1.1.3 基质
选取3种培养基质,即基质Ⅰ:沙、土体积比为1∶1,基质Ⅱ:沙、土、草炭体积比为2∶2∶1,基质Ⅲ:沙、土、草炭、陶粒体积比为2∶2∶1∶2.土壤取自安国中药材基地黄芩根围原位土,陶粒、草炭购于河北省保定市花鸟鱼虫市场.
1.2 实验设计
播种前基质在121℃下间歇灭菌2次,时间为1h.实验器皿(内径7cm×深8.5cm)用体积分数为75%的酒精消毒后使用.播种时,每盆装培养基质0.75kg.将不同基质、接种量、宿主植物进行组合,共27个处理,每个处理重复3次,共81盆.基质装盆后用水浇透,待表面微干时播种并接种孢子,出苗10d后定苗,每盆20株,定时浇水,3个月后收获测定相关指标.
1.3 测定项目
生物量用称重法;黄酮含量用超声波提取法[11];孢子密度用湿筛法测定[12];定殖率用Phillips和Hayman方法测定[13];球囊霉素含量用Wright和David方法测定[14-15];SDH活性用Smith等方法测定[16].
1.4 数据分析
采用DPS,SPSS生物统计软件对实验数据进行统计分析.
2 结果与分析
2.1 AM真菌生长状况
2.1.1 不同处理对孢子密度的影响
宿主植物为三叶草,基质相同,随接种量增加,孢子密度提高,接种量为50/盆时孢子密度显著高于其他接种量.不同基质,基质Ⅲ的孢子密度显著高于其他基质.说明不同孢子接种量会影响网状球囊霉繁殖量.
宿主植物为黑麦草,基质Ⅱ时,孢子不同接种量间差异不显著,但在接种量为50/盆时孢子密度达最大值;基质Ⅰ和基质Ⅲ时,接种量不同孢子密度差异显著,接种量为50/盆的孢子密度显著高于其他接种量.接种量为10/盆时,基质Ⅱ的孢子密度显著高于其他基质;接种量为30/盆时,不同基质间孢子密度无显著差异;接种量为50/盆时,基质Ⅲ的孢子密度显著高于其他基质.
宿主植物为苜蓿,接种量增加孢子密度随之增加,接种量为50/盆的最高.接种量为10/盆和30/盆时,不同基质间无显著差异,在基质Ⅲ达最大值;接种量为50/盆时,基质Ⅲ的孢子密度显著高于其他基质.
由表1可知,宿主植物不同,基质和接种量相同,黑麦草的孢子密度显著高于其他宿主植物;接种量为50/盆时,基质Ⅲ的孢子密度最大.

表1 不同处理对AM真菌生长的影响Tab.1 Effect of AM fungal growth in different treatments
2.1.2 不同处理对菌丝内SDH活性的影响
宿主为三叶草,基质Ⅰ时,不同接种量间SDH活性无显著差异;基质Ⅱ和基质Ⅲ,接种量为50/盆的SDH活性显著提高.相同接种量,基质Ⅲ的SDH活性显著高于其他基质.
宿主为黑麦草,接种量为50/盆的SDH活性显著高于其他接种量.接种量相同,仅基质Ⅲ的SDH活性显著高于基质Ⅰ.
宿主为苜蓿,基质Ⅰ时,接种量为50/盆的SDH活性最高;基质Ⅱ,接种量为30/盆的SDH活性显著高于其他处理;基质Ⅲ,随接种量增加,SDH活性提高,在接种量为50/盆时达最大值.相同接种量,基质Ⅲ的SDH活性高于基质Ⅰ和基质Ⅱ.
接种量和基质相同,黑麦草的SDH活性显著高于其他植物;接种量为50/盆、基质Ⅲ时,SDH活性最高,显著高于其他处理(表1).
2.1.3 不同处理对AM真菌定殖率的影响
相同宿主,总定殖率均在基质Ⅲ、接种量50/盆时最大,显著高于其他处理;相同处理下,黑麦草总定殖率显著高于其他宿主植物,最高达83.9%.
基质Ⅲ、接种量50/盆的泡囊定殖率显著高于其他处理;基质和接种量相同,不同宿主泡囊定殖率存在显著差异,黑麦草泡囊定殖率显著高于三叶草和苜蓿.
宿主相同,基质和接种量不同,基质Ⅲ、接种量50/盆的丛枝定殖率高于其他处理;基质相同,丛枝定殖率因接种量不同有所差异,随接种量增加丛枝定殖率提高.相同基质和接种量,苜蓿丛枝定殖率显著高于其他宿主植物(表1).
2.1.4 不同处理对球囊霉素含量的影响
由表1可知,宿主为三叶草,基质Ⅲ、接种量为50/盆时,EEG含量显著高于其他处理;宿主为黑麦草和苜蓿,基质Ⅱ、接种量为50/盆时,EEG含量显著高于其他处理.宿主不同,基质和接种量相同,三叶草的EEG含量显著高于其他宿主植物;黑麦草的EEG含量显著低于其他宿主植物.
以三叶草为宿主的TEG含量显著高于黑麦草和苜蓿,基质Ⅲ、接种量50/盆时达最大值,显著高于其他处理.
2.2 宿主植物生长状况
由表2可知,三叶草地下部干质量在不同接种量间存在显著差异;地上部干质量,在不同接种量间差异不显著;基质Ⅲ的地下部干质量显著高于基质Ⅰ和基质Ⅱ.随接种量增加,地下、地上部黄酮含量提高;不同基质相同接种量,地下、地上部黄酮含量在基质Ⅲ达最大值,显著高于其他基质.基质Ⅲ、接种量为50/盆时,三叶草地下、地上部黄酮含量均达最大值.
不同接种量,黑麦草地上、地下部干质量差异不显著;地下部黄酮含量在接种量为30/盆时,达最大值;地上部黄酮含量在接种量为50/盆时达最大值.相同接种量不同基质,基质Ⅲ的地上、地下部干质量及地上部黄酮含量显著高于其他基质;地下部黄酮含量在基质Ⅱ最高.黑麦草地下部干质量在基质Ⅲ、接种量为30/盆时达最大值;地上部干质量、黄酮含量在基质Ⅲ、接种量为50/盆时达最大值;地下部黄酮含量在基质Ⅱ、接种量为30/盆时达最大值.
相同基质不同接种量,苜蓿地上、地下部干质量差异不显著;地上部黄酮含量在接种量为50/盆时达最大值.相同接种量不同基质,苜蓿地上、地下部干质量及黄酮含量差异显著.苜蓿地下部干质量在基质Ⅲ、接种量10/盆时达最大值;地上部干质量、黄酮含量在基质Ⅲ、接种量50/盆时达最大值;基质Ⅱ、接种量30/盆时,其地下部黄酮含量显著高于其他处理.?

表2 不同处理条件下宿主植物生长状况Tab.2 Growth condition of host plants in different treatments
2.3 AM真菌与宿主植物生长指标相关性分析
由表3可知,孢子密度与地下黄酮含量极显著正相关,与地下干质量、TEG和EEG显著正相关;泡囊定殖率与地下干质量极显著正相关,与孢子密度显著相关;丛枝定殖率与孢子密度极显著相关,与地下干质量和黄酮含量、TEG和EEG显著相关;总定殖率与地下干质量、孢子密度极显著相关,与地下黄酮含量显著相关.
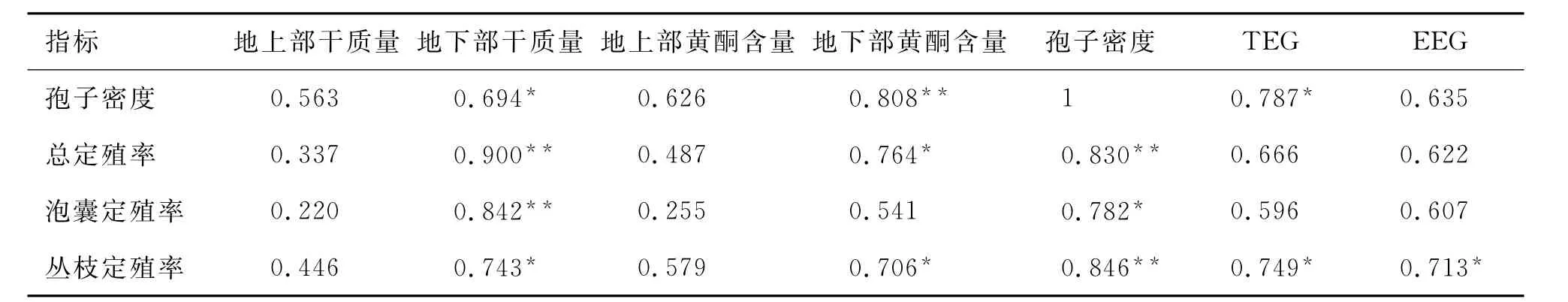
表3 AM真菌与三叶草的相关性Tab.3 Relativity analyses between AM fungi and Triflium repens
由表4可见,孢子密度与地上和地下干质量、地下黄酮、EEG、TEG正相关,与地上黄酮含量负相关;总定殖率与地上黄酮含量、TEG负相关,与其他指标正相关;泡囊定殖率与孢子密度显著正相关,与地上黄酮负相关;丛枝定殖率与孢子密度显著正相关,与地上黄酮含量负相关.

表4 AM真菌与黑麦草的相关性Tab.4 Relativity analyses between AM fungi and Lolium perenne
由表5可知,孢子密度与地上干质量和黄酮含量负相关,与地下干质量和黄酮含量,EEG,TEG正相关;总定殖率与地上黄酮含量负相关,与其他指标正相关;泡囊定殖率与EEG,TEG显著负相关,与孢子密度正相关;丛枝定殖率与孢子密度显著正相关,与地上黄酮负相关.

表5 AM真菌与苜蓿的相关性Tab.5 Relativity analyses between AM fungi and Medicago sativa
3 讨论
实验结果表明,3种宿主植物均能与网状球囊霉形成良好共生关系.相同基质及接种量,黑麦草最高定殖率达83.9%,苜蓿为65.1%,三叶草为55.6%;黑麦草孢子密度最高为35.3/g,苜蓿次之,三叶草最低;黑麦草琥珀酸脱氢酶活性显著高于其他宿主植物,达65.3%.说明网状球囊霉繁殖的最佳宿主植物为黑麦草.
网状球囊霉孢子密度高的处理,植物生物量相对较高.宿主地下生物量及黄酮含量与孢子密度、泡囊定殖率、丛枝定殖率和总定殖率正相关,即根部发达的处理,孢子密度、定殖率高.说明AM真菌在一定程度上可以促进植物根系生长[1-8].黑麦草的孢子密度与地上黄酮含量负相关,苜蓿的孢子密度与地上干质量及黄酮含量负相关,说明网状球囊霉并没有提高黑麦草和苜蓿地上生物量.黑麦草的球囊霉素含量低于其他宿主植物.说明AM真菌产生球囊霉不仅与孢子密度有关,还受到宿主植物的影响.球囊霉素是由AM真菌产生的一种含金属离子的糖蛋白,对维护AM真菌本身的生物及生理功能极为重要[4,10],可以间接反映孢子生活状态及繁殖情况.本实验中,三叶草更有利于网状球囊霉产生球囊霉素.
研究表明,培养基质对网状球囊霉孢子繁殖量、菌丝量、定殖率均有影响.Gaur and Adholeya[9]研究发现,在基质中加入沙、珍珠粉、木炭粉、黏性砖粉等,AM真菌繁殖体数量增加了40%~50%;陈宁等[7]发现,以高粱为宿主接种摩西球囊霉,最佳培养基质是加入沙的量与壤土体积比为1∶1.本实验选取的3种基质中,最佳培养基质为沙、壤土、草炭、陶粒体积比2∶2∶1∶2的基质.相同接种水平及宿主植物,基质Ⅲ孢子密度、丛枝、泡囊及总定殖率最高,SDH活性显著高于其他基质,说明基质Ⅲ适合于网状球囊霉繁殖和培养.基质Ⅱ的孢子密度及定殖率显著低于基质Ⅲ,但基质Ⅱ的TEG含量和EEG含量显著高于基质Ⅲ.说明不同基质对AM真菌产生球囊霉素有影响.
本实验没有采用接种剂,而是将网状球囊霉孢子直接接种到基质中,从而达到扩繁的目的.目前,对于这一研究未见报道.本实验中,随接种量增加,孢子密度、定殖率显著提高,接种量为50/盆的孢子密度最高,达35.3/g;孢子密度高的处理,相对应的定殖率和SDH活性也显著高于其他处理;相同宿主植物,球囊霉素含量在接种量为50/盆时达最大值.说明孢子接种量为50/盆是最佳水平.本实验只选取了10,30,50/盆3个接种量,继续增加孢子接种量,孢子密度和定殖率是否会增加,还需进一步研究.
由相关性分析可知,球囊霉素含量与孢子密度正相关,即球囊霉素与AM真菌生长密切相关[4,8,10].黑麦草的总定殖率与球囊霉素含量负相关,原因可能是AM真菌繁殖会经过不同阶段,当处于菌丝侵染阶段,其孢子分泌的球囊霉素量会相对减少.
综合实验结果可知,安国黄芩AM真菌优势种——网状球囊霉扩繁的最佳宿主植物为黑麦草,最佳培养基质是沙、壤土、草炭、陶粒体积比为2∶2∶1∶2,最适孢子接种量为50/盆.
[1] 刘润进,李晓林.丛枝菌根及其应用[M].北京:科学出版社,2000:1-224.
[2] 杨晓红,孙中海,邵菊芳,等.丛枝菌根真菌培养方法研究进展[J].菌物学报,2004,23(3):444-456.
YANG Xiaohong,SUN Zhonghai,SHAO Jufang,et al.Advance of cultural methods for arbuscular mycorrhizal fungi.[J].Mycosystema,2004,23(3):444-456.
[3] 贺学礼,李君,高爱霞,等.不同宿主植物对丹参根围土著AM真菌生长发育的影响[J].河北大学学报:自然科学版,2009,29(5):533-537.
HE Xueli,LI Jun,GAO Aixia,et al.Effects of different host plants on the development of AM fungi in the rhizospere ofSalviamiltiorrhiza[J].Journal of Hebei University:Natural Science Edition,2009,29(5):533-537.
[4] 贺学礼,马丽,王平.AM真菌和施P量对黄芩生长养分吸收和微量元素的影响[J].中国中药杂志,2011,36(16):2170-2175.
HE Xueli,MA Li,WANG Ping.Effects of AM fungi on growth and microelement ofScuteliariabaiealensisunder different applied phosphorous levels[J].China Journal of Chinese Materia Medica,2011,36(16):2170-2175.
[5] 刘广富,赵方贵,侯丽霞,等.摩西球囊霉优良繁殖基质的筛选[J].中国农学通报,2012,28(09):169-174.
LIU Guangfu,ZHAO Fanggui,HOU Lixia,et al.Screening of the superior culture substrates forGlomousmosseae[J].Chinese Agricultural Science Bulletin,2012,28(09):169-174.
[6] 陈宁,王幼珊,蒋家珍,等.培养基质对丛枝菌根(AM)真菌生长发育的影响[J].农业工程学报,2007,23(9):205-207.
CHEN Ning,WANG Youshan,JIANG Jiazhen,et al.Effects of culture substrates on development of arbuscular mycorrhizal fungi[J].Transactions of the CSAE,2007,23(9):205-207.
[7] 曾端香,袁涛,王莲英.AM真菌接种剂与栽培基质对牡丹容器苗丛枝菌根侵染的影响[J].中国农学通报,2011,27(10):108-112.
ZENG Duanxiang,YUAN Tao,WANG Lianying.The effects of AM fungus and culture substrates on colonization of arbuscular mycorrhizal for tree Peony Container seedling[J].Chinese Agricultural Science Bulletin,2011,27(10):108-112.
[8] 张翔鹤,贺学礼,王雷.金银花根围AM真菌分布与土壤碳氮关系[J].河北大学学报:自然科学版,2011,31(5):522-527.
ZHANG Xianghe,HE Xueli,WANG Lei.Research of AM fungal distribution and the relationship with soil carbon and nitrogen in the rhizosphere ofLonicerajaponica[J].Journal of Hebei University:Natural Science Edition,2011,31(5):522-527.
[9] GAUR A,ADHOLEYA A.Effects of the particle size of soilless substrates upon AM fungus inoculum production[J].Mycorrhiza,2000,10(1):43-48.
[10] 贺学礼,许珂,郭辉娟.黄芩根围AM真菌分布与土壤碳氮相关性研究[J].河北农业大学学报,2011,34(5):63-68.HE Xueli,XU Ke,GUO Huijuan.Relationship between distribution of AM fungi in the rhizosphere ofScutellariabaicalensisand soil C and N[J].Journal of Agricultural University of Hebei,2011,34(5):63-68.
[11] 李佳,李国庆,苏力坦阿巴白克力.超声波法提取短毛柳中总黄酮[J].生物技术,2008,18(5):38-40.
LI Jia,LI Guoqing,SULTAN ABABAKERY.Extraction methods of flavonoids from Tamarix.Karelini Bge.[J].Biotechnology,2008,18(5):38-40.
[12] SMITH S E,READ D J.Mycorrhizal Symbiosis[M].San Diego:Academic Press,1997.
[13] PHILLIPS J M,HAYMANDS.Improved procedures for clearing roots and staining parasitic and vesicular arbuscular mycorrhizal fungi for rapid assessment of infection[J].Transactions of British Mycorrhizal Society,1970,55:158-161.
[14] WRIGHT S F,UPADHYAYA A.A survey of soils for aggregate stability and glomalin,aglycoprotein produced by hyphae of arbuscular mycorhizal fungi[J].Plant and Soil,1998,198(1):97-107.
[15] JANOS D P,GARAMSZEGI S,BELTRAN B.Glomalin extraction and measurement[J].Soil Biology and Biochemistry,2008,40(3):728-739.
[16] SMITH S E,GIANIN A V.Phosphate uptake and vesicular arbuscular activity in mycorrhizalAlliumcepaL.:Effect of photon irradiance and phosphate nutrition[J].Austr J Plant Physiol,1990,17:177-188.
(责任编辑:赵藏赏)
Culture of Glomus reticulatumin the rhizospereo of Scutellaria baicalensis
HE Xueli,WANG Meng
(College of Life Sciences,Hebei University,Baoding 071002,China)
Effects of different conditions on the growth ofG.reticulatumwas studied in pot culture in the experiment.The purpose was to establish the optimal culture system ofG.reticulatum.The results showed that there was appreciable impact in different host plants,culture substrates and inoculum concentrations.When the treatment wasLoliumperenneas host plant,culture substrateⅢand 50inoculum concentrations,the spore density was 35.3spores per gram of soil,the total colonization was 83.9%,vesicular colonization was 64.8%,arbuscular colonization was 4.7%,the activity of SDH was appreciable different with others.With the increasing of inoculum concentration,there was significant improvement among the activity of SDH,spore density,colonization and content of Flavonoids.The activity of SDH,spore density,colonization and content of Flavonoids and the growth of host plant was the highest in culture substrateⅢ.Both spore density and colonization ofG.reticulatumshowed a positive correlation with the dry height of root,content of Flavonoids,EEG and TEG.This claimed that the growth of plants was directly impacted by AM fungi,and the function of AM fungi was to promote the growth of plants.Theoptimal culture system wasL.perenneas host plant,culture substrateⅢ(sand)∶(soil)∶(turf)∶(ceramsite)=(2∶2∶1∶2)and 50inoculum concentrations.
Scutellariabaicalensis;Glomusreticulate;host plant;culture substrate;inoculum con-centration
Q939.96;Q948
A
1000-1565(2013)03-0280-07
10.3969/j.issn.1000-1565.2013.03.011
2012-06-16
河北省自然科学基金资助项目(C2010000273)
贺学礼(1963-),男,陕西蒲城人,河北大学教授,博士,主要从事药用植物及菌根生物技术研究.
E-mail:xuelh1256@yahoo.com.cn
