胃癌组织podoplanin的表达及其与淋巴结转移关系的研究
2013-06-22罗庆伟田小林蒋志庆
罗庆伟,田小林,蒋志庆,林 静
在世界范围内,胃癌发病率位居所有恶性肿瘤的第2位。淋巴结转移是导致胃癌治疗失败和死亡的主要原因,是胃癌最重要的预后影响因素。约60%的可切除胃癌在确诊时已经发生了淋巴结转移,进展期胃癌总的5年生存率不足20%,但目前的研究对于胃癌淋巴结转移的分子机制知之甚少。淋巴结转移是胃癌的最主要转移方式及导致术后复发的原因之一[1],影响着胃癌患者的预后。肿瘤淋巴结转移与淋巴管生成关系密切,淋巴结转移率即转移淋巴结数与检出淋巴结数的比值,与患者预后有相关性,淋巴结转移率升高提示患者预后较差[2]。podoplanin是一种小分子黏液样跨膜糖蛋白,主要表达于淋巴管内皮细胞,为淋巴管特异性标志物,可用以区分微淋巴管和微血管。本研究采用免疫组化方法检测患者胃癌组织、癌旁组织及胃正常组织淋巴管podoplanin表达情况,探讨podoplanin在胃癌淋巴结转移中的作用。
1 材料与方法
1.1 实验材料 选取桂林医学院附属医院病理科2009年1月—2010年2月收治的胃癌患者54例,均有完整的病历资料且经病理学检查确诊;收集其手术切除的胃癌组织、癌旁组织存档蜡块及同期10例健康体检者的正常胃组织蜡块作为实验材料。胃癌组织蜡块须包含癌中央区 (癌内)及胃癌组织与周围正常组织交界区 (癌周),且患者术前未接受过化疗。54例胃癌患者中男36例,女18例;年龄30~90岁,平均55.7岁;低分化腺癌18例,中分化腺癌24例,高分化腺癌12例;有淋巴结转移30例,无淋巴结转移24例;2003年国际抗癌联盟 (UICC)胃癌TNM分级:Ⅰ级13例,Ⅱ级18例,Ⅲ级14例,Ⅳ级9例。
1.2 仪器与试剂 Shandon切片机 (型号:Finesse325),隔水式电热恒温培养箱 (型号:PHY-DHS-600-B),OLYMPUS正置荧光显微镜 (型号:BX51),OLYMPUS光学显微镜(型号:CH30),Thermo Electron Finnpipette转移器 (型号:Z46607),抗podoplanin单克隆抗体 (购自Santa Cruz Biotechnology公司),免疫组化PV-9000试剂盒和二氨基联苯胺(DAB)试剂盒 (购自北京中杉金桥生物技术有限公司)。
1.3 免疫组化染色 (1)采用辣根过氧化酶标记的SP法,实验材料经10%甲醛固定后,常规制作石蜡包埋块并切片,切片厚度为4~6 μm,常规脱蜡至水,枸橼酸盐高温高压法抗原修复;(2)3%的H2O2室温孵育10 min,以阻断内源性过氧化物酶;(3)磷酸盐缓冲液 (PBS)冲洗后,滴加抗podoplanin抗体 (1∶100倍稀释),4℃冰箱过夜;(4)滴加聚合物辅助剂,室温孵育20 min,辣根过氧化酶标记二抗,室温处理30 min;(5)用PBS冲洗,DAB显色,复染后封片。
1.4 结果判定与淋巴管计数方法 podoplanin的着色部位位于细胞膜。主要表达于由单层内皮细胞构成且管壁较薄,外周无周细胞且无平滑肌的淋巴管,其管腔内无红细胞,有的管腔内可见絮状物,用400倍视野的光镜进行形态学判定之后,podoplanin染色阳性的微脉管皆为淋巴管。podoplanin染色阳性标记的脉管数视为微淋巴管密度 (LMVD)。微淋巴管计数采用Weidner计数方法[3],先在低倍镜 (×40)下确定5个管腔着色最密集的区域,然后在200倍光镜下观察染成棕色的单个细胞和细胞丛,并以此作为一个微淋巴管。计数5个视野的微淋巴管的数目,取其平均值作为LMVD,癌周淋巴管密度(LMVDpt)定义为距离胃癌组织边缘100 μm以内的周边区域内podoplanin阳性表达的微淋巴管数。
1.5 统计学方法 采用SPSS 17.0统计软件进行统计学分析,计量资料以 (x±s)表示,组间比较采用t检验、t'检验及方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 podoplanin在正常胃组织、胃癌组织、癌旁组织的表达免疫组化染色结果显示,正常胃组织podoplanin阳性染色微淋巴管在黏膜固有层、黏膜下层、肌层及浆膜层均可见到,在黏膜下层数目最多,且呈扩张状、壁薄、形态大小不一。在胃癌组织和癌旁组织中淋巴管内皮细胞均可见到podoplanin的阳性表达。胃癌癌细胞、正常胃组织细胞、血管内皮细胞对podoplanin免疫组化染色均无反应 (见图1~3)。
2.2 胃癌组织、癌旁组织、正常胃组织LMVD的比较 在胃癌组织中,可以观察到podoplanin染色阳性的淋巴管多位于癌旁组织及胃癌组织中,但数目及形态差异性大,癌周微淋巴管数目多且管腔多扩张;而癌内微淋巴管数目少,且多为闭锁的条索状,或呈狭长的裂隙状。podoplanin染色阳性的淋巴管在正常组织中少见。
胃癌组织和癌旁组织的LMVD〔(9.19±2.48)、(18.19±4.22)〕均高于正常胃组织的 (5.60±0.84) (t=4.50,9.34;P<0.01);癌旁组织的LMVD又高于胃癌组织 (t=13.5,P<0.01)。同时胃癌组织中有淋巴结转移的LMVD高于无淋巴结转移,癌旁组织中有淋巴结转移的LMVDpt也高于无淋巴结转移,差异有统计学差异 (P<0.05,见表1)。
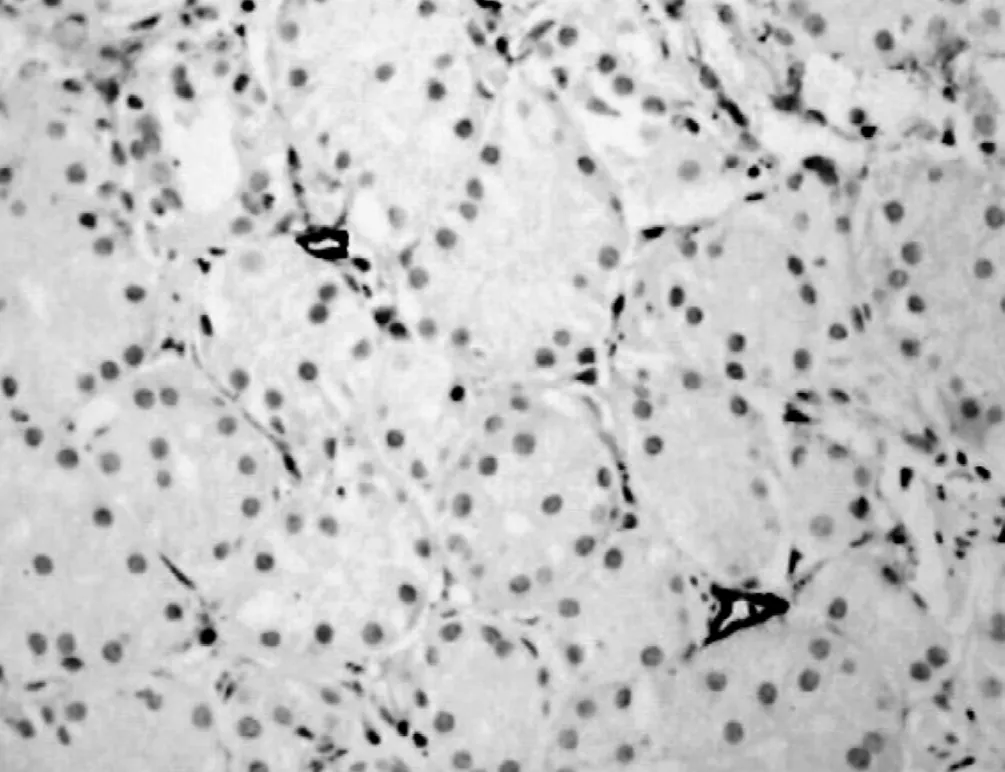
图1 正常胃组织中的淋巴管 (SP,×400)Figure 1 Lymphatic in normal gastric tissues

图2 胃癌组织中的淋巴管 (SP,×400)Figure 2 Lymphatic in cancerous tissues
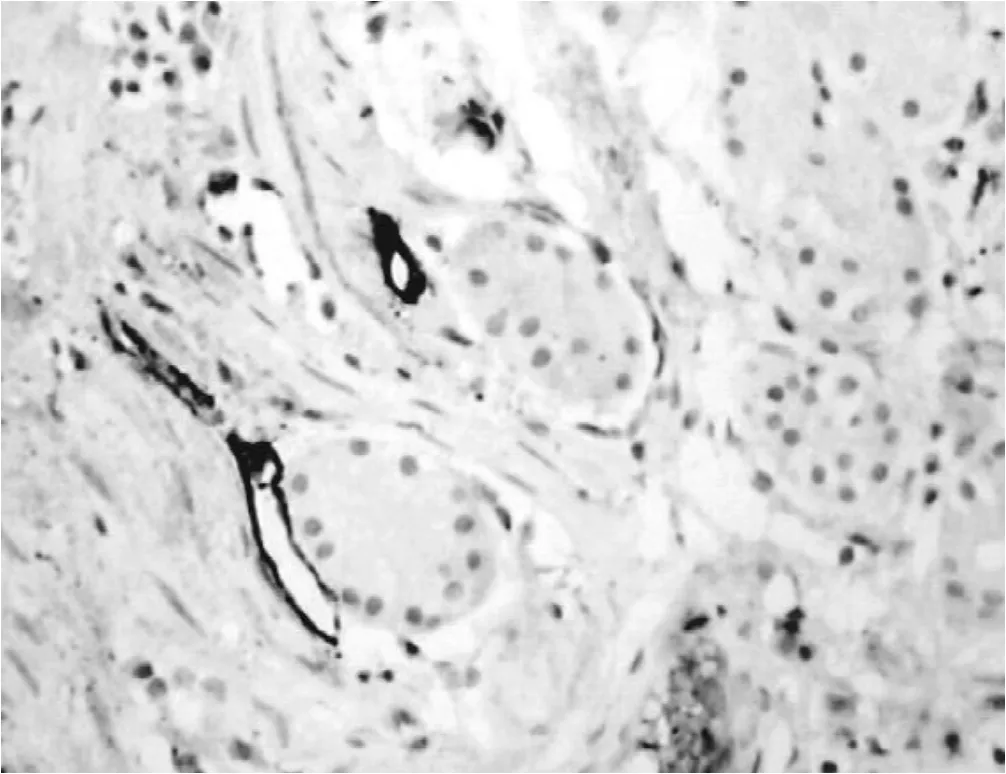
图3 癌旁组织中的淋巴管 (SP,×400)Figure 3 Lymphatic in pericancerous gastric tissues
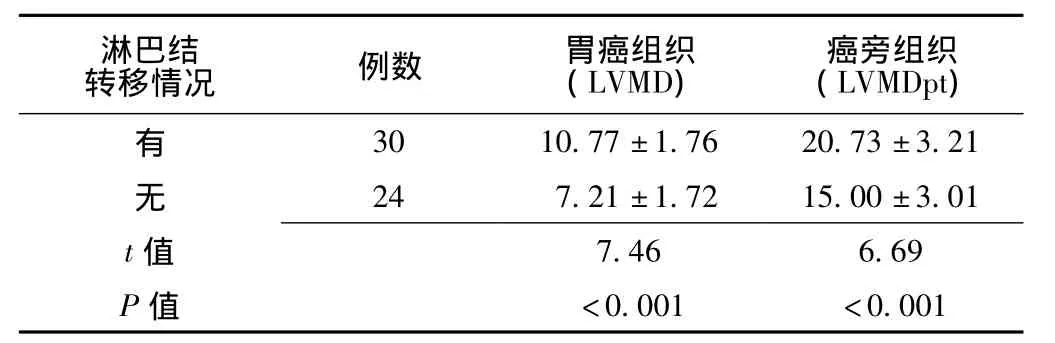
表1 不同淋巴结转移情况胃癌组织及癌旁组织podoplanin表达情况比较Table 1 Comparison of the expression of podoplanin between cancer tissues and paracancerous tissues with different lymph node metastasis
3 讨论
肿瘤淋巴结转移机制研究的关键问题是淋巴管的识别,因为淋巴管在形态上与小血管很相似,而肿瘤组织内部的淋巴管和血管由于受到肿瘤细胞的侵袭和破坏使得它们在形态上更加难以区别,导致肿瘤淋巴管的研究落后于血管的研究。随着淋巴管内皮特异性标记物的发现及应用,使得淋巴管更易于观察识别及与血管进行区分,从而使对肿瘤淋巴管的进一步研究成为可能。目前认为,比较特异的淋巴管内皮细胞标记物有VEGFR-3、LYVE-1、podoplanin、Prox-1及5'-核苷酸酶等。
podoplanin与肾小球上皮足细胞扁平化有关而得名[4]。其是一种相对分子质量为38×103的Ⅰ型跨膜糖蛋白,由162个氨基酸构成[5]。podoplanin主要表达在淋巴管内皮上,而在血管内皮上不表达,是淋巴内皮细胞的特异性标志物[6-7]。免疫荧光标记法发现,97%以上淋巴管均特异性地被podoplanin标记[8]。
本研究中,通过免疫组化方法,可以观察到:podoplanin阳性表达在管壁较薄且不规则,管腔较大,通常呈塌陷状的管道上,内无红细胞,由核大且向腔内突出的单层内皮细胞构成,这符合毛细淋巴管的典型形态特征。淋巴管的这些特点使其更容易被癌细胞侵袭和破坏。随着肿瘤体积的增大,瘤周组织内淋巴管不同程度的增加,同时瘤组织间隙水肿明显,导致淋巴管更加扩张,使肿瘤细胞易于通过淋巴结转移[9]。淋巴管的生成与淋巴结转移关系密切[10]。关于淋巴结转移的机制目前仍不清楚,特别是关于胃癌组织中淋巴管的数量、密度是否增加,是否存在淋巴管的新生等问题仍存在较大争议。
本研究通过对54例胃癌的研究发现,癌旁组织的LMVD明显高于胃癌组织。淋巴结转移组的胃癌组织及癌旁胃组织的LMVD分别明显高于无淋巴结转移组的胃癌组织及癌旁胃组织。正常胃组织的LMVD明显低于胃癌组织和癌旁组织。
本研究表明,微淋巴管的“热点”区域绝大多数位于癌周边部;癌周组织中的淋巴管的密度明显增加,尤其在淋巴结转移组中增加更为明显。认为可能是两方面的原因引起的:(1)癌细胞产生大量的淋巴管生成因子如血管内皮细胞生长因子 (VEGF)-A、VEGF-C、VEGF-D刺激淋巴管的生成,其VEGF-A通过表达于淋巴管内皮的血管内皮细胞生长因子受体 (VEGFR)-2介导淋巴管生成[11]。VEGF-C、VEGF-D通过旁分泌机制与肿瘤周围间质内或存在于原有淋巴管内皮的VEGFR-3结合,诱导VEGFR-3酪氨酸激酶磷酸化,进而促进了内皮细胞的增殖和迁移,导致新的淋巴管生成以及原有淋巴管的分支和出芽,造成了淋巴管数量和密度的增加[12]。(2)肿瘤细胞自身能分泌促淋巴管生成蛋白podoplanin,促进肿瘤性淋巴管新生,从而促进肿瘤淋巴结转移[13-15]。本研究中podoplanin在胃癌中的表达,可能参与了胃癌组织及癌旁内淋巴管的形成。癌细胞由这些增多的淋巴管向外播散和转移,这可能是癌细胞沿淋巴结转移的机制之一。同时,podoplanin也可作为肿瘤细胞的血小板聚集介导因子[16-18]而发挥作用,能促进肿瘤细胞迁移及增加肿瘤细胞侵袭力。已有研究表明,用podoplanin评估口腔鳞癌[19]、食管癌[20]的淋巴管生成,可以预测淋巴结转移和患者的预后。肿瘤组织的LMVD可从一个侧面反映出肿瘤组织和肿瘤细胞的微环境状态,对肿瘤细胞的增殖、生长、侵袭和转移起着至关重要的作用。通过抑制和阻断podoplanin的表达,减少新生淋巴管形成,进而抑制肿瘤的增殖、浸润、转移成为新的治疗思路。
综上所述,podoplanin在胃癌组织的表达,胃癌组织及癌旁的高LMVD增加了胃癌淋巴结转移的风险,在胃癌组织podoplanin是否能做预测评估还待研究。相信,随着研究的深入与资料的不断完善,podoplanin与胃癌的淋巴结转移的规律和机制将被阐明。
1 王昭,詹文华,何裕隆,等.胃癌患者N2淋巴结转移和腹膜扩散的相关因素和预后分析[J].中国普通外科杂志,2006,15(9):645-649.
2 Nitti D,Marchet A,Olivieri M,et al.Ratio between metastatic and examined lymph nodes is an independent prognostic factor after D2 resection for gastric cancer:analysis of alarge European monoinstitutional experience [J].Ann Surg Oncol,2003,10(9):1077-1085.
3 Weidner N.Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors[J].Breast Cancer Res Treat,1995,36(2):169-180.
4 Breiteneder-Geleff S,Matsui K,So-leiman A,et al.Podoplanin,novel 43-kd membrane protein of glomerular epithelial cells,is downregulated in puromycin nephrosis [J].Am J Pathol,1997,151(4):1141-1152.
5 Fujii T,Zen Y,Sato Y,et al.Podoplanin is a useful diagnostic markerfor epithelioid hemangioendothelioma of the liver[J].Mod Pathol,2008,21(2):125-130.
6 Martin-Villar E,Scholl FG,Gamallo C,et al.Characterization of human PA2.26 antigen(T1alpha-2,podoplanin),a small membrane mucin induced in oral squamous cell carcinomas [J].Int J Cancer,2005,113(6):899-910.
7 Ordonez NG.The diagnostic utility of immunohistochemistry in distinguishing between epithelioid mesotheliomas and squamous carcinomas of the lung:a comparative study [J].Mod Pathol,2006,19(3):417-428.
8 Schoppmann SF,Bayer G,Aumayr K,et al.Prognostic value of lymphangiogenesis and lymphovascular invasion in invasive breast cancer[J].Ann Surg,2004,240(2):306-312.
9 Li JM,Han JS,Huang Y,et al.A novel gene delivery system targeting cells expressing VEGF receptors[J].Cell Res,1999,9(1):11-25.
10 Nakaya H,Kawashiri S,Tanaka A,et al.Influences of angiogenesis and lymphangiogenesis on cancerous invasion in experimentally induced tongue carcinoma[J].J Oral Pathol Med,2005,34(2):87-92.
11 Kafiehuber E,Breiteneder GS,Greeger M,et al.Isolation and eharctefization of dermal lymphatic and blood endothelial cells reveal stable and functionally specialized cell lineages [J].J Exp Med,2001,194(6):797-808.
12 Shibuya M,Claesson-Welsh L.Signal transduction by VEGF receptors in regulation of angiogenesis and lymphangiogenesis [J].Exp Cell Res,2006,312(5):549-560.
13 丁志敏,黄振录,周祥祯,等.甲状腺乳头状癌Podoplanin表达与淋巴道转移关系的研究 [J].广西医科大学学报,2010,27(1):32-33.
14 Schacht V,Ramirez MI,Hong YK,et al.T1 alpha/Podoplanin deficiency disrupts normal lymphatic vasculature formation and causes lymphedema [J].EMBO J,2003,22(14):3546-3556.
15 Raica M,Raica M,Ribatti D,et al.Podoplanin expression in advanced-stage gastric carcinoma and prognostic value of lymphatic microvessel density[J].Neoplasma,2008,55(5):455-460.
16 Kato Y,Kaneko M,Sata M,et al.Enhanced expression of Aggrus(T1 alpha/podoplanin),a platelet-aggregation-inducing factor in lung squamous cell carcinoma [J].Tumour Biol,2005,26(4):195-200.
17 Kaneko MK,Kato Y,Kitano T,et al.Conservation of a platelet activating domain of Aggrus/podoplanin as a platelet aggregation-inducing factor[J].Gene,2006,378(1):52-57.
18 Kaneko MK,Kato Y,Kameyama A,et al.Functional glycosylation of human podoplanin:glycan structure of platelet aggregation-inducing factor [J].FEBS Lett,2007,581(2):331.
19 Yuan P,Temam S,El-NaggarA,et al.Overexpression of podoplanin in oral cancer and its association with poor clinical outcome [J].Cancer,2006,107(3):563-569.
20 Nakayama Y,Matsumoto K,Nagato M,et al.Significance of lymphangiogenesis as assessed by immunohistochemistry for podoplanin in patients with esophageal carcinoma [J].Anticancer Res,2007,27(1B):619-625.
