糖基化终产物对雪旺细胞体外功能的影响及其机制的研究
2013-06-22张临洪
张 媚,张临洪
糖尿病周围神经病变是糖尿病最常见的并发症之一,其机制尚不明确[1-2]。雪旺细胞是周围神经髓鞘细胞,可以分泌多种神经营养因子,有维持神经元存活、促进轴突生长的作用,其在糖尿病周围神经病变发生发展中的作用已经得到广泛关注[3]。糖基化终产物 (advanced glycation end products,AGEs)是长期的高血糖状态经非酶糖化和脂质氧化等一系列反应和结构重排所形成的非酶类物质[4],与AGEs特异性受体 (receptor of advanced glycation end product,RAGE)结合后,激活并诱发一系列促炎、促凝血反应,参与到糖尿病的神经、视网膜、血管、肾脏等多种并发症发生发展中[5]。在人类糖尿病患者和实验糖尿病动物的外周神经中都检测到了AGEs的存在[6]。然而AGEs对于雪旺细胞的功能究竟有何影响,AGEs是否通过影响雪旺细胞的功能参与糖尿病周围神经病变,目前并不清楚。本研究初步探讨AGEs对于原代培养的雪旺细胞的增殖迁移等功能的影响及机制,以期为糖尿病周围神经病变提供新的潜在治疗靶点。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物 预备新生3 d的雄性SD乳鼠,由华中科技大学同济医学院实验动物中心提供。
1.1.2 主要试剂 2%胶原酶、0.25%胰酶、DMEM培养基和胎牛血清 (FBS)购于GIBCO公司;凋亡检测试剂盒购于BD公司;核因子κB(NF-κB)活性检测试剂盒购于PIERCE公司;肿瘤坏死因子α(TNF-α)检测盒、白介素6(IL-6)检测试剂盒购于Peprotech公司;荧光定量聚合酶链式反应(PCR)逆转录试剂盒和PCR试剂盒购于Takara公司;兔抗鼠Caspase-3抗体和羊抗兔二抗购于Cell Signaling Technology公司。
1.2 方法
1.2.1 原代分离纯化雪旺细胞 乳鼠脱颈椎处死,75%乙醇消毒,暴露坐骨神经,剥离其外膜,将神经纤维剪成1 mm的小段,置于2%胶原酶和0.25%胰酶等量混合液中消化20 min,然后弃去消化酶,反复吹打洗涤,用含20%FBS的DMEM培养液重悬细胞,接种于培养板中,每3 d换1次液,观察细胞生长情况。采用免疫细胞化学染色法行雪旺细胞标志蛋白S100染色鉴定。
1.2.2 制备AGEs 牛血清清蛋白 (BSA)终浓度5.0 g/L,葡萄糖终浓度50 mmol/L,充分溶于磷酸盐缓冲液 (PBS)中,过滤除菌,37℃避光孵育3个月,除去未结合的葡萄糖;同法制备不含葡萄糖的BSA作为阴性对照,荧光分光光度计鉴定AGEs。
1.2.3 细胞分组与干预 根据不同条件处理原代雪旺细胞,分为7组:分别给予不含任何刺激物的低糖DMEM培养基(空白对照组)、20 μg/ml BSA、20 μg/ml AGEs、50 μg/ml BSA、50 μg/ml AGEs、100 μg/ml BSA 和 100 μg/ml AGEs 干预细胞生长,每组实验重复3次。各组细胞用AGEs处理时,培养基中FBS水平低至5%。
为了检测促炎细胞因子在不同条件下的表达情况,原代分离的雪旺细胞分别予以不含任何刺激物的低糖DMEM培养基(空白对照)、50 μg/ml BSA、50 μg/ml AGEs 和 50 μg/ml AGEs+10 μg/ml抗RAGE抗体干预,共分为4组,每组实验重复3次。
1.2.4 噻唑蓝 (MTT)法检测细胞增殖能力 消化、收集雪旺细胞,调整细胞浓度为2×105/ml。按照上述分组予以干预因素,将各组细胞接种到96孔板,每孔200 μl细胞悬液,继续培养48 h后,每孔加入20 μl的MTT液体,4 h后弃去上清液,每孔加入二甲基亚砜150 μl,充分振荡10 min,置酶标仪于波长490 nm处检测各组OD值。OD值越大,表示细胞增殖能力越强。
1.2.5 Millcell小室检测细胞迁移能力 在Millicell细胞培养小室中进行,消化、收集及干预因素等同细胞增殖能力检测,每组3个复孔,24板孔内小室下为含血清浓度为5%的DMEM培养基,上室分别加入200 μl细胞浓度为105/ml的细胞悬液。孵育24 h后用4%多聚甲醛固定,拭去膜上层的细胞,结晶紫染色,显微镜下观察,计算迁移的细胞数。每孔随机取6个视野计数,计算均数。
1.2.6 雪旺细胞凋亡的检测 消化、收集、设复孔及干预因素等同细胞增殖能力检测,调整细胞浓度为2×105/ml,吸取500 μl细胞悬液,1 000×g离心5 min,弃去上清液,加入195 μl Annexin V-FITC结合液 (1×)重悬细胞,再加入5 μl Annexin V-FITC,混匀,室温避光孵育15 min;1 000×g离心5 min,弃去上清液,加入190 μl Annexin V-FITC结合液重悬细胞,加入10 μl碘化丙啶 (PI)染色液,混匀后冰育避光放置;立即行流式细胞仪检测,Annexin V-FITC为绿色荧光,PI为红色荧光。细胞凋亡率=Annexin V-FITC阳性细胞数/细胞总数×100%。
1.2.7 凋亡基因Caspase-3 mRNA的表达水平 用实时荧光定量PCR法检测Caspase-3的mRNA水平:用Trizol法提取各处理组培养48 h后的细胞RNA,用Takara逆转录试剂盒逆转录为 cDNA。引物根据 GenBan cDNA序列进行设计,Caspase-3:上游为5'-CAGACAGTGGAACTGACGAT-3',下游为5'-TTTCAGCATGGCGCAAAGTG-3';内参照GAPDH:上游为 5'-CAACGGCACAGTCAAGGCTGAGA-3',下游为5'-CTCAGCACCAGCATCACCCCAT-3',反应体系 10 μl。扩增条件:首先95°C预变性30 s,然后95°C变性5 s,55°C退火,72°C延伸,循环40次,延伸阶段系统收集荧光信号,计算CT值。以GAPDH作为内参,以Caspase-3 mRNA/GAPDH mRNA来表示Caspase-3的表达水平,比值越高,则表示Caspase-3表达水平越高。
1.2.8 NF-κB及炎性因子TNF-α和IL-6的测定 采用电泳迁移率改变分析法 (electrophoretic mobility shift assay,EMSA)检测NF-κB,酶联免疫吸附试验 (ELISA)试剂盒检测雪旺细胞中炎性因子TNF-α和IL-6的表达,具体操作根据说明书进行。
1.3 统计学方法 采用SPSS 10.0软件进行统计检验。计量资料以 (x±s)表示,多组间比较行单因素方差分析(ANOVA)。检验水准α =0.05。
2 结果
2.1 雪旺细胞的分离培养 原代培养2~3 d可见少量梭形细胞贴壁生长,约2周时梭形细胞可长满培养皿。免疫细胞化学染色显示85%以上的细胞S100阳性,提示所培养细胞为雪旺细胞。
2.2 AGEs对雪旺细胞增殖、迁移能力及凋亡率的影响 不同干预条件的7组乳鼠雪旺细胞的增殖能力 (OD值表示)、迁移细胞数、凋亡率比较,差异均有统计学意义 (P<0.05),但不同浓度的BSA组间各个检测指标比较,差异均无统计学差异 (P>0.05)。(1)与空白对照组比较,各浓度BSA组干预后雪旺细胞的增殖能力比较,差异均无统计学意义 (P>0.05);但是各浓度AGEs组干预后雪旺细胞,随着AGEs浓度的增加,细胞的增殖能力减弱,两两比较差异有统计学意义(P<0.05),且与相同浓度的BSA组比较,差异亦有统计学意义 (P<0.05)。(2)各浓度BSA组迁移细胞数与空白对照组比较,差异均无统计学意义 (P>0.05);但是雪旺细胞在受到不同浓度的AGEs干预后,其细胞迁移数随着AGEs浓度的增加而减少,两两比较差异有统计学意义 (P<0.05);且与相同浓度的BSA组比较,在低浓度 (20 μg/ml)时差异无统计学意义 (P >0.05),但在 50 μg/ml、100 μg/ml AGEs干预后,其细胞迁移数较BSA组降低,差异均有统计学意义 (P<0.05)。(3)各浓度BSA组干预后凋亡率间差异无统计学意义(P>0.05),但是经不同浓度的AGEs干预后,凋亡率逐渐增高,两两比较差异有统计学意义 (P<0.05);与相同浓度的BSA组比较,各浓度AGEs组的凋亡率均增加,差异有统计学意义 (P<0.05,见表1)。
2.3 AGEs对雪旺细胞凋亡蛋白Caspase-3 mRNA表达水平的影响 原代分离的雪旺细胞经不同条件干预处理后,其Caspase-3 mRNA表达水平 (以Caspase-3 mRNA/GAPDH mRNA表示)比较,差异有统计学意义 (P<0.05)。其中各浓度BSA组Caspase-3 mRNA表达水平与空白对照组比较,差异无统计学意义 (P>0.05);而随着AGEs干预浓度的增加,Caspase-3 mRNA表达水平逐渐增高,两两比较差异有统计学意义 (P<0.05);且与相同浓度的BSA组比较,各浓度AGEs组Caspase-3 mRNA表达水平升高,差异均有统计学意义 (P<0.05,见表1)。

表1 不同浓度的BSA和AGEs干预后雪旺细胞增殖能力、迁移细胞数、凋亡率及Caspase-3 mRNA表达水平的比较 (x±s)Table 1 Comparison of cell proliferation,migration,apoptosis rate and Caspases-3 mRNA of Schwann cells in different groups of BSA and AGEs
2.4 AGEs对雪旺细胞NF-κB活性及TNF-α、IL-6水平的影响 各组雪旺细胞NF-κB活性及TNF-α、IL-6水平比较,差异均有统计学意义 (P<0.05)。其中,经BSA干预雪旺细胞后NF-κB活性及TNF-α、IL-6水平与空白对照组比较,差异均无统计学意义 (P>0.05);与BSA组比较,AGEs组NF-κB活性及TNF-α、IL-6水平升高,差异均有统计学意义 (P<0.05);而AGEs+抗RAGE抗体组的NF-κB活性及TNF-α、IL-6水平与BSA组比较,差异无统计学意义(P>0.05,见表2)。
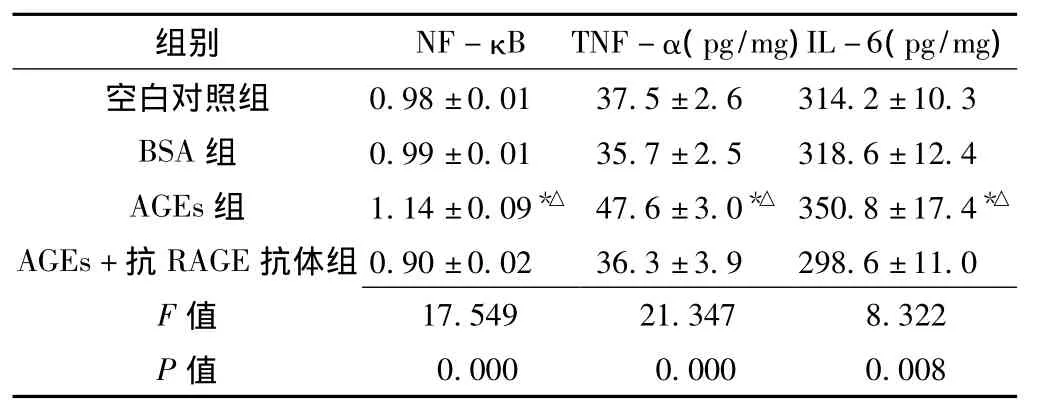
表2 雪旺细胞NF-κB活性及TNF-α、IL-6水平比较 (x±s)Table 2 Comparison of NF-κB activity and level of TNF-α and IL-6 of Schwann cells
3 讨论
人体内的AGEs分外源性和内源性两类:外源性AGEs主要来自食物及烟草;内源性AGEs是体内还原糖的羰基与蛋白质中的氨基与在无酶的条件下反应,经过一系列分子内重排而形成[7]。AGEs与其受体结合后,通过增强氧化应激、激活NF-κB信号途径等,刺激产生一系列细胞因子,这些因子在糖尿病慢性并发症的发生发展中起重要作用[8]。目前研究已经证实,AGEs参与了糖尿病血管、肾脏、视网膜等各种并发症的发生,降低了患者的生活质量[9]。近年来,AGEs对于糖尿病周围神经病变的作用也得到广泛的研究。在糖尿病患者和糖尿病实验动物的外周神经中都检测到了AGEs的存在。Migur等[10]在对8例2型糖尿病周围神经病变患者的外周神经取样研究中发现,周围神经组织中存在大量的AGEs,其中神经轴突和髓鞘处积聚最多。Wada等[11]建立的糖尿病小鼠模型中,在雪旺细胞、神经轴突和神经束膜内均发现了AGEs。
雪旺细胞是由神经嵴细胞分化而来的周围神经系统成髓鞘细胞,作为神经干内主要的非神经元活性细胞,它能够分泌多种神经营养因子,具有营养神经、趋化和促进再生神经纤维成熟的功能[12]。本研究结果显示,AGEs能够抑制体外培养的雪旺细胞的增殖、迁移能力,促进其凋亡,这就导致外周神经脱髓鞘并抑制新生神经纤维正常结构的形成。另外,当成熟的神经纤维受损时,雪旺细胞能够增生形成一个连续的柱状结构并分泌神经营养因子,诱导神经再生[13-14]。因而AGEs诱导的雪旺细胞增殖能力降低也可能导致糖尿病患者的周围神经修复能力减弱。
如前所述,AGEs与其受体结合后,通过多种途径参与到糖尿病各种慢性并发症发生发展中,增加NF-κB的活性是其重要途径之一。NF-κB是氧化应激过程中的一个关键的调控蛋白,可调控炎症反应调节蛋白的基因转录[15]。本研究结果显示,AGEs可诱导雪旺细胞中NF-κB的活性增高和炎性因子TNF-α及IL-6分泌增加,而抗RAGE抗体与AGEs同时孵育时则NF-κB的活性和炎性因子TNF-α及IL-6分泌均未见显著增高,即抗RAGE抗体阻断了AGEs的促发作用。这说明AGEs与RAGE结合后激活NF-κB,后者调控TNF-α、IL-6等炎性因子的表达,引起雪旺细胞内部一系列炎症反应,造成细胞的损伤及增殖、迁移等能力的下降。由此可见,AGEs能够通过促进炎性反应来损害雪旺细胞的功能,可能正是这种损害作用导致了患者周围神经的损伤修复能力下降和再生功能障碍。这一发现验证了AGEs参与糖尿病周围神经病变的假设,因而抑制AGEs的生成或者阻断其与RAGE的结合可能成为未来预防或治疗糖尿病周围神经病变的方向之一。
1 王国凤,徐宁,尹冬,等.糖尿病周围神经病变的诊断和治疗新进展[J].中国全科医学,2012,15(5):1661.
2 李成科.丹参粉针联合中药汤剂治疗糖尿病周围神经病变疗效观察[J].实用心脑肺血管病杂志,2012,20(3):466.
3 郭莲.高尿酸血症与糖尿病周围神经病变的相关性研究 [J].海南医学院学报,2012,18(2):189-192.
4 Sekido H,Suzuki T,Jomori T,et al.Reduced cell replication and induction of apoptosis by advanced glycation end products in rat Schwann cells[J].Biochem Bioph Res Co,2004,320(1):241-248.
5 殷汉,孙子林,王尧.羧甲基赖氨酸和可溶性糖基化终产物受体水平与2型糖尿病冠状动脉钙化相关性研究[J].中国全科医学,2011,14(2):388.
6 Stitt AW.AGEs and diabetic retinopathy [J].Invest Ophthalmol Vis Sci,2010,51(10):4867-4874.
7 魏琼,孙子林,金晖,等.氨基胍对糖基化终产物干预后人肾系膜细胞 fractalkine表达的影响 [J].中国全科医学,2012,15(9):3146.
8 Barlovic DP,Soro-Paavonen A,Jandeleit-Dahm KA.RAGE biology,atherosclerosis and diabetes[J].Clin Sci(Lond),2011,121(2):43-55.
9 Bos DC,de Ranitz-Greven WL,de Valk HW.Advanced glycation end products,measured as skin autofluorescence and diabetes complications:a systematic review [J].Diabetes Technol The,2011,13(7):773-779.
10 Misur I,Zarkovic K,Barada A,et al.Advanced glycation endproducts in peripheral nerve in type 2 diabetes with neuropathy [J].Acta Diabetol,2004,41(4):158-166.
11 Wada R,Nishizawa Y,Yagihashi N,et al.Effects of OPB-9195,anti-glycation agent,on experimental diabetic neuropathy [J].Eur J Clin Invest,2001,31(6):513-520.
12 Magnaghi V,Procacci P,Tata AM.Novel pharmacological approaches to Schwann cells as neuroprotective agents for peripheral nerve regeneration [J].Int Rev Neurobiol,2009,87:295-315.
13 Lehmann HC,Hoke A.Schwann cells as a therapeutic target for peripheral neuropathies [J].CNS Neurol Disord Drug Targets,2010,9(6):801-806.
14 金毅,罗永湘,李伟.自体雪旺细胞促周围神经端侧吻合轴突侧支发芽的实验研究 [J].中华实验外科杂志,2003,20(2):155-157.
15 吕海燕,王沁,张曦.肿瘤坏死因子α和白介素6及核因子κB在酒精性肝病患者血清中的表达及意义 [J].中国全科医学,2011,14(7):2405.
