右美托咪啶在烟雾病颞肌贴敷手术麻醉中的应用
2013-06-15周强,陈君,梁禹
周 强,陈 君,梁 禹
(天津环湖医院,天津300060)
烟雾病是一种慢性脑血管病,目前治疗手段多以外科治疗为主。手术通过重建颅内外血管来实现脑血流动力学障碍的改善,同时降低术后卒中发生率。颞肌贴敷术是间接血管重建手术的常用外科手术术式,麻醉时应力求平稳,避免出现术中体动;术中镇静、镇痛充分、保持稳定的血流动力学状态;控制呛咳、寒战等麻醉恢复期并发症,防止出现颅内压的骤升。右美托咪啶是一种高选择性α2肾上腺素能受体激动剂,可抑制交感神经活性、镇静、镇痛以及抗焦虑作用,不良反应少且轻。本研究对右美托咪啶在颞肌贴敷手术全身麻醉中的应用及效果进行评估。
1 资料与方法
1.1 临床资料 随机选择2010年2月~2012年6月天津环湖医院行择期颞肌贴敷术治疗烟雾病患者60例,年龄32~54岁,身高150~180 cm,体质量45~90 kg,ASAⅠ ~Ⅲ级,无癫痫、出凝血障碍等病史,无长期服用镇痛药物、抗抑郁药物史。随机分为右美托咪啶组(D组)和生理盐水组(S组),每组30例。
1.2 方法
1.2.1 实验方法 患者常规禁食水,术前30 min肌注阿托品0.5 mg、苯巴比妥钠0.2 mg,入室后开放上肢静脉,输注乳酸钠林格液[20 mL/(h·kg)],予面罩吸氧。采用 Primus麻醉机(德国 Dräger公司),监测心电图、平均动脉压(MAP)、呼气末二氧化碳分压(PETCO2)、脉搏血氧饱和度(SpO2)及双频谱指数(BIS),桡动脉处置入导管监测有创动脉血压(ABP)。麻醉诱导前,D组静脉予右美托咪啶0.6 μg/kg,于10 min内输注完毕;S组予等量生理盐水。术中D组给予右美托咪啶0.4μg/(kg·h)持续泵注,S组给予等量的0.9%氯化钠注射液持续泵注。麻醉诱导及维持均采用靶控输注(TCI)技术,经Ochestra麻醉工作站给予丙泊酚或瑞芬太尼。瑞芬太尼、丙泊玢初始药物效应部位靶浓度分别设置为4.0 ng/L、3 μg/L,达到预期靶浓度后,追加药物剂量直至患者意识消失;静脉推注顺式苯磺酸阿曲库铵0.15 mg/kg,诱导充分后气管插管。气管插管后连接Primus麻醉机,设定为间歇正压通气方式,潮气量(VT)8~10 mL/kg,频率(f)12次/min,维持PETCO235~45 mmHg。麻醉维持:术中丙泊酚和瑞芬太尼采用TCI输注;根据肌松监测数值按需间断推注顺式苯磺酸阿曲库铵。使用血管活性药物辅助维持血压,根据有创动脉血压数值调整给药量。若血压低于基础值的30%,则予2%去氧肾上腺素(0.9%氯化钠注射液每500 mL中加入去氧肾上腺素10 mg)静滴,调节滴速直至血压稳定;若血压高于基础值的20%,则予盐酸乌拉地尔0.1~0.15 mg/kg。若心率低于50次/min,则予阿托品0.5 mg。术毕前30 min停止输注右美托咪啶,术毕时丙泊酚和瑞芬太尼停止输注。
1.2.2 观察指标 记录以下各时间点患者的HR和MAP:给予右美托咪啶或生理盐水前(T0)、诱导前(T1)、气管插管前(T2)、气管插管后1 min(T3)、手术切皮时(T4)、拔出气管导管前(T5)、拔出气管导管后1 min时(T6);记录患者麻醉复苏情况:停药后意识恢复时间、拔除气管导管时间。观察并记录患者麻醉拔管时有无呛咳、拔管后躁动、术后寒战等并发症。
1.2.3 统计学方法 数据分析采用SPSS19.0统计软件,计量资料以¯x±s表示,分别采用两独立样本均数的t检验,或重复测量设计的方差分析;计数资料以相对数构成比(%)或率(%)表示,行χ2检验。P≤0.05为有统计学差异。
2 结果
2.1 血流动力学变化 与T0比较,T1时D组MAP降低(P <0.05);与T2比较,T3时 S组 HR、MAP 升高(P均<0.05)。与 T5比较,T6时 S组 MAP、HR均升高(P均<0.05)。组间MAP与HR对应值相比较,在 T1、T3、T5、T6时间点,D 组比 S 组 MAP 与HR均降低(P均<0.05)。见表1。
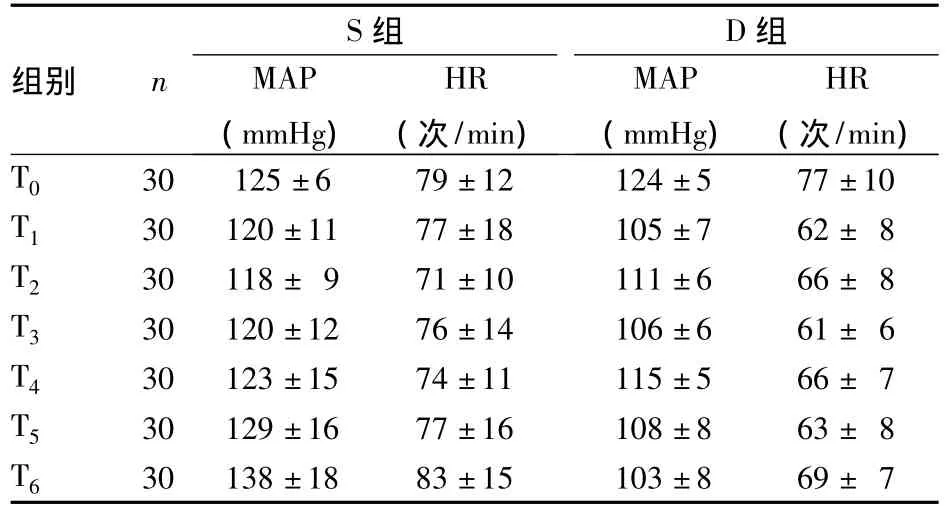
表1 2组患者围麻醉期MAP和HR的比较(¯x±s)
2.2 麻醉药物用量比较 D组丙泊酚、瑞芬太尼用量分别为(712±144)μg和(1 558±309)mg,S组分别为(802±201)μg和(1 750±372)mg,D 组丙泊酚、瑞芬太尼用量均少于S组(P均<0.05)。
2.3 术后复苏及恢复情况 停止给药后,D组意识恢复时间、拔管时间均比S组短,两组存在统计学差异(P均<0.05)。相比S组患者,D组患者对气管导管的耐受性高于S组,未出现躁动,拔出气管导管时未出现呛咳或术后寒战。S组拔出气管导管时出现呛咳、拔管后躁动或术后寒战的发生率高于D组(P 均 <0.05)。见表2。

表2 2组患者术后复苏及恢复情况比较
3 讨论
烟雾病患者均存在不同程度的脑血流改变,缺血部位血管及脑组织对颅内压、血容量改变相对敏感。大脑的自动调节功能在清醒状态下可以调节这些因素,但全麻时调节功能下降,导致脑缺血、出血,甚至卒中[1~3]。在提供充分麻醉的同时,还应兼顾脑血流和脑氧耗。麻醉过程中应避免血压急剧升高或降低。血压急剧升高可能会导致颅内出血,有颅内出血病史者会存在进一步出血的危险;血压急剧降低会导致脑供血供氧不足引起脑缺血[4]。本研究中,在血流动力学易出现剧烈变化的几个麻醉时期,如气管插管后(T3)、手术切皮时(T4)、拔出气管导管前(T5)和拔出气管导管后(T6),D组的MAP和HR的变化均较S组平稳。给予右美托咪定,对于气管插管、手术切皮及拔出气管导管等有害刺激,可维持更为平稳的血流动力学状态,减少因血压骤升骤降而发生的脑出血或脑缺血几率。
右美托咪啶是一种新型高选择性α2肾上腺能受体激动剂,可产生剂量依赖性的镇静、镇痛和抗焦虑作用,血流动力学稳定,无呼吸抑制等优点,十分适用于神经外科手术患者的麻醉。本研究中,D组患者瑞芬太尼和丙泊酚的总用量均少于S组。多项临床试验证实右美托咪啶可以提供充分的镇静,显著减少咪达唑仑、丙泊酚以及阿片类药物的用量[5]。其可以在机械通气脱机过程中持续泵注,术毕30 min时停止给药后,不延长患者自主呼吸恢复时间,且无呼吸抑制、降低低氧血症等呼吸系统的并发症发生率[6]。右美托咪啶直接激活颅内血管α2肾上腺素能受体,通过直接收缩血管及间接中枢性缩血管作用来降低脑血流,并呈剂量依赖性,而不增加颅内压。血压正常水平下,右美托咪啶对脑循环无不良影响[7]。
NMDA受体系统对瑞芬太尼诱发的痛觉过敏反应具有调控作用,能够缓解瑞芬太尼诱发的痛觉敏化效应。Zhang等[8]发现,右美托咪啶可抑制NMDA受体介导的突触后电位,从而抑制A和C初级传入纤维介导的突触传递所产生的伤害性刺激效应。因此,使用右美托咪啶,能够在麻醉复苏期维持更好的镇静镇痛水平和更平稳的血压,有效减少术后疼痛所诱发的各种不良反应[9]。本研究中,D组患者意识恢复及拔出气管导管的时间均快于S组患者,且麻醉复苏时期呛咳、躁动、寒战等不良反应的发生例数均少于S组。因右美托咪啶可降低手术应激引发的神经内分泌反应。通过抑制大脑体温调节中枢,降低寒战阈值[10]。围麻醉期使用右美托咪啶,术后寒战的发生率明显降低,寒战程度亦明显下降,机体的氧耗量和CO2生成量均减少。
综上所述,右美托咪啶具有镇静、镇痛、抗焦虑的作用,围麻醉期血压、心率等生命体征平稳,有效减少麻醉复苏时期呛咳、寒战等不良反应的发生率,对脑血流影响小,在颞肌贴敷治疗烟雾病手术中维持血流动力学稳定方面具有积极作用,对于改善麻醉苏醒质量、提高手术质量及手术预后均有积极的作用。
[1]陈诤,毛颖,周良辅.烟雾病的研究进展[J].国外医学:脑血管疾病分册,2004,12(10):761-764.
[2]黄显军,刘文华,徐格林,等.烟雾病的脑血流动力学[J].国际脑血管病杂志,2010,18(6):441-444.
[3]杨树源.烟雾病研究的现状与展望[J].中华神经外科杂志,2011,27(12):1293-1296.
[4]戚翔,张志强,康荣田.1例烟雾病患者的麻醉体会[J].广东医学,2010,31(6):764.
[5] Triltsch AE,Welte M,von Homeyer P,et al.Bispectral indexguided sedation with dexmedetomidine in intensive care:a prospective,randomized,double-blinded,placebo-controlled phaseⅡ study[J].Crit Care Med,2002,30(5):1007-1014.
[6]石佳,于钦军.右美托咪啶的药理作用及在重症监护病房中的应用[J].国际麻醉学与复苏杂志,2007,28(6):540-543.
[7]Drummond JC,Dao AV,Roth DM,et al.Effect of dexmedetomidine on cerebral blood flow velocity,cerebral metabolic rate,and carbon dioxide response in normal humans[J].Anesthesiology,2008,108(2):225-232.
[8]Zheng Y,Cui S,Liu Y,et al.Dexmedetomidine prevents remifentanil-induced postoperative hyperalgesia and decreases spinal tyrosine phosphorylation of N-methyl-d-aspartate receptor 2B subungit[J].Brain Res Bull,2012,87(4-5):427-431.
[9]Luginbfuhl M,Gerber A,Schnider TW,et al.Modulation of remifentanil-induced analgesia,hyperalgesia,and tolerance by small-dose ketamine in humans[J].Anesth Analg,2003,96(3):726-732.
[10]Bajwa SJ,Gupta S,Kaur J,et al.Reduction in the incidence of shivering with perioperative dexmedetomidine:a randomized prospective study[J].JAnaesthesiol Clin Pharmacol,2012,28(1):86-91.
