马拉硫磷对东亚飞蝗解毒酶活性的影响
2013-06-11曹广春张泽华
赵 霞,贾 苗,王 磊,曹广春*,张泽华
(1.沈阳农业大学植物保护学院,沈阳 110161;2.中国农业科学院植物保护研究所农业部生物防治重点开放实验室,北京 100081)
东亚飞蝗Locusta migratoria manilensis,Meyen是重要的农业害虫之一,在国内外分布比较广泛(洪晓月和丁锦华,2007)。自2010年以来,随着气候的异常变化和生态环境的改变,蝗灾的发生比较频繁,其中澳大利亚东南部、新疆伊犁河谷以及河南黄河沿岸等地遭受严重的蝗虫灾害,给农业生产带来巨大的经济损失。目前,大量用于蝗灾防治的有机磷杀虫剂马拉硫磷,具有杀虫谱广、低毒高效、残效期短、价格低廉等特点,并有良好的胃毒、触杀和一定的熏蒸作用,且对人畜无害(贺红武和刘钊杰,2001)。
随着马拉硫磷杀虫剂的过量施用,害虫对药物的敏感性发生变化并产生一定抗性。目前对其抗性的生化机制研究如下:昆虫乙酰胆碱酯酶(AChE)活性升高是产生马拉硫磷抗性的一个重要机制(唐振华和周成理,1992;Fournier et al.,1993;Zhu et al.,1999;Taskin et al.,2004;Magana et al.,2007;),其他可能的因素有酯酶(Ests)活性的升高(高希武等,1992;Zhu et al.,1999;Magana et al.,2007);多功能氧化酶(MFO)活性的升高(Motoyama et al.,1980)以及谷胱甘肽-S-转移酶(GSTs)活性的变化(Motoyama et al.,1980;高希武等,1992;Taskin et al.,2004;何艳萍等,2005)。当前研究重点大多集中于马拉硫磷抗性机制研究,而马拉硫磷对解毒代谢酶的影响还未见报道,严重地阻碍了其抗性延缓和治理策略的制定。
本实验以东亚飞蝗为研究对象,在浸叶法测定马拉硫磷对东亚飞蝗3龄蝗蝻毒力的基础上,研究了其对解毒代谢酶的影响,以期为马拉硫磷的合理使用、抗性延缓和抗性治理提供理论依据。
1 材料与方法
1.1 供试昆虫
东亚飞蝗蝗卵2007年采集于河北沧州,室内孵化饲养传代至今,未接触过任何杀虫剂。虫卵在人工气候培养箱中孵化,温度(30±2)℃,湿度为(60+5)%,光照时间∶黑暗时间=14 h∶10 h。将同一时间孵化的蝗蝻转移到60 cm×50 cm×70 cm 规格的养虫笼中用新鲜小麦和麦麸饲养传代。
1.2 主要试剂及仪器
1.2.1 供试试剂
马拉硫磷原药由中国农业科学院植物保护研究所农药研究室提供;DTNB(5,5-二硫双(2-硝基苯甲酸))、ATChI(碘化硫代乙酰胆碱)、考马斯亮蓝G-250、CDNB(1-氯-2,4-二硝基苯)、DCNB(1,2-二氯-4-硝基苯)均为Sigma 产品;α-NA(乙酸-1-萘酯)、p-NA(对硝基苯甲醚)、NADPH(还原型辅酶II)均购自Amresco 公司;GSH(还原型谷胱甘肽)、固蓝RR 盐、牛血清蛋白购自Solarbio 公司;其余药品为国产分析纯。
1.2.2 供试仪器
智能人工气候箱(宁波海曙塞福实验仪器厂)、立式压力蒸气灭菌器(上海博讯实验有限公司)、电热恒温鼓风干燥箱(上海精宏实验设备有限公司)、SartoriusBS224S 天平、3K15 型冷冻离心机(Sigma 公司)、H2O3-PRO 恒温金属浴(金银杏生物科技有限公司)、VERSAmax 型酶标仪(美国Molecular Device 公司)。
1.3 生物测定
试验采用浸渍叶片法(陈年青,1990)测定马拉硫磷对蝗虫的毒力效果,首先将马拉硫磷原药用丙酮配制成一定浓度的母液,然后用双蒸水将母液稀释为不同浓度。将新鲜无污染的小麦叶,浸在不同浓度的药液中5 s 后取出,室内晾干后等量放入饲养盆中。挑选大小一致的3龄蝗虫若虫,每个处理15头,重复次数为3,并用双蒸水作为对照,饲养于养虫室,每天统计死亡虫数。以解剖针轻触虫体,无明显反应者为死亡。
计算处理死亡率,并采用SPSS 数据处理软件(贾春生,2006)计算马拉硫磷48 h和72 h 的毒力回归方程及LC50和95%置信区间。
1.4 酶液的制备
取马拉硫磷药物处理48 h 后存活的蝗虫,加入适量0.1 M 的磷酸盐缓冲液(酯酶:缓冲液pH 7.0,1.5mL/头,含0.1%TritonX-100;多功能氧化酶O-脱甲基活力:pH7.3,1mL/头含1 mM EDTA和1 mM DTT;谷胱甘肽-S-转移酶:pH7.5,1.5mL/头;乙酰胆碱酯酶:pH7.0,1.5mL/头)冰浴匀浆3 min,匀浆液在10,000 rpm、4℃条件下离心10 min。取上清液在15,000 rpm、4℃条件下再离心20 min,所获得的上清液用作酶活性测定。
1.5 酶活的测定
1.5.1 蛋白含量测定
酶液中蛋白含量采用Bradfold(1976)考马斯亮蓝方法,牛血清白蛋白为标准蛋白,用酶标仪在595 nm 处读取OD 值,计算样品蛋白含量。
1.5.2 全酯酶活性测定
参考韩召军等(Han et al.,1998)方法,在酶标板加样孔中依次加90μL 0.1 M pH7.0 磷酸盐缓冲液、200μL 底物与显色剂的混合液(α-NA 10 mg、固蓝RR 20 mg 分别溶于1mL 丙酮,分别取200μL 用缓冲液定容至8mL,过滤。),最后加入10μL 酶液。迅速置于酶标仪在450 nm 波长下,每隔25 s 记录一次光密度值,共记录10 min,样品测定时设置3个重复,酶促反应温度为27℃,数据记录和处理由Softmax Pro 6.1 软件进行。
1.5.3 谷胱甘肽-S-转移酶活性测定
参照Oppenoorth(1976)报道的方法,以CDNB 为底物时,在96 孔酶标板中每孔分别加入90μL 0.1 M pH7.5 磷酸盐缓冲液,10μL 酶液,100μL 1.2 mM CDNB和100μL 6 mM GSH。以DCNB 为底物时,在96 孔酶标板中每孔加入50μL酶液,100μL 1.2 mM DCNB和100μL 6 mM GSH。置于酶标仪在340 nm 波长下,每隔25 s 记录一次光密度值,共记录10 min,样品测定时设置3个重复,酶促反应温度为27℃,数据记录和处理由Softmax Pro 6.1 软件进行。
1.5.4 多功能氧化酶O-脱甲基活力测定
参照Hansen和Hodgson(1971)的方法,在96 孔酶标板中,每孔依次加入100μL 2mM 的p-NA、50μL 酶液,在27℃下温育2min,然后加入40μL,9.6 mM 的NADPH。置于酶标仪在405 nm波长下,每隔25 s 记录一次光密度值,共记录10 min,样品测定时设置3个重复,酶促反应温度为27℃,数据记录和处理由Softmax Pro 6.1 软件进行。
1.5.5 乙酰胆碱酯酶活性测定
参考韩召军等方法(Han et al.,1998),在酶标板加样孔中依次加50μL,0.1M pH7.0 磷酸盐缓冲液、50μL 酶液、100μL 45 μM DTNB和100μL 1.5 mM ATChI。置于酶标仪在405 nm 波长下,每隔30 s 记录一次光密度值,共记录40个值,样品测定时设置3个重复,酶促反应温度为27℃,数据记录和处理由Softmax Pro 6.1 软件进行。
2 结果与分析
2.1 马拉硫磷对东亚飞蝗的毒力测定
马拉硫磷对东亚飞蝗3龄蝗蝻室内毒力测定,结果表明:处理48 h 的LC50值为448.89 mg/L,处理72 h 的LC50值为315.61 mg/L。
2.2 不同浓度马拉硫磷处理东亚飞蝗相关生化酶活性变化
从表1 中可以看出,取接近于LC0(7.48 mg/L)、LC5(37.4 mg/L)、LC30(187 mg/L)的3个马拉硫磷浓度处理东亚飞蝗48h 后,其体内的解毒酶活性出现了一定变化。全酯酶(Ests)和乙酰胆碱酯酶(AChE)活性受到抑制并且变化趋势相同,当浓度为37.4 ppm 时,其酶活性分别为对照组的0.28和0.32倍。分别以CDNB和DCNB 为底物测定东亚飞蝗谷胱甘肽S-转移酶(GSTs)活性,其变化趋势不同。以CDNB 为底物时,经低浓度马拉硫磷处理后东亚飞蝗GSTs 活性受到抑制,但是当处理浓度为187 ppm 时其活性被诱导升高1.35倍;以DCNB 为底物时,测得东亚飞蝗GSTs比活力较小,但是其活性呈现先升高后降低的诱导趋势,当马拉硫磷浓度为37.4 ppm 其活性最高为1.34倍。多功能氧化酶(MFO)活性受到抑制,但无显著性差异,浓度为7.48 ppm 时活性最低为0.68倍。

表1 马拉硫磷对东亚飞蝗的毒力Table 1 Toxicity of malathion to Locusta migratoria manilensis
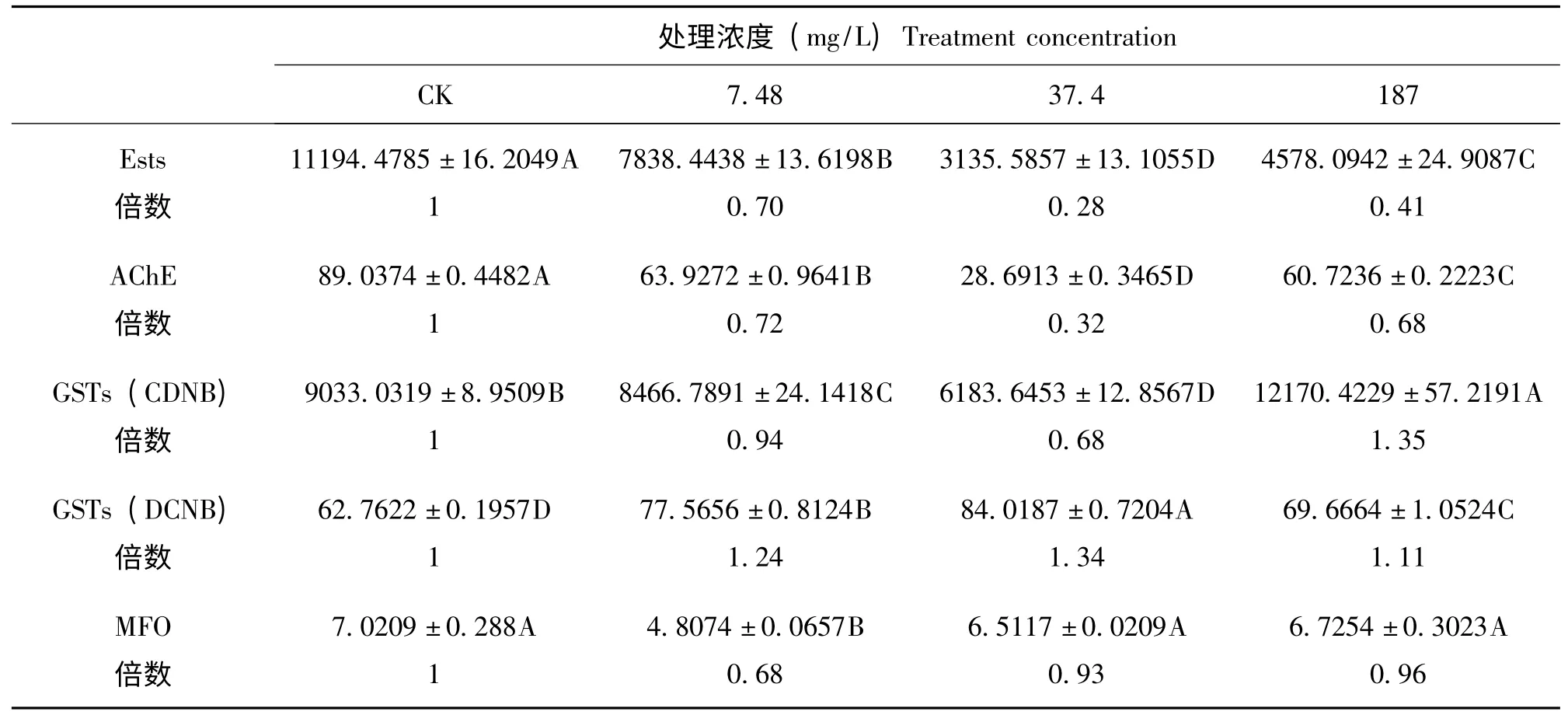
表2 不同浓度马拉硫磷处理下东亚飞蝗相关酶活性Table 2 The enzymes activities assays of Locusta migratoria manilensis to malathion
3 结论与讨论
本试验以3龄东亚飞蝗为测定对象,用马拉硫磷杀虫剂进行了室内毒力测定,并分析了东亚飞蝗体内解毒代谢酶的变化趋势。试验结果表明马拉硫磷作用72 h 后对东亚飞蝗的LC50值为315.61 mg/L 。纪明山等(2012)对草原蝗虫毛足棒角蝗和亚洲小车蝗3龄若虫进行了室内药剂的筛选试验,结果发现马拉硫磷对这两种蝗虫毒力最低,72h 的LC50值分别为422.9821 mg/L和317.8538 mg/L。李翠兰等(2005)报道山西晋源地区的中华稻蝗5龄若虫经马拉硫磷作用24 h,其LC50值为549 mg/L。上述结果说明马拉硫磷对不同的蝗虫具有相近的毒力效果,因此可用于蝗虫的大面积混合防治,而不会出现防效不一的结果。
已知马拉硫磷主要作用于乙酰胆碱酯酶(AChE)靶标酶,使AChE 活性部位磷酰化而抑制其活性,引起乙酰胆碱在突触间作用时间延长,从而引起突触后膜乙酰胆碱受体的超兴奋,使昆虫痉挛死亡(张宗炳和曹骥,1990)。刘波(2003)等报道LD10剂量的马拉硫磷诱导了棉铃虫Helicoverpa armigera 体内的AChE 的活性。但是亚致死剂量的马拉硫磷作用24 h 后抑制花翅摇蚊Chironomus kiiensis 体内的AChE 活性(刘洪霞,2005)。本研究发现马拉硫磷处理48 h 后,抑制了东亚飞蝗AChE 活性,并且随着马拉硫磷浓度的升高呈现先降低后升高的趋势。不同的昆虫经马拉硫磷处理后体内AChE 活性变化情况不同,这可能与昆虫的处理方式和AChE 活性测定方法不同有关,但对体内AChE 的抑制被认为是最可能的结果,在马拉硫磷抗性机制研究中发现AChE 活性升高是造成昆虫产生抗性的重要原因(Zhu et al.,1995)。
杀虫剂进入昆虫体内,常常会遭受不同酶系的进攻,与此相关的主要有酯酶、谷胱甘肽-S-转移酶、多功能氧化酶(冷欣夫和唐振,1996)。刘泽文等研究发现在马拉硫磷的抗性发展过程中,褐飞虱酯酶活性在不断的上升,并且存在较好的相关性;而多功能氧化酶和谷胱甘肽-S-转移酶只在抗性发展的最初阶段起到一定的作用(刘泽文等,2003)。在本试验中东亚飞蝗全酯酶、谷胱甘肽-S-转移酶(以CDNB 为底物)和多功能氧化酶都被抑制,但全酯酶、谷胱甘肽-S-转移酶(以CDNB 为底物)的活性随着马拉硫磷浓度的升高呈现先降低后升高的趋势,而MFO 活性变化不明显。由此推测乙酰胆碱酯酶、全酯酶和谷胱甘肽-S-转移酶活性的上升可能是导致东亚飞蝗对马拉硫磷抗性发展的重要原因之一,多功能氧化酶活性的变化可能促进了其抗性的发展。
明确马拉硫磷对昆虫体内解毒代谢酶的影响,可为其抗性的延缓和抗性治理奠定一定的理论基础。针对抗性的问题,刘泽文(刘泽文等,2004)研究发现在马拉硫磷抗性品系中磷酸三苯酯(TPP)对马拉硫磷的增效作用达到9.15倍,增效剂的使用可以增强马拉硫磷的毒力,降低抗性的影响。因此,作为延缓或者阻止抗性发展的主要手段,杀虫剂与增效剂混用、不同作用机理的杀虫剂混用和杀虫剂的轮用等措施将势在必行。
References)
Bradford MM,1976.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding.Analytical Biochemistry,72:248-254.
Chen NQ,1990.Technology of Pesticide Bioassay.Beijing:Beijing Agriculture University Press.66-68.[陈年青,1990.农药生物测定技术.北京:北京农业大学出版社.66-68.]
Fournier D,Mutero A,Pralavorio M,1993.Drosophila acetylcholinesterase:mechanisms of resistance to organophosphates.Chem.Biol.Interact,87(1-3):233-238.
Gao XW,Zheng BZ,Cao BJ,1992.Resistance in Myzus persicae to organophosphorus and carbamate insecticides in China.Acta Phytophylacica Sinica,19(4):365-371.[高希武,郑炳宗,曹本,1992.桃蚜对有机磷和氨基甲酸酯抗性机制研究.植物保护学报,19(4):365-371]
Han ZJ,Moores GD,Denholm I,1998.Association between biochemical markers and insecticide resistance in the Cotton Aphid,Aphis gossypii Glover.Pesticide Biochemistry and Physiology,62:164-171.
Hansen LG,Hodgson E,1971.Inhibition of microsomal oxidoses from the housefly.Pesticide Biochemistry and Physiology,1:109-119.
He HW,Liu ZJ,2001.Developing trend of organic phosphorus pesticides and the exploitation and utilization of the low toxicity organic phosphorus.World Pesticides,23(4):26-31.[贺红武,刘钊杰,2001.有机磷农药的发展趋势与低毒有机磷杀虫剂的开发和利用(下).世界农药,23(4):26-31]
He YP,Liu X,Ma EB,2005.Two metabolic enzymes of oriental migratory locust,Locusta migratoria manilensis(Meyen),from two locust areas with different ecological characteristics.Acta Ecologica Sinica,25(2):203-209.[何艳萍,刘新,马恩波,2005.两个不同生态特征蝗区东亚飞蝗的两种代谢酶.生态学报,25(2):203-209]
Hong XY,Ding JH,2007.Agricultural Entomology.Beijing:China Agriculture Press.134-140.[洪晓月,丁锦华,2007.农业昆虫学.北京:中国农业出版社,134-140]
Ji MS,Liu ZC,Li XW,Yan KC,Zhu H,Han JD,2012.Pharmaceutical screening of grassland locusts in lab.Agrochemicals,51(2):148-150.[纪明山,刘周成,李修伟,颜克成,朱赫,韩金栋,2012.防治草原蝗虫有效药剂的室内筛选.农药,51(2):148-150]
Jia CS,2006.Calculatiang the LC50of insecticides with software SPSS.Entomological Knowledge,43(3):414-417.[贾春生,2006.利用SPSS 软件计算杀虫剂的LC50.昆虫知识,43(3):414-417]
Len XF,Tang ZH,Wang QC,1996.The Insecticidal Molecular Toxicology and the Resistence of Insects.Beijing:China Agriculture Press,9-27.[冷欣夫,唐振华,王前长,1996.杀虫药剂分子毒理学及昆虫抗药性.北京:中国农业出版社,9-27]
Li CL,Lu FP,Guo YP,Ma EB,2005.Acute toxicities of Malathion,Fipronile and Cyhalothrin to fifth instar nymphs of rice gresshopper Oxya chinensis.Journal of Agro-Environment Sicence,24(3):562-566.[李翠兰,卢芙萍,郭亚平,马恩波,2005.马拉硫磷锐劲特和氯氟氰菊酯对中华稻蝗五龄若虫的急性毒性.农业环境科学学报,24(3):562-566]
Liu B,Gao XW,Zhen BZ,2003.Effect of sublethal doses of anticholinesterase agents on toxicity of insecticides and their induction to acetylcholinesterase(AchE)in Helicoverpa armigera.Acta Entomologica Sinica,46(6):691-696.[刘波,高希武,郑炳宗,2003.抗胆碱酯酶剂亚致死剂量对棉铃虫毒力的影响及对乙酰胆碱酯酶的诱导作用.昆虫学报,46(6):691-696]
Liu HX,Shi XY,Gao XW,2005.The optimum in acetylcholinesterase assaye and the sensibility to organophosphorus of Chironomus kiiensis.Journal of Safety and Environment,5(5):67-70.[刘洪霞,史雪岩,高希武,2005.摇蚊乙酰胆碱酯酶最佳反应体系的建立及有机磷类药剂敏感度比较.安全与环境学报,5(5):67-70]
Liu ZW,Han ZJ,Zhang LC,Wang YC,2003.The roles of esterase,MFO and GSTs in malathion resistance development in brown planthopper.Journal of Nanjing Agricultural University,26(1):24-28.[刘泽文,韩召军,张玲春,王荫长,2003.解毒酶系在褐飞虱对马拉硫磷的抗性发展中的作用.南京农业大学学报,26(1):24-28]
Liu ZW,Han ZJ,2004.Cross resistance of malathion resistant strain of Nilaparvata lugens and its biochemical aspects.Journal of Nanjing Agricultural University,27(1):55-58.[刘泽文,韩召军,2004.抗马拉硫磷褐飞虱品系的交互抗性及其生化分析.南京农业大学学报,27(1):55-58]
Magana C,Hernandez-Crespo P,Ortego F,2007.Resistance to malathion in field populations of Ceratitis capitata.J.Econ.Entomol.,100(6):1836-1843.
Motoyama N,Hayaoka T,Nomura K,1980.Glutathione S-transferase,their role in the metabolism of organophours insecticides.Review Biochemistry Toxicol.,2:49-51.
Oppenoorth FJ,Welling W,1976.Biochemistry and physiology of resistance.Insecticide Biochemistry and Physiology.New York:Plenum Press,507-551.
Tang ZH,Zhou CL,1992.The acetylcholinesterase sensibility of Plutella xylostella(Linn.)in resistant strain.Acta Entomologica Sinica,35(4):385-392.[唐振华,周成理,1992.抗性小菜蛾的乙酰胆碱酯酶敏感性.昆虫学报,35(4):385-392.]
Taskin V,Kence M,2004.The genetic basis of malathion resistance in housefly(Musca domestica L.)strains from Turkey.Genetika,40(11):1475-1482.
Zhang BZ,Cao J,1990.Pest Control:Strategy and Method.Beijing:Science Press,143-154.[张宗炳,曹骥,1990.害虫防治:策略与方法.北京:科学出版社,143-154]
Zhu KY,Gao JR,1995.Increased activity associated with reduced sensitivity of acetylcholinesterase in organophosphate resistant greenbug,Schizaphis graminum(Homoptera:Aphididae).Pestic Sci.,55:11-17.
