湿法磷酸萃取制备磷酸二氢钾的研究
2013-06-11张雅晴
孙 毅,李 军,周 堃,张雅晴
(1.四川大学化学工程学院,四川成都610065;2.成都理工大学材料与化学化工学院)
磷酸二氢钾是无色或白色带光泽的斜方晶体,能溶于水,呈酸性反应,不溶于醇。由于其特殊的性质,磷酸二氢钾广泛用于现代工业、医药和农业中。此外,它还可广泛用于发酵、食品、饲料、化学试剂、植物生长剂和化肥等生产行业[1]。目前,工业化生产磷酸二氢钾的主要方法有中和法、离子交换法、复分解法、萃取法等[2]。其中,萃取法有工艺流程简单,反应温度低,设备腐蚀小,成本低,无“三废”污染等优点。它是目前较先进、具有发展前途的工业生产技术。萃取法已有工业化报道的方法之一是三乙胺法,该法利用价格昂贵的热法磷酸为原料并且在蒸馏回收三乙胺及乙醇时损失大,故成本还是较高[3]。此外,其他文献中有记载用萃取法制备磷酸二氢钾的,一般也都是以热法酸或净化酸与氯化钾为原料[4]。而以湿法磷酸和氯化钾为原料采用萃取法直接制取磷酸二氢钾的工艺尚未见报道。
1 实验部分
1.1 仪器与试剂
DF-101S集热式恒温加热磁力搅拌器。
主萃取剂,工业级,质量分数≥99%;辅萃取剂,工业级,质量分数≥99%;稀释剂,分析纯;氨水,w(NH3)=25%~28%;氯化钾,粉末状,分析纯,质量分数>99.8%;实验所用的湿法磷酸是由广西某化工企业提供,组成为:w(P2O5)=21.62%,w(Fe3+)=0.24%,w(Mg2+)=0.79%,w(Al3+)=0.28%,w=1.01%,w(F-)=1.75%。
1.2 实验原理
对可用作萃取剂的几种醇类、脂类、胺类等溶剂进行了筛选,最终使用的有机萃取体系是由主萃取剂、辅萃取剂与稀释剂按质量比5∶4∶1组成的混合物。该混合萃取剂对盐酸的萃取选择性好,与水的互溶度小,化学稳定性好,毒性小,萃取效率高,易于反萃再生。萃取时主要反应如下(E在各式中均代表萃取剂)[5]:

由于萃取剂对HCl的选择性好,则主要萃取HCl。萃取过程中,主要是HCl与萃取剂发生反应而进入有机相,但与此同时,也有少量H3PO4分子不可避免地与萃取剂反应而进入有机相:
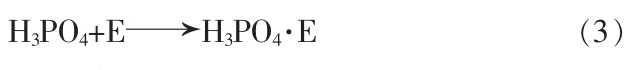
采用碱性物质(如氨水)对有机相进行反萃,可使萃取剂再生。反萃过程中,氨水与萃合物发生反应,生成氯化铵和磷酸二氢铵并进入水相,使萃取剂再生,再生后的萃取剂经过水洗可循环使用。
1.3 工艺流程
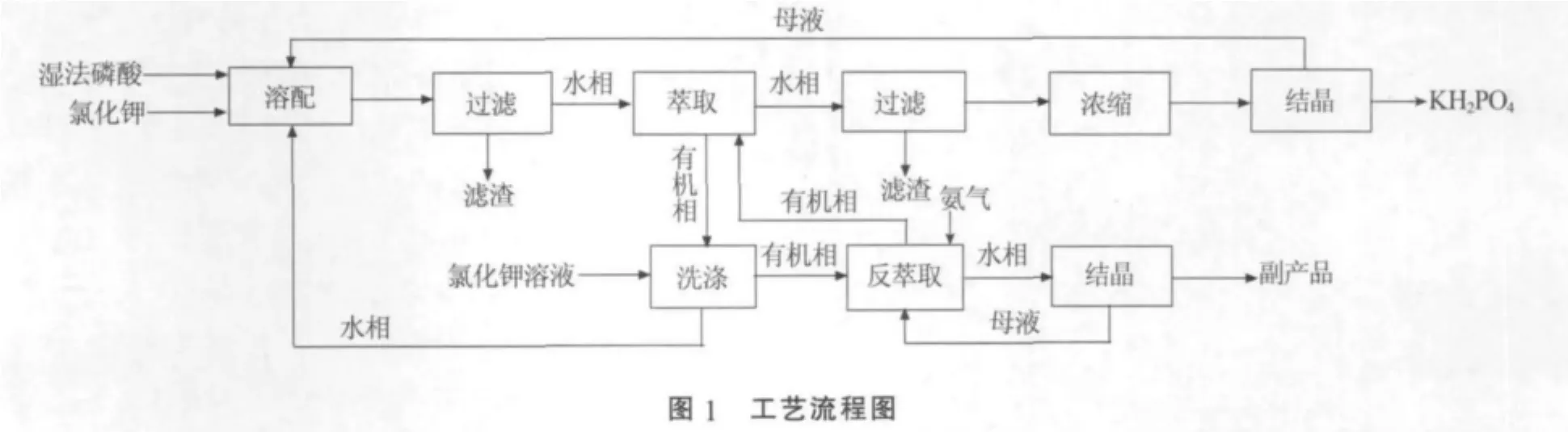
湿法磷酸萃取制备磷酸二氢钾生产工艺主要包括溶配、萃取、洗涤与反萃取等步骤,其生产工艺流程见图1。
2 结果与讨论
2.1 溶配部分
溶配过程是整个工艺不可缺少的操作。该工艺中氯化钾不仅作为原料为体系提供钾元素,同时它可作为脱氟的沉淀剂,首先脱除大部分的氟化物。实验在充分搅拌的情况下,加入不同量的氯化钾(脱氟剂),反应一段后,将反应物用真空泵抽滤,将滤液取样,采用选择性电极法进行分析。实验结果见图2。实验结果表明,随氯化钾加入量的增加,F-的脱除率不断升高。在氯化钾与磷酸物质的量比为0.2~0.6时,脱除率升高得比较快,而氯化钾与磷酸物质的量比为0.6~1.2时,脱除率变化极为缓慢,可视为稳定。 当 n(KCl)/n(H3PO4)=1.0 时,F-脱除率最高,为89.5%,脱除氟后的溶液含氟量为0.1%(质量分数)。
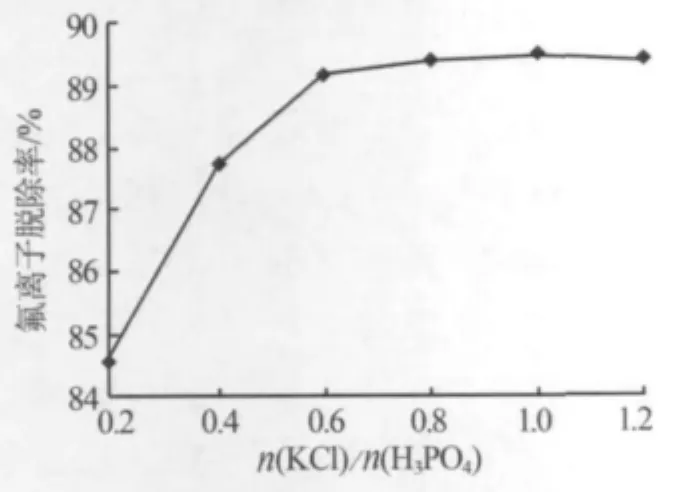
图2 氯化钾与磷酸物质的量比对氟离子脱除率的影响
2.2 氯化钾与磷酸物质的量比、反应时间对萃取率及杂质脱除率的影响
实验中,氯化钾主要作为原料与磷酸按照物质的量比1∶1发生反应,有少部分与氟硅酸反应脱除湿法磷酸中的氟。从反应平衡的角度考虑,适当提高磷酸与氯化钾物质的量比,会促进HCl的萃取。但在萃取过程中,少量磷酸分子不可避免地与萃取剂反应而进入有机相,如果磷酸过量太多,会增加磷酸的损失。萃取反应在有机萃取剂与原料液相比为3∶1,原料液由湿法磷酸和氯化钾按不同的 n(KCl)/n(H3PO4)溶配而成,萃取时间为 30 min,萃取温度为62℃,搅拌速率为300 r/min的条件下进行。不同n(KCl)/n(H3PO4)对萃取结果的影响见图 3。 由图 3可知,H3PO4和HCl的萃取率以及SO42-的脱除率都随着 n(KCl)/n(H3PO4)的增加而降低,其中 HCl的萃取率下降非常缓慢。另外,Fe3+、F-的脱除率随n(KCl)/n(H3PO4)的增加而基本保持不变,其中 F-的脱除率有略微增加。考虑到该工艺中氯化钾与磷酸按物质的量比 1∶1反应,而 HCl的萃取率又在n(KCl)/n(H3PO4)为 1.2 时下降比前面快,所以确定n(KCl)/n(H3PO4)为 1.0~1.2。
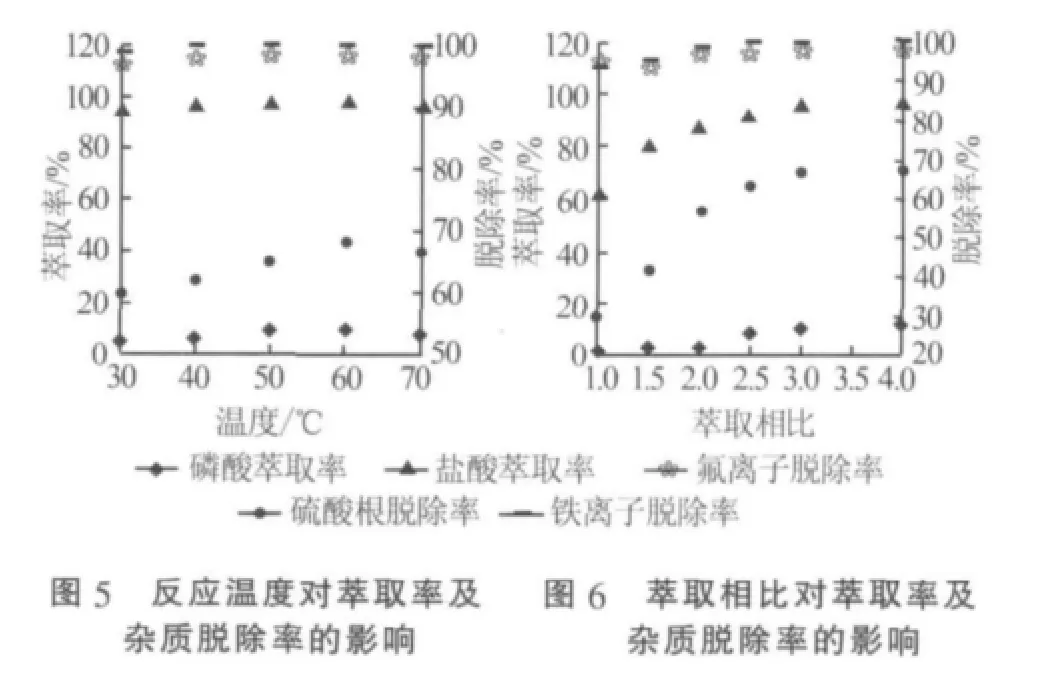
萃取反应在有机萃取剂与原料液相比为3∶1、原料液由湿法磷酸和氯化钾按 n(KCl)/n(H3PO4)为1.0溶配而成、萃取温度为62℃、搅拌速率为300 r/min的条件下,考察了时间对萃取过程的影响,结果见图 4。由图 4可知,H3PO4和 HCl的萃取率以及Fe3+、F-、杂质的脱除率都随着时间的增加而增加。H3PO4达到萃取平衡需要40 min,HCl达萃取平衡只需要30 min;而Fe3+的脱除率在20 min时就达到稳定,F-与的脱除率都在30 min达到稳定值。因此,在杂质脱除率及HCl萃取率越高越好、H3PO4萃取率越低越好的前提下,再综合能耗、效率等因素,之后的实验萃取时间选为30 min,以保证HCl萃取达平衡。晶所需温度,确定较适宜萃取温度为60℃。

在液液萃取中相比是指有机相与水相体积的比值。萃取是水相中的相关物质转移至有机相的过程,在两相中存在传质平衡,当被萃取的水相的量一定时,增加萃取剂的量(即增大相比)可以使平衡向萃取方向进行,从而提高萃取效率。但是,由于存在萃取平衡,过多地增大相比对萃取的意义并不大,且会增加设备的负荷,造成浪费。在萃取时间为30 min、搅拌速率为300 r/min、萃取温度为62℃、原料液由湿法磷酸和氯化钾按 n(KCl)/n(H3PO4)=1.0 溶配而成条件下,考察了不同萃取相比对萃取过程的影响,结果见图6。由图6可知,H3PO4和HCl的萃取率以及Fe3+、F-、杂质的脱除率都随着萃取相比的增加而增加,且都在萃取相比达到3.0之后,上升率趋于平缓。其中,HCl的萃取率和的脱除率在相比从1.0增加到3.0的过程中增加较快;而H3PO4的萃取率在相比从1.0增加到2.0的过程几乎保持不变,当相比从2.0增加到3.0,开始逐步增加,直至达到一个稳定值。因此,萃取相比选择为3.0。
2.3 反应温度、萃取相比对萃取率及杂质脱除率的影响
萃取温度会影响有机相黏度及反应速率。温度越低,有机相黏度越大,尤其是萃取后的有机相,常温下非常黏稠,以至于温度过低会给分相带来困难,另外,若温度太低,会降低有机相的溶解度,使两相搅拌混合后不易于聚集分层而造成乳化,甚至出现第三相,不利于操作;若温度过高,能耗增加。因此,整个溶剂萃取过程中需要保持适当的温度[4]。萃取反应在有机萃取剂与原料液相比为3∶1、原料液由湿法磷酸和氯化钾按 n(KCl)/n(H3PO4)为 1.0 溶配而成、萃取时间为30 min、搅拌速率为300 r/min的条件下,考察了温度对萃取过程的影响,结果见图5。由图5可以看出,温度对H3PO4和HCl的萃取率以及Fe3+、F-杂质的脱除率的影响都非常小,而温度对杂质的脱除率影响相对较大。另外,随温度的升高,H3PO4和HCl的萃取率和F-杂质的脱除率都略微升高,到60℃后又略微有一点下降;杂质的脱除率随温度升高而升高,到60℃后又略微有一点下降;而随温度的变化,Fe3+的脱除率几乎不变化。考虑到有机相黏度和操作能耗及后续磷酸二氢钾结
2.4 洗涤部分
萃取后的有机相中包含了少部分的H3PO4,造成P2O5的损失,因此需要对萃取后的有机相进行洗涤,将H3PO4洗入水相,以提高P2O5的收率。实验采用KCl溶液进行洗涤,洗涤时间为20 min,洗涤温度为62℃,搅拌速率为300 r/min,根据萃取时被萃入有机相的P2O5的量计算洗涤萃取相时所需KCl的量,在此基础上过量1.1倍,分别用蒸馏水配制不同浓度的 KCl溶液,使洗涤时相比为 3、6、9、12、15、20。不同相比对P2O5洗涤率的影响见图7。由图7可以看出,当相比为12时,P2O5洗涤率达到最大,当相比继续增加时,P2O5洗涤率呈下降趋势,但减少的比例较小。因此,洗涤相比选择为12。

2.5 反萃取部分
反萃取是萃取的逆过程,是整个工艺过程中将有机相回收再利用的操作。萃取HCl后的有机相需采用碱中和法回收萃取剂,氨水、碳酸氢铵等都可以使用。本工艺采用氨水作为反萃取剂,反萃取效率较高。将反萃温度定为62℃,反萃后分相容易,有机相进行水洗操作后可返回到萃取段循环使用,水相冷却结晶,过滤干燥得到合格的氯化铵副产品。
2.6 浓缩结晶
磷酸二氢钾的溶解度随温度升高有明显增加,适宜采用冷却结晶的方法[5]。实验将萃取、过滤所得溶液在一定真空度和温度下进行浓缩,然后通过适当地降温,可制得大颗粒的品质好的磷酸二氢钾晶体。在最佳工艺条件下,循环实验,得到的产品纯度达96.75%以上,P2O5收率达95.98%。
3 结论
1)通过实验研究,确定了较优工艺条件:萃取温度为60℃,萃取时间为30 min,氯化钾与磷酸的物质的量比为1.0,萃取相比为3.0,洗涤相比为12。2)本方法P2O5收率可达95.98%,产品纯度可达到96.75%以上,达到磷酸二氢钾农用级优等品的标准。3)本工艺P2O5收率高;只需采用一级萃取,不需要较大的设备;无需先净化湿法磷酸,再由净化酸生产磷酸二氢钾。因此,本工艺流程短,成本低,操作简单。
[1]陈路萍,樊继宽.湿法磷酸生产磷酸二氢钾新工艺[J].淮海工学院学报,2001,10(2):39-41.
[2]陈嘉甫,谭光薰.磷酸盐的生产与应用[M].成都:成都科技大学出版社,1986:76-95.
[3]李海丽,曾波.萃取法生产磷酸二氢钾工艺[J].云南化工,2001,28(1):14-15.
[4]李春,徐世林,宿其.溶剂萃取法生产工业级磷酸二氢钾新工艺研究[J].无机盐工业,1997(3):14-16.
[5]段潇潇,李 军,章怡.萃取法制取磷酸二氢钠的研究[J].无机盐工业,2008,20(12):24-26.
