VEGF CD44v6MMP-9在子宫内膜异位症组织中的表达及临床意义
2013-06-09姚红梅石秀玲
姚红梅 郭 静 石秀玲
(济宁医学院附属医院,山东 济宁272029)
子 宫 内膜异位 症(endometriosis、EMS)是1885年由VonreckLinghausen[1]首次提出并命名,是一种常见的妇科良性病变,但具有类似于恶性肿瘤的组织侵袭、血管生成等生物学行为,复发率高。以卵巢子宫内膜异位症最多见。其发病率约为6%~8%,在不孕、痛经等患者中,其发病率有所增加,约为30%~45%。近年来EMS有上升的趋势,严重影响了妇女的日常生活。关于EMS发病机制的研究被广泛关注,为阻断EMS的发生、发展提供新的有效的治疗靶点。本研究通过检测子宫内膜异位症组织中VEGF、CD44v6及MMP-9的表达,从而探讨其在EMS发病机制中可能的作用及相关性。
1 材料与方法
1.1 一般资料
选取济宁医学院附属医院2009年3月至2010年10月因卵巢囊肿行腹腔镜或开腹手术的患者,术后经病理证实为卵巢子宫内膜异位症60例作为研究组。在位内膜为卵巢子宫内膜异位症患者同时诊刮或切除子宫所得的内膜52例。选择同期在本院因子宫平滑肌瘤行子宫全切,且经病理证实无子宫内膜疾病及异位症患者的子宫内膜标本44例为对照组。所有患者年龄均35~46岁,均为增殖期子宫内膜,月经周期规律,术前3个月未应用激素治疗。各组间的年龄差别无统计学意义。
1.2 主要试剂
兔抗人VEGF、鼠抗人CD44v6及鼠抗人MMP-9单克隆抗体均购自福州迈新生物技术开发有限公司;链霉素抗生物素蛋白-过氧化物酶(SP)免疫组化试剂盒、DAB染色试剂等,购自北京中杉金桥生物技术有限公司。
1.3 方法
将蜡块标本进行5μm厚连续切片4张,1张用于HE染色复查,确定诊断。余者切片常规二甲苯脱蜡,梯度乙醇水化。采用SP法行CD44v6、VEGF和MMP-9检测。实验操作严格按说明书进行。以0.01mol/L PBS代替一抗作为阴性对照,以已知阳性标本为阳性对照。
结果判定:阳性均为棕黄色颗粒,分布于细胞膜和/或胞浆。具体如下:着色强度:不显色或显色不清为0;浅黄色为1;棕黄色为2;深褐色为3。阳性细胞百分率:阳性细胞百分数<5%,0分;5%~35%,1分;36%~65%,2分;>66%,3分。两项得分相加,0~1分为(-),2~3分为(+),4分及以上为(⧺)。
1.4 统计学方法
应用SSPS 13.0统计软件进行统计学分析,采用秩和检验,检验水准均为0.05,两分类变量的关联性分析。
2 结果
2.1 VEGF的表达
VEGF主要表达于子宫内膜腺上皮细胞的胞浆,灶性分布,在子宫内膜间质细胞、血管内皮细胞也有表达,但在上皮细胞的表达最强。阳性细胞胞浆呈棕黄色或棕褐色。3种子宫内膜中VEGF表达的分布差别有统计学意义。见表1。进一步两两比较,卵巢异位内膜VEGF的阳性表达明显高于在位内膜(Z=-5.725,P=0.000)与正常内膜(Z=-3.498,P=0.000),差异均有统计学意义;在内异症在位内膜中的阳性表达高于正常子宫内膜,差异有统计学意义(Z=-2.674,P=0.000)。

表1 3种子宫内膜中VEGF表达的等级比较
2.2 CD44v6的表达
CD44v6主要表达于子宫内膜腺上皮细胞、腔面上皮细胞。主要是细胞膜阳性,染成棕黄色。胞浆可有少量表达,但着色比胞膜浅,意义不明确。3种子宫内膜中CD44v6表达的分布差别有统计学意义。见表2。进一步两两比较,卵巢异位内膜CD44v6阳性表达高于在位内膜(Z=-5.610,P=0.000)与正常内膜(Z=-5.596,P=0.000),差异有统计学意义;内异症在位内膜与正常子宫内膜相比,阳性表达率较高,但差异无统计学意义(Z=-0.388,P=0.698)。
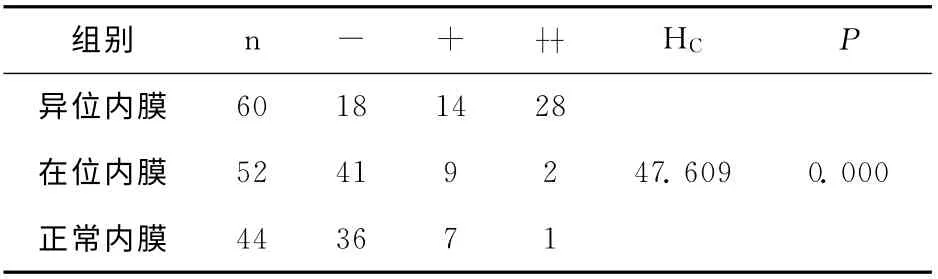
表2 3种子宫内膜中CD44v6表达的等级比较
2.3 MMP-9的表达
MMP-9主要表达于子宫内膜腺上皮细胞及间质细胞胞浆内,阳性细胞的胞浆被染成棕黄色或棕褐色。3种子宫内膜中MMP-9表达的分布差别有统计学意义。见表3。进一步两两比较,卵巢异位内膜MMP-9阳性表达明显高于在位内膜(Z=-4.957,P=0.000)与正常内膜(Z=-5.179,P=0.000),差异均有统计学意义;在内异症在位内膜中的阳性表达略高于正常子宫内膜,但无统计学意义(Z=-0.388,P=0.698)。
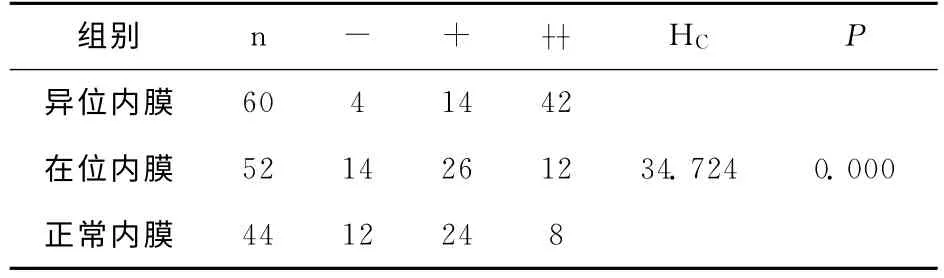
表3 3种子宫内膜中MMP-9的表达等级比较
2.4 VEGF、CD44v6和MMP-9在异位内膜组织中表达的相关性
采用两分类变量的关联性分析,异位内膜组VEGF和CD44v6呈正相关(r1=0.462,χ2=42.038,P=0.000);MMP-9与CD44v6之间呈正相关(r2=0.558,χ2=70.534,P=0.000);MMP-9与VEGF呈正相关(r3=0.397,χ2=29.187,P=0.000)。
3 讨论
子宫内膜异位症(EMS)的发病机制不明,众说纷纭,目前仍以经血逆流种植学说为主导理论。然而有经血逆流的妇女中只有10%~15%的人发生EMS。有些国内学者提出“在位内膜决定论”。即内膜细胞在异位处生长、发育、出血并引起临床症状。CD44v6、MMP-9与VEGF直接影响着异位的子宫内膜的黏附、侵袭和局部血管形成等生物学特性。
3.1 VEGF与EMS的关系
血管内皮生长因子(VEGF)是血小板衍生生长因子超家族的成员,分子量为34~36KDa,是一种多肽类生长因子。VEGF蛋白主要灶性表达于腺上皮细胞的胞浆。Takehara等[2]研究发现,EMS患者的子宫内膜中VEGF-A mRNA和VEGF-C mRNA表达比非EMS患者明显增高。近期的研究发现EMS患者中VEGF基因型和表达频率与正常人存在明显的差异[3]。
本文结果显示:免疫组化显示VEGF阳性细胞胞浆着色,被染成棕黄色。本研究中VEGF在卵巢异位内膜中的表达均显著高于在位内膜和正常子宫内膜,表明在异位内膜中VEGF含量高,与异位内膜种植中血管的形成及增生有一定关系。VEGF是一种多肽类生长因子,主要参与调控血管生成。其表达高低反映了该组织的血管生成的活性。异位内膜病灶内血管的数量及面积明显高于在位内膜。它直接作用于内皮细胞,通过和血管内皮细胞的特异性受体结合,促进内皮增殖和血管生长。同时,能增加血管通透性,促进包括纤维蛋白原在内的血浆蛋白的渗出[4],因而间质高度血管化,进一步促进异位内膜的种植和增殖。Fujii等[5]发现子宫内膜异位症患者血清中VEGF含量增加,VEGF的含量增高,能维持内膜异位部位的血管呈现较高的活性,刺激毛细血管增生,促进异位腺上皮细胞生长的同时促进异位内膜在该部位进一步增殖和浸润至盆腔和腹膜内组织,增大病灶的深度及范围,形成腹腔的异位灶,从而加重痛经的程度。Nap等[9]研究发现,抗人类VEGF抗体(HUMV833)可明显减少EMs鼠模型体内异位灶微血管密度,并能抑制内膜种植和生长。与本文结果一致,更有力的证实了VEGF在EMS的异位内膜在异位部位血管形成及种植过程中的重要性。
3.2 CD44v6与EMS的关系
CD44v6是细胞黏附分子中的一类,是CD44的一种异构体。是一类介导细胞与细胞、细胞与细胞外基质(ECM)黏附作用的膜表面糖蛋白,在上皮源性细胞和肿瘤中表达。CD44v6是透明质酸的主要受体和淋巴细胞归巢受体,能改变肿瘤细胞表面黏附分子的构成及功能,介导细胞与基质的粘连,参与细胞伪足的形成及肿瘤的发生、发展和转移。EMS具有恶性肿瘤侵袭性生长的恶性生物学行为,因而CD44v6在EMS发病机制中的作用不容忽视。
本文结果显示:CD44v6阳性腺上皮及腔面上皮细胞胞膜着色,被染成棕黄色,少量细胞胞浆内着色,比胞膜染色浅,间质细胞未见着色。有实验表明,CD44v6参与了子宫内膜细胞与腹膜表面间皮细胞黏附,淋巴细胞归巢受体的功能,能帮助子宫内膜细胞逃避腹腔液免疫细胞(NK细胞)的识别和杀伤,继而得以存活。CD44v6透明质酸受体的作用,可以帮助内膜细胞与腹膜间皮细胞的透明质酸配体黏附,异位的内膜细胞更易侵袭种植。本研究认为CD44v6在异位症发生中促进了异位的内膜细胞与周围组织黏附。
3.3 MMP-9与EMS的关系
MMP-9是MMPs家族中分子量最大的明胶酶,又称明胶酶B,分子量92kD,可降解Ⅳ型、Ⅴ型胶原及弹性蛋白等ECM的主要成分,参与细胞外基质降解和新血管形成,在许多恶性肿瘤组织中均可检测到MMP-9活性形式的表达。在子宫内膜异位病灶周围,有着连续、完整的基底膜,Ⅳ型胶原是其固有成分之一[10]。有实验表明,MMPs在正常情况下,表达量很少,而且以无活性的酶原形式存在,而在炎性细胞因子、激素、生长因子刺激下其表达量上升及活性增加,如胚胎发育、血管新生、子宫复旧、组织修复与重塑、炎症反应以及肿瘤的侵袭与转移等情况。Szamatowicz的研究结果证实[7],MMP-9可通过和整合素的相互活化而加强细胞间的黏附作用,同时促进血管内皮细胞的出芽,导致新生血管的形成,从而在子宫内膜细胞的异位黏附、种植和生长的过程中发挥重要作用。
本文结果表明:MMP-9在异位内膜组阳性表达率最高,其次为在位内膜组和正常内膜组,与邱晓红等[11]研究结果一致。MMP-9的高表达表明异位内膜细胞对ECM有着最强的降解能力,利于异位内膜的侵袭性种植和生长,进而破坏周围组织,使病变扩散,逐渐加重。提示EMS患者异位内膜细胞的生物热性与在位内膜细胞有差别,前者更具侵袭能力,因而能异位种植,这与沈蓉等[8]研究结果一致。目前有异位内膜孕激素受体显著低于正常子宫内膜的报道[12],因子宫内异症、子宫腺肌病患者在位内膜与异位内膜中,增殖期与分泌期的表达强度无明显差异,失去了周期性变化规律。MMP-9的蛋白水解活性破坏局部组织结构及基底膜成分,有利于腹腔的侵袭,同时在MMP-9促细胞间黏附和促血管形成的共同作用下,促使逆流入腹腔的内膜组织种植生长并使病灶不断扩大。
3.4 VEGF CD44v6及MMP-9在子宫内膜异位症发生中的协同作用
EMS的发生、发展是一个多步骤多阶段而且多个细胞因子相互作用的复杂过程。VEGF、CD44v6及MMP-9在EMS发生发展过程中,有各自独特的作用,同时又紧密关联,相互促进。异位的子宫内膜细胞必须具备黏附、侵袭及血管生成3个基本环节,才能在种植部位像肿瘤细胞一样生长。首先是异位内膜细胞在CD44v6作用下黏附在种植部位,其次MMP-9发挥降解基底膜糖蛋白及细胞外基质成分的作用,增强了异位内膜细胞的侵袭能力,再则VEGF促进异位部位的血管重建和增生,血管通透性增加,新的纤维及血管化间质建立,最终EMS得以发生和发展。在这个过程中,CD44v6为MMP-9定位于细胞表面提供了受体,同时可以通过与MMP-9结合而激活肿瘤坏死因子-β(TGFβ),导致新生的血管生成[13]。血管生成过程中的内皮细胞循环及血管结构形成均需要MMP-9对ECM的降解和重建,协同促进了EMs的发生发展。随着新药如MMPs抑制剂和VEGF抑制剂的问世以及在恶性肿瘤中的应用,为EMS的治疗提供了新的研究方向。
[1] O Down MJ,Philipp EE.The history of obstetrics and gynecology[M].New York:The Part henon Publishing Group,2000:523-525.
[2] Takehara M,Veda M,Yamashita Y,et al.Vascular endothelial growth factor A and C gene expression in endometriosis[J].Humpathol,2004,35(11):1369-1375.
[3] Kim SH,Choi YM,Choung SH,et al.Vascular endothelial growth factor gene+405C/G polymorphism advanced stage endometriosis[J].Hum Reprod,2005,20(10):2904-2908.
[4] Pepper MS,Ferrara N,Orci L,et al.Potent synergism between vascular endothelial grower factor and basic fibroblast growth factor in the induction of angiogenesis in vitro[J].Biochen Biophys Res Commun,1992,189(2):824-831.
[5] Fujii EY,Nakayama M,Nakagawa A.Concentrations of receptor for advanced glycation end products,VEGF and CML in plasma.follicular fluid,and peritoneal fluid in women with and without endometriosis[J].Reprod Sci,2008,15(10):1066-1074.
[6] 辛晓燕,李洁,严瑞兰,等.血管生成因子在子宫内膜异位症中的作用[J].现代妇产科进展,2001,10(3):187-189.
[7] Szamatowicz J,Laudanskip,Tomaszewska I,et al.Matrixmetalloproteinase-9and tissue inhibitor of matrix metalloproteinase-1:apossible role in the pathogenesis of endometriosis[J].Hum Reprod,2002,17(2):284-288.
[8] 沈蓉,田永杰.MMP-9、TIMP-1在子宫内膜异位症患者子宫内膜中的表达及意义[J].山东医药,2006,46(17):20-22.
[9] Nap AW,Griffion AW,Dunselmang A,et al.Anti-angiogenesistherapy for endometriosis[J].J Clim Endocdol Metal,2004,89(3):1089-1095.
[10]Evers JL,Willebrand D.The basement membrance in endometriosis[J].Fertil Steril,1987,47(3):505-507.
[11]邱晓红,李荷莲.基质金属蛋白酶MMP-2MMP-9及其抑制因子TIMP-1TIMP-2在子宫内膜异位症中的表达及意义[J].中国实用妇科与产科杂志,2004,20(3):158-160.
[12]Lu XE,Ning WX,Dong MY,et al.Vascular endothelial growth factor and matrix metalloproteinase-2expedite formation of endometriosis in the early stage ICR mouse model[J].Fertil Steril,2006,8:1175-1181.
[13]Yu Q,Stamenkovic I.Cell surface-localized matrix metalloproteinase-9proteolytically activates TGF-βand promotes tumor invasion and angiogenesis[J].Genes Dev,2000,14(2):163-176.
