骨肉瘤miR-96的表达与细胞增殖和凋亡
2013-06-09
南昌大学第一附属医院骨一科,江西 南昌,330006
骨肉瘤miR-96的表达与细胞增殖和凋亡
吴德明 刘翔 江川 戴闽
南昌大学第一附属医院骨一科,江西 南昌,330006
背景与目的:微小RNA(microRNA,miRNA)是一类内源性的非编码小分子RNA,其主要通过与靶mRNA作用抑制转录后的翻译。miR-96是在多类肿瘤细胞中高表达的小RNA分子。本研究旨在检测miR-96在骨肉瘤组织中的表达,并研究其在骨肉瘤细胞的增殖、细胞周期及凋亡中的意义。方法:运用TagMan MGB探针法检测40例骨肉瘤组织及对应的骨组织中miR-96的表达;应用反义技术降低骨肉瘤细胞(U2-OS和MG-63)中miR-96的表达;采用MTT比色法检测细胞增殖的改变;应用流式细胞技术检测骨肉瘤细胞细胞周期和凋亡情况。结果:在40例骨肉瘤组织中,62.5%(25/40)的骨肉瘤组织miR-96表达明显高于对应骨组织(P<0.05);反义miR-96转染骨肉瘤细胞U2-OS和MG-63后,miR-96的表达明显降低,U2-OS和MG-63骨肉瘤细胞生长受到明显抑制,其生长主要停滞在G0/G1期,而S期和G2/M期细胞的比例下降。另外,降低miR-96的表达,U2-OS和MG-63骨肉瘤细胞早期凋亡明显增加。结论:miR-96在骨肉瘤组织中表达明显上调,降低其表达能明显抑制U2-OS和MG-63骨肉瘤细胞的生长,并诱导细胞早期凋亡增加,miR-96可能成为骨肉瘤基因表达调控的新靶点。
骨肉瘤;miR-96;反义单核苷酸;肿瘤抑制
骨肉瘤是最常见的原发性骨恶性肿瘤之一,约占骨恶性肿瘤的33%。它来源于有成骨潜能的间叶细胞,由恶性增殖的肉瘤细胞直接产生肿瘤性骨样组织或不成熟骨,也称为成骨肉瘤,其恶性程度极高,可严重损害劳动生产力及危及患者生命,因此早期诊断及早期治疗具有特别重要的意义[1]。
微小RNA 分子(miRNA)是长度约为21个核苷酸的非编码小分子RNA,可以在基因转录后水平调节蛋白质的生物合成,参与了细胞生物活动调控的多个环节。另外,多数miRNA具有高度时序性、保守性和细胞组织特异性,同时受到发育和空间的调控,从而参与细胞的增殖、分化和死亡过程[2]。正常组织中某种或某些miRNA的表达失调,导致细胞内许多发挥重要作用的瘤基因或抑瘤基因受到异常调控而导致表达失常,从而使肿瘤发生。在恶性肿瘤发生、发展中,miRNAs扮演着“癌基因”和(或)“抑癌基因”的双重角色[3]。近年研究发现miR-96在胱膀癌、乳腺癌、肺癌及结肠癌等恶性肿瘤中表达上调[4-7],在恶性肿瘤的发生发展中发挥重要作用。本研究拟采用TagMan MGB探针法检测miR-96在骨肉瘤组织中的表达情况,同时用反义技术降低骨肉瘤细胞miR-96的表达,观察骨肉瘤细胞生长及细胞周期和凋亡情况,以便为骨肉瘤早期诊治提供新的理论和试验基础。
1 材料和方法
1.1 标本
收集2008年9月—2012年5月南昌大学第一附属医院矫形外科40例骨肉瘤及对应骨组织手术标本,所有标本均经病理学检查确诊,其中男性27例,女性13例,年龄11~47岁。本实验经南昌大学第一附属医院医学伦理委员会批准及患者知情同意。
1.2 试剂和仪器
DMEM高糖培养基(美国Gibco公司)、脂质体LipofectamineTM2000(美国Invitrogen公司);胎牛血清(美国Gibco公司)、TaqMan miRNA分析试剂盒(美国ABI公司);Annexin V-FITC凋亡检测试剂盒(北京宝赛生物技术有限公司);反义miR-96寡核苷酸(AMO-miR-96)(美国Invitrogen公司);人骨肉瘤细胞系U2-OS和MG-63(中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库);实时荧光定量PCR分析仪7500(美国ABI公司),流式细胞仪(美国BD公司)。
1.3 方法
1.3.1 TagMan MGB探针法检测miR-96的表达
采用TRIzol试剂提取骨肉瘤及对应骨组织中总RNA,采用紫外分光光度计测定浓度,-80 ℃保存待用,用TaqMan miRNA分析试剂盒检测miR-96的表达。首先取2 μg总RNA为反应模板,与3 μL逆转录酶相互混合,反应体系为20 μL,反应条件为:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min。反应结束后,收集cDNA,将其稀释150倍,然后取2 μLTaq Man引物与1 μL 稀释的cDNA相混合,20 μL反应体系:95 ℃ 10 min,随后95 ℃ 15 s,60 ℃ 60 s,40个循环。相对miRNA表达用Ct值精确计算,以U6 snRNA作为内参。
1.3.2 反义miR-96单核苷酸序列设计
依据miRBase(http://www.sanger.ac.uk/ software/Rfam/miRna)所提供的miRNA测序序列,获取人miR-96的基因序列,并设计其反义寡核苷酸序列,同时运用核酸序列数据库检索程序以排除其他的同源序列。另外,我们同时设计一条随机对照序列,miR-96顺义链:5’-AGCACAUUUUUGCUUGUGUCU-3’,miR-96反义链:5’-AGACACAAGCAAA AATGTGCT-3’。随机序列顺义链:5’-UCCUCUGAACGUGGCACGUUT-3’;反义链:5’-AGCUCACTCGUCCGCAGTATT -3’,送Invitrogen公司合成,PAGE纯化,全硫代修饰。
1.3.3 细胞株的培养及转染
将U2-OS和MG-63骨肉瘤细胞接种于DMEM培养基(含10%胎牛血清),在CO2体积分数为5%、37 ℃条件下培养。严格遵照LipofectamineTM2000转染试剂盒操作程序进行转染,反义miR-96寡核苷酸终浓度分别为:50、100、150、200 nmol/L,本研究前期初步筛选出最佳终干扰浓度为100 nmol/L。转染后培养时间分别为24、48、72 h,初步筛出最佳作用时间为48 h。将荧光对照的反义寡核苷酸转染后放置于倒置荧光显微镜下进行观察, 上述操作重复3次。转染效率为(87.5±6.0)%。
1.3.4 转染反义miR-96单核苷酸后对miR-96表达的影响
转染反义miR-96单核苷酸48 h后,提取总RNA,将其逆转录为cDNA,运用紫外分光光度计测定cDNA浓度,同时设立空白对照组、随机对照组及转染PBS组。运用TaqMan miRNA分析试剂盒检测miR-96的表达(具体条件同1.3.1)。
1.3.5 MTT检测各组细胞的增殖
收集U2-OS和MG-63细胞,将各组细胞悬液在离心管内反复充分打匀,接种于96孔培养板(6×103/孔),24 h后换液。实验分组同1.3.4,每组设立6个复孔。转染后1~4 d每孔加入浓度为5 mg/mL的 MTT试剂20 μL,在体积分数为5%的CO2、37 ℃条件下继续温育4 h。 用移液器吸取各孔上清液, 加入DMSO 150 μL/孔,在室温条件下置水平摇床摇10 min以充分完全溶解MTT结晶。测定各孔吸光值(波长490 nm)。每组重复3次。按下列公式计算细胞生长抑制率(%):细胞生长抑制率=(A490实验组-A490对照组)/A490对照组×100%。
1.3.6 流式细胞术分析细胞周期变化情况
实验分组同1.3.4。细胞接种于6孔板,转染反义miR-96单核苷酸48 h后收集细胞,PBS漂洗2次,离心后弃上清液,加入PBS重悬细胞,加-20 ℃预冷的75%乙醇并振荡充分混合,4 ℃固定1 h,离心后弃冰乙醇,PBS漂洗1遍,弃上清液;加入碘化吡啶(浓度为50 μg/mL PI)和无DNA酶污染的RNA酶PBS染色液(浓度为100 μg/mL),4 ℃避光静置1 h,上机检测。每组重复3次。
1.3.7 流式细胞术分析细胞早期凋亡
实验分组同1.3.4,细胞接种6孔板,转染反义miR-96寡核苷酸。48 h后收集细胞, 制成单细胞悬液,PBS洗2次, 离心后弃上清液。应用Annexin V-FITC早期凋亡试剂盒,流式细胞仪检测细胞早期凋亡情况。
1.4 统计学处理
2 结 果
2.1 骨肉瘤组织miR-96的表达情况
用实时荧光定量PCR检测40例骨肉瘤及对应骨组织miR-96的表达,结果发现62.5%(25/40)的骨肉瘤组织miR-96表达明显高于相对应的骨组织,差异有统计学意义(P<0.05,图1);另外37.5%(15/40)的骨肉瘤组织miR-96的表达与相对应的骨组织的表达差异无统计学意义(P>0.05)。
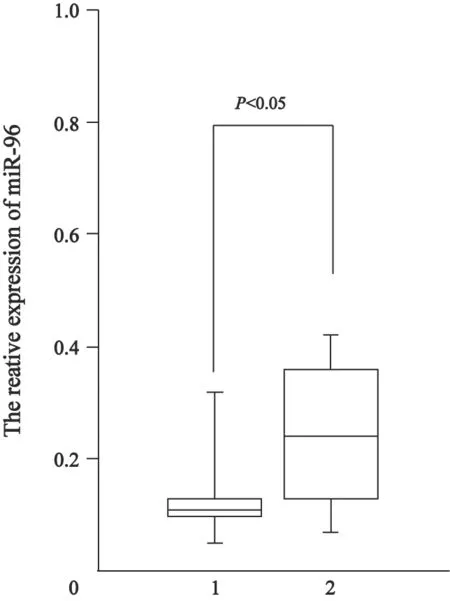
图 1 实时荧光定量PCR检测骨肉瘤及骨组织miR-96的表达Fig. 1 Analysis the expression level of miR-96 in osteosarcoma and their adjacent nontumorous tissues using quantitative PCR
2.2 AMO-miR-96转染后miR-96表达的变化
利用反义核苷酸技术,将反义miR-96寡核苷酸(浓度为100 nmol/L)转染至骨肉瘤细胞U2-OS和MG-63中48 h后,实时荧光定量PCR检测发现,miR-96的表达较对照组明显降低(P<0.05),而空白对照组、随机对照组及PBS组间差异无统计学意义(图2)。

图 2 实时荧光定量PCR检测AMO-miR-96转染后miR-96表达Fig. 2 Analysis the expression of miR-96 in AMO-miR-96 transfected osteosarcoma cells using quantitative PCR
2.3 AMO-miR-96作用后对骨肉瘤细胞生长的抑制作用
转染AMO-miR-96的骨肉瘤细胞生长明显慢于对照组(P<0.05),而空白对照组、随机对照组及转染PBS组间骨肉瘤细胞的生长无明显差异(P>0.05,图3)。
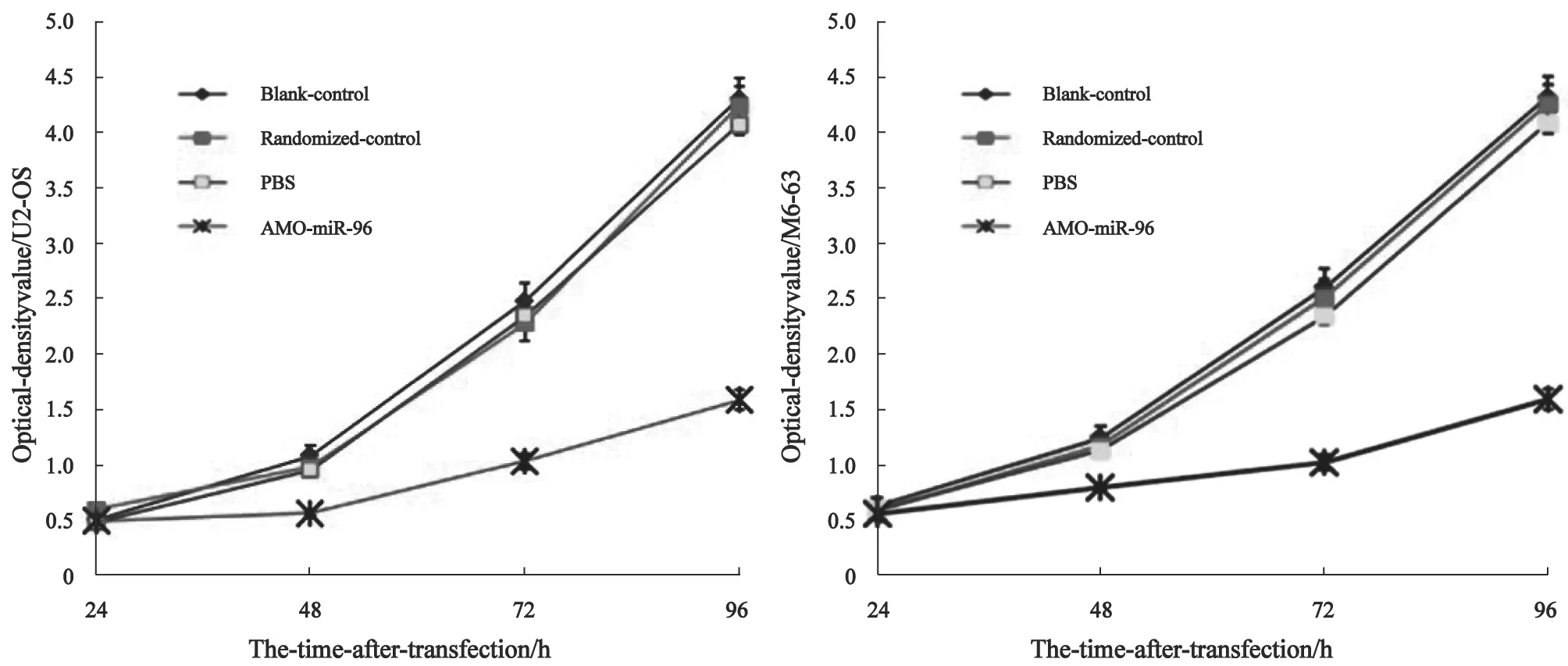
图 3 AMO-miR-96作用后对骨肉瘤细胞生长的抑制作用Fig. 3 The osteosarcoma cells growth was significantly inhibited in AMO-miR-96 transfected osteosarcoma cells
2.4 流式细胞术分析转染AMO-miR-96后骨肉瘤细胞周期变化情况
转染AMO-miR-96后的骨肉瘤细胞U2-OS和MG-63通过流式细胞周期分析发现,转染AMO-miR-96后U2-OS和MG-63细胞阻滞于G0/G1期,而S期和G2/M期明显降低。数据经χ2检验,实验组较空白对照组、随机对照组及PBS组差异有统计学意义(P<0.05),而空白对照组、随机对照组及PBS组间差异无统计学意义 (P>0.05,表1、2)。
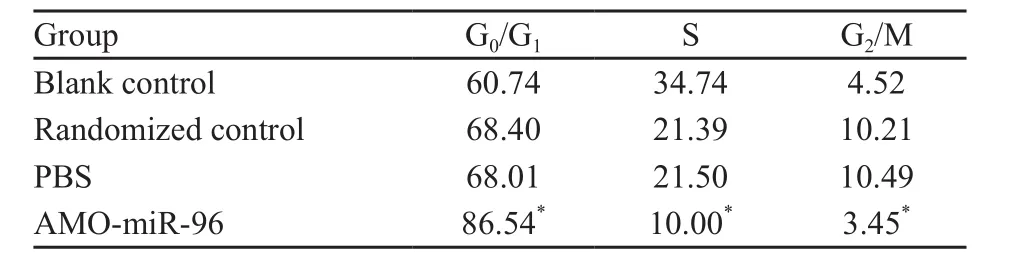
表 1 AMO-miR-96转染U2-OS细胞降低miR-96表达后细胞周期变化Tab. 1 The changes of cell cycle after AMO-miR-96 transfected U2-OS cells %

表 2 AMO-miR-96转染MG-63细胞降低miR-96表达后细胞周期变化Tab. 2 The changes of cell cycle after AMO-miR-96 transfected MG-63 cells
2.5 流式细胞术分析转染AMO-miR-96后骨肉瘤细胞凋亡情况
骨肉瘤细胞转染AMO-miR-96后,U2-OS细胞转染AMO-miR-96组(22.2%)较空白对照组(3.64%)、随机对照组(4.36%)、转染PBS组(5.14%)早期凋亡明显增加(P<0.05),MG-63细胞转染AMO-miR-96组(16.91%)较空白对照组(3.59%)、随机对照组(4.21%)、转染PBS组(4.36%)早期凋亡也明显增加(P<0.05);而U2-OS细胞转染AMO-miR-96组(7.53%)、空白对照组(5.12%)、随机对照组(4.40%)、转染PBS组(6.40%)之间晚期凋亡无明显改变;MG-63细胞转染AMO-miR-96组(7.47%)、空白对照组(6.34%)、随机对照组(8.19%)、转染PBS组(10.13%)之间晚期凋亡也未见明显变化(图4)。
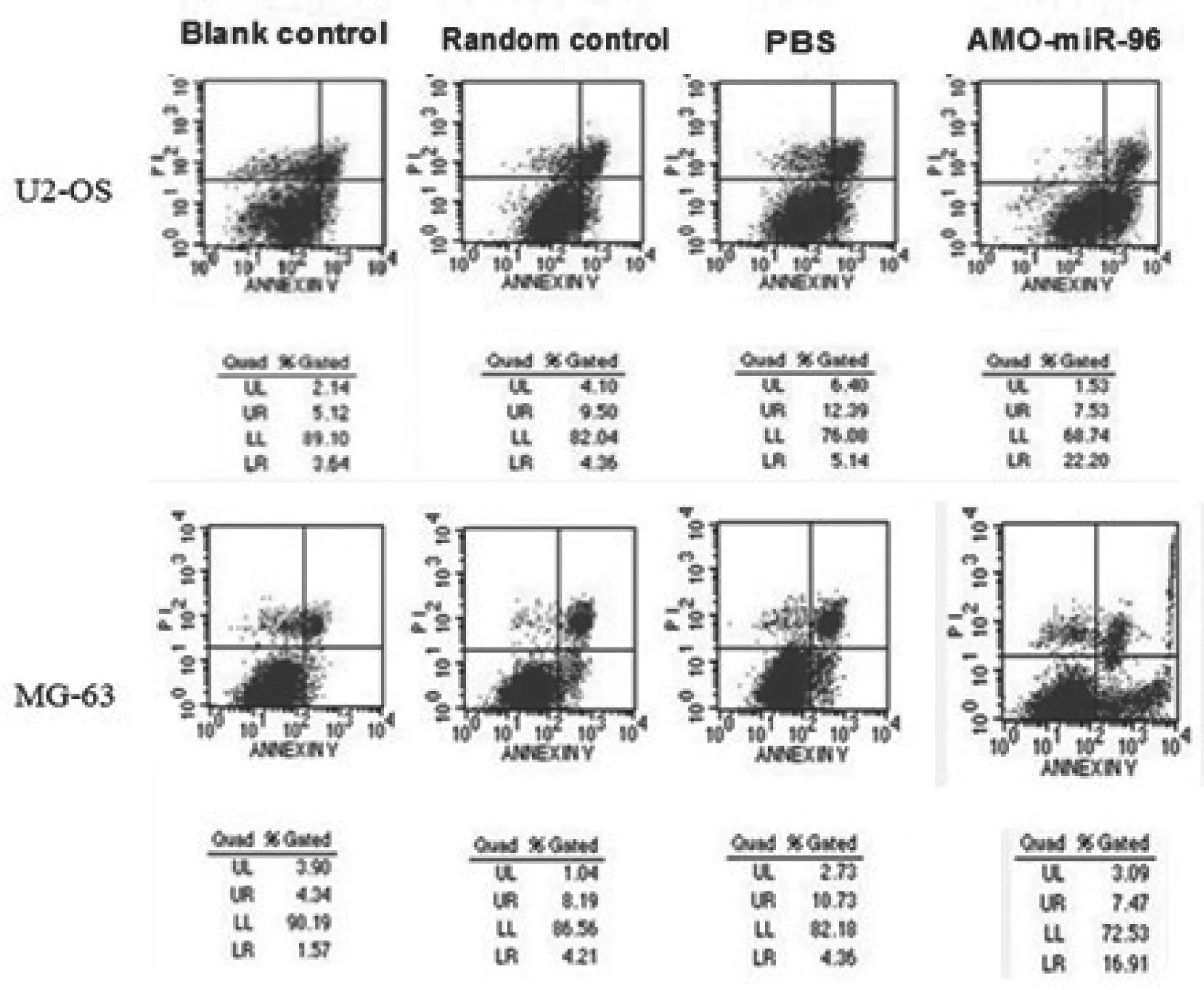
图 4 流式细胞术分析转染AMO-miR-96后骨肉瘤细胞凋亡情况Fig. 4 Flow cytometric analysis the osteosarcoma cells apoptosis after AMO-miR-96 transfected osteosarcoma cells
3 讨 论
miRNAs是一类新的基因调控因子,在控制细胞的生长发育、分化、血管形成、凋亡等过程中发挥着十分重要的作用[3,8]。miRNA通过与靶mRNA的3’非编码区近乎完全互补结合在转录后水平使其降解,或者与之不完全互补结合在翻译水平抑制蛋白合成,从而在基因表达中发挥重要的调节作用。随着越来越多的miRNA被鉴定和深入研究,近年来研究发现miRNAs与恶性肿瘤关系密切,大约有调控miRNAs编码基因位的52%位于肿瘤相关染色体区域[9-10]。有研究者认为miRNA实际上可作为癌基因或者抑癌基因而发挥作用。因此miRNAs可能成为诊断肿瘤的新的分子标志和判断肿瘤治疗及预后的分子靶点,而且miRNAs在转录后水平调节靶基因的表达,更有助于恶性肿瘤的早期发现、早期诊断和早期治疗,其必将具有广阔的临床应用前景[11]。
骨肉瘤是起源于成骨组织的一种原发性恶性肿瘤,好发于青少年长管状骨的干端,恶性程度高,预后差。虽然放化疗及手术治疗的水平在逐渐提高,但仍约有50%的患者治疗失败,原因就在于肿瘤的早期转移以及耐药性的出现[1,12]。因此,急需找到新的肿瘤标志物来进一步提高骨肉瘤的早期诊疗效果。近年随着miRNAs研究的不断深入,发现大量异常表达的miRNAs通过调控靶基因的表达而调节包括骨肉瘤在内的多种恶性肿瘤的发生发展,因此大规模的筛选肿瘤发生发展过程中异常表达的miRNAs将为人们全面认识肿瘤的生物学特性发挥重要作用,也为骨肉瘤的早期诊治提供了新的希望。最近研究发现miR-96在多种恶性肿瘤中表达失调[4-7]。此外,Chen等[13]研究发现,降低miR-96的表达可以明显抑制肝癌细胞的侵袭迁移能力。但miR-96在骨肉瘤中的表达及作用目前尚不清楚。
我们首先通过TagMan MGB探针法定量分析40例骨肉瘤及对应骨组织中miR-96的表达,结果发现62.5%(25/40)的骨肉瘤组织miR-96表达上调(P<0.05)。与miR-96在胱膀癌、乳腺癌等其他恶性肿瘤中的表达基本相符[4-7]。另外,Krützfeldt等[14]针对miRNA192的反义寡核苷酸能够明显抑制小鼠不同组织中相对应microRNAs的表达,这表明针对miRNAs设计的反义寡核苷酸能够有效抑制microRNAs的表达,随后本研究也用反义核苷酸技术成功降低骨肉瘤细胞U2-OS和MG-63内的miR-96表达,并成功筛选出其最佳作用浓度和时间。众所周知,细胞的增殖过程是通过细胞周期来完成的,恶性肿瘤的有序增殖取决于细胞周期的精确调控,因而采用多种手段、多种途径干扰或阻断肿瘤细胞的周期活动可以达到有效抑制肿瘤增殖的目的。因此我们转染终浓度为100 nmol/L的AMO-miR-96到U2-OS和MG-63骨肉瘤细胞48 h后,应用荧光定量PCR反应检测发现miR-96表达抑制率达76%,同时也运用MTT法检测发现U2-OS和MG-63骨肉瘤细胞的生长受到明显抑制。最后应用流式细胞术检测转染AMO-miR-96后的骨肉瘤细胞的细胞周期各期DNA的含量及细胞早期凋亡情况,结果发现,干扰miR-96基因表达后,两组细胞的细胞周期主要停滞于G0/G1期,而S期和G2/M期细胞数量的比例明显降低,并且两组细胞的早期凋亡数量也明显增加。
综上所述,miR-96在调控骨肉瘤细胞的增殖和凋亡方面发挥重要作用,其很可能成为一个骨肉瘤新的癌前标记物,为骨肉瘤临床基因治疗提供新的靶点。但其具体的作用机制有待于我们进一步深入研究。
[1] CAMPBELL W C, CANALE S T, BEATY J H. Campbell’s Operative Orthopaedics [M]. 11thedition, Mosby, 2008: 901-902.
[2] ZENG Y. Principles of micro-RNA production and maturation[J]. Oncogene, 2006, 25(46): 6156-6162.
[3] CROCE C M. Causes and consequences of microRNA dysregulation in cance [J]. Nat Rev Genet, 2009, 10(10): 704-714.
[4] WANG Y, LUO H, LI Y, et al. hsa-miR-96 up-regulates MAP4K1 and IRS1 and may function as a promising diagnosticmarker in human bladder urothelial carcinomas [J]. Mol Med Report, 2012, 5(1): 260-265.
[5] LIN H, DAI T, XIONG H, et al. Unregulated miR-96 induces cell proliferation in human breast cancer by down regulating transcriptional factor FOXO3a [J]. PLoS One, 2010, 5(12): e15797.
[6] ZHU W, LIU X, HE J, et al. Overexpression of members of the microRNA-183 family is a risk factor for lung cancer: a case control study [J]. BMC Cancer, 2011, 11: 393.
[7] SARVER A L, FRENCH A J, BORRALHO P M, et al. Human colon cancer profiles show differential microRNA expression depending on mismatch repair status and are characteristic of undifferentiated proliferative states [J]. BMC Cancer, 2009, 9: 401.
[8] STEFANI G, SLACK F J. Small non-coding RNAs in animal development [J]. Nat Rev Mol Cell Biol 2008, 9(3): 219-230.
[9] ESQUELA-KERSCHER A, SLACK F J. Oncomirs -microRNAs with a role in cancer [J]. Nat Rev Cancer, 2006, 6(4): 259-269.
[10] CALIN G A, CROCE C M. MicroRNA signatures in human cancers [J]. Nat Rev Cancer, 2006, 6(11): 857-866.
[11] JEMAL A, SIEGEL R, WARD E, et al. Cancer statistics, 2008. [J] CA Cancer J Clin, 2008, 58(2): 71-96.
[12] NIKIFOMVA M N, TSENG G C, STEWARD D, et al. MicroRNA expression profiling of thyroid tumors:biological significance and diagnostic utility [J]. J Clin Endocrinol Metab, 2008, 93(5): 1600-1608.
[13] CHEN R X, XIA Y H, XUE T C, et al. Suppression of microRNA-96 expression inhibits the invasion of hepatocellular carcinoma cells [J]. Mol Med Report, 2012, 5(3): 800-804.
[14] KRÜTZFELDT J, RAJEWSKY N, BRAICH R, et al. Silencing of microRNAs in vivo with “antagomirs' [J]. Nature, 2005, 438(7068): 685-689.
《中国癌症杂志》2013年征订启事
《中国癌症杂志》是由国家教育部主管、复旦大学附属肿瘤医院主办的全国性肿瘤学术期刊,读者对象为从事肿瘤基础、临床防治研究的中高级工作者。主要报道内容:国内外研究前沿的快速报道、专家述评、肿瘤临床研究、基础研究、文献综述、学术讨论、临床病理讨论、病例报道、讲座和简讯等。《中国癌症杂志》已入选中文核心期刊、中国科技核心期刊及全国肿瘤类核心期刊,并为中国科技论文统计源期刊,先后被“中国期刊网”、“万方数据——数字化期刊群”和“解放军医学图书馆数据库(CMCC)”等收录。
《中国癌症杂志》为月刊,大16开,80页铜版纸(随文彩图),每月30日出版,单价8元,全年96元。国际标准刊号1007-3639,国内统一标准刊号CN31-1727/R,邮发代号4-575。
读者可在当地邮局订阅,漏订者可直接向本刊编辑部订阅。
也欢迎广大作者来稿。
主 编:沈镇宙
主 任:秦 娟
联系地址:上海市东安路270号复旦大学附属肿瘤医院内《中国癌症杂志》编辑部
邮 编:200032
电 话:021-64188274;021-64175590×3574
网 址:www.china-oncology.com
电子邮件:zgaz@163.com
miR-96 expression in osteosarcoma and the role in cell proliferation and apoptosis
WU De-ming, LIU Xiang, JIANG Chuan, DAI Min (Department of Orthopaedics, the First Affiliated Hospital of Nanchang University, Nanchang Jiangxi 330006, China)
DAI Min E-mail: leizhen6677@163.com
Background and purpose: MicroRNAs are small non-coding endogenous RNA molecules that can inhibit protein translation partly through binding with target mRNAs. MiR-96 is over expressed in many kinds of human tumor cells. The present study aimed to investigate the expression of miR-96 in osteosarcoma tissues and demonstrate its role in osteosarcoma cell lines proliferation, cell cycle and apoptosis. Methods: The expressions of miR-96 in 40 pairs of osteosarcoma and their adjacent nontumorous tissues were detected by TagMan MGB probe method. The antisense technology was used to decrease the expression of miR-96 in osteosarcoma cells (U2-OS, MG-63), MTT assay and flow cytometry were performed to investigate the effect of miR-96 on the cell proliferation, cell cycles and apoptosis. Results: We examined miR-96 expression levels in 40 pairs of human osteosarcoma and their corresponding nontumorous tissues. miR-96 was found to be over-expressed in 62.5% (25/40) of the osteosarcoma cases (P<0.05). The cell growth ability of U2-OS and MG-63 cells was significantly inhibited following transfection of antisense-microRNA-oligonucleotides-96 (AMO-miR-96). U2-OS and MG-63 cells were mainly detained in G0/ G1, and the percentage of cells at S and G2/M decreased. In addition, knocking down the expression of miR-96 in U2-OS and MG-63 cells resulted in an increase in early apoptosis. Conclusion: miR-96 is over-expressed in human osteosarcoma. Inhibition of miR-96 expression can not only effectively suppress the growth of U2-OS and MG-63 cells, but also induce cell apoptosis. MiR-96 may serve as a new molecular target for the regulation of gene expression in osteosarcoma.
Osteosarcoma; miR-96; Antisense oligonucleotides
10.3969/j.issn.1007-3969.2013.04.008
R738.1
:A
:1007-3639(2013)04-0285-07
2010-10-17
2013-03-13)
戴闽 E-mail:leizhen6677@163.com
