微小RNA-187*在结直肠癌组织中表达及其对结肠癌细胞凋亡的影响
2013-06-09
河北医科大学第一医院普通外科,河北 石家庄 050031
微小RNA-187*在结直肠癌组织中表达及其对结肠癌细胞凋亡的影响
刘博 田延锋 赵增仁 樊智彬 张丽静 贺新奇 高利飞
河北医科大学第一医院普通外科,河北 石家庄 050031
背景与目的:微小RNA(microRNA, miRNA)在细胞分化、细胞周期及凋亡过程中发挥重要作用。miRNA通过扩增、缺失、突变和沉默等机制影响癌症的发生、发展。本研究探讨miR-187*在结直肠癌组织中的表达和临床意义,以及上调miR-187*表达量对结肠癌细胞凋亡的影响。方法:采用实时荧光定量反转录聚合酶链反应(real-time quantitative reverse transcription-PCR,real-time PCR)的方法在40例结直肠癌患者组织标本中检测miR-187*的表达水平,结合病理资料分析其临床意义。HCT116细胞转染miR-187*mimics后,用Annexin-Ⅴ FITC/PI流式细胞术检测miR-187*对凋亡的影响。结果:miR-187*在结直肠癌组织中表达量为0.165(0.106,0.428),明显低于正常黏膜组织表达量[0.334(0.211,0.712)],差异有统计学意义(P<0.05),且在黏液癌及高龄患者中下调更明显(P<0.05)。将miR-187*mimics转染至HCT116中可提高其表达量,通过流式技术检测发现,与对照组早期凋亡率[(23.010±1.279)%]相比较,实验组早期凋亡率[(26.748±1.098)%]升高,差异有统计学意义(P<0.05)。结论:miR-187*在结直肠癌组织中低表达,并且与组织学类型及年龄有关;miR-187*表达上调可促进HCT116早期凋亡;miR-187*具有潜在抑癌作用。
结直肠肿瘤;微小RNA;microRNA-187*;凋亡
结直肠癌是常见的恶性肿瘤之一。美国全球癌症统计分析报告显示:结直肠癌在常见癌症中位居前三。2008年,全球范围内新增约1 200万结直肠癌患者,其中60.8万例死亡(占所有癌症死亡人数的8%,成为第四大最常见的癌症死亡的原因)[1]。我国农村和城市结直肠癌发病率均呈逐年升高趋势[2],结直肠癌的发病机制仍不明确。miRNA的出现为结直肠癌的研究提供了新的切入点。miRNAs是一类小的可调控基因表达的内源性非编码RNA,长度为19~24 bp,广泛存在于真核细胞生物中,主要在转录后水平调控基因表达功能。miRNA在肿瘤的发生、发展中所扮演的角色受到越来越多研究者的关注,结合表观遗传学探讨其表达调节也是当前研究热点[3]。本课题组早期利用基因芯片技术对miRNAs进行筛查发现,miR-187*在结直肠癌组织中低表达。查阅文献发现miR-187*参与冠心病[4]、男性胸主动脉瘤[5]疾病发生、发展的调控,但对miR-187*在肿瘤中研究的文献较少。本研究旨在探讨miR-187*在结直肠癌组织中的表达、临床意义;上调miR-187*表达量对结肠癌细胞凋亡的影响。
1 材料和方法
1.1 材料
1.1.1 临床标本
收集2011年5月—2012年5月河北医科大学第一医院、河北医科大学第四医院结直肠癌手术标本40例。每例标本分别取自结直肠原发肿瘤组织及上(下)切缘正常黏膜且术后病理证实无癌组织侵犯。新鲜标本离体后迅速置于液氮中,于-80 ℃保存。40例患者术前未接受任何化疗和放疗。
1.1.2 细胞株
结肠癌细胞株HCT116由香港中文大学消化疾病研究所于君馈赠。
1.1.3 主要试剂
McCoy’s 5A培养液、胎牛血清(FBS)、青霉素链霉素(PEST)均购自美国Gibco公司。胰蛋白-乙二胺四乙酸(EDTA)消化液购自北京诺博莱德科技有限公司。Annexin V-FITC试剂盒购自深圳欣博盛生物科技有限公司。miR-187* mimics和negative control转染试剂盒购自广州锐博生物科技有限公司。LipofectmanineTM2000及TRIzol试剂均购自美国Invitrogen公司。实时荧光定量反转录聚合酶链反应(real-time quantitative reverse transcription-PCR,real-time PCR)采用All-in-One™ miRNA qRT-PCR 检测试剂盒、内参U6、miR-187*的引物均购自广州复能基因有限公司。
1.2 实验方法
1.2.1 细胞培养
HCT-116细胞使用McCoy's 5A培养液,并在细胞培养液中加入10% FBS及1×PEST,在37 ℃,CO2体积分数为5%的水饱和湿度条件下培养。每1~2 d换液传代1次。当细胞生长至106~107时收集细胞,备用提取RNA。
1.2.2 细胞转染
转染前1天,将适量(约4×104~5×104)细胞接种在24孔细胞培养板上,每孔加入不含抗生素的细胞培养液400 µL。密切观察细胞生长情况,当细胞密度达到 30%~50%时,开始进行实验组(miR-187* mimics)和对照组(negative control, NC)的转染。用50µL的不含血清培养基Opti-MEM 对1.25 µL浓度为20 µmol/L的miR-187* mimics和negative control进行稀释,轻轻振荡混匀,室温下温育5 min。用50 µL的不含血清培养基Opti-MEM 对1 µL LipofectmanineTM2000进行稀释,轻轻振荡混匀,室温下温育5 min。将稀释好的miR-187* mimics和negative control和LipofectmanineTM2000混合,轻柔混匀,室温下温育20 min,以形成混合物。100 µL混合物加到培养板的孔中,轻轻摇晃细胞培养板使其与培养液混匀。将细胞培养板置于CO2体积分数为5%的培养箱中,在37 ℃下培养4~6 h后,移除每孔中含有混合物的培养液,更换新的培养液。继续在37 ℃、CO2体积分数为5%的条件下培养24 h后,进行转染后的其他实验检测。
1.2.3 细胞凋亡检测
取实验组及对照组细胞数量约为106,用4 ℃无菌PBS液洗涤细胞2次,用250 μL结合缓冲液将细胞稀释为浓度2×105~5×105/mL细胞悬浮液。取195 µL细胞悬浮液加入5 µL FITC标记的Annexin-Ⅴ,混匀后静置3 min,然后加入10 µL浓度为20 µg/mL的PI。混匀后室温避光温育10 min。加入300 µL的结合缓冲液,混匀,立即进行流式细胞仪检测。实验重复3次,每次做3个复孔。
1.2.4 组织标本及结直肠癌细胞株中总RNA的提取
患者的组织标本或细胞标本中加入1 mL TRIzol匀浆,室温下静置5 min;加入0.2 mL氯仿,振荡混匀后静置5 min;4 ℃ 15 000×g离心15 min,吸取上层无色液相至另一管中,加入0. 5 mL异丙醇,室温下放置15 min,4 ℃15 000 ×g离心15min,可见RNA沉淀在管底部或侧壁。弃上清液,加75%乙醇1mL振荡器混匀,4 ℃ 6 000 ×g离心5 min,弃上清液,静置15 min后用无RNA酶水溶解混匀,分光光度计检测RNA浓度及A260/A280的数值,且A260/A280>1.8。
1.2.5 组织标本miR-187*表达的检测
采用qRT-PCR检测患者癌组织及正常黏膜组织中miRNA-187*的表达,按照All-in-One™miRNA qRT-PCR检测试剂盒说明书操作。取2 μg总RNA反转录成cDNA,再以稀释5倍cDNA为模板,qPCR扩增miR-187*及U6的基因片段。反转录选用25 μL反应体系:总RNA模板2 μg,2.5 U/ μL Poly A 多聚酶1 μL,逆转录酶混合物1 μL,5×反应缓冲液1 μL,补无DNA酶无RNA酶水至25 μL。反应条件:37 ℃ 60 min,85 ℃ 5 min。qRT-PCR选用20 μL反应体系:2×All-in-One qPCR Mix 10 μL,All-in-One miRNA qPCR引物(2 μmol/L) 2 μL,通用衔接头 PCR 引物(2 μmol/L) 2 μL,第一链cDNA (稀释1∶5) 2 μL,50×ROX参考染料0.4 μL,补无RNA酶的水至20 μL。反应条件:95 ℃预变性10 min,然后按95 ℃×10 s,60 ℃×30 s,72 ℃× 10 s,进行45个循环。其中细胞实验重复3次。
1.3 统计学处理
应用SPSS 13.0软件对数据进行统计分析,数据以中位数(四分位数间距)或表示,两组间配对样本采用Wilcoxon检验或t检验,两组间独立样本采用Mann-Whitney检验,重复测量数据采用双因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 miR-187*在癌组织和正常黏膜组织中的表达
miR-187*在40例患者癌组织中的表达量为0.165(0.106,0.428),正常黏膜组织中的表达量为0.334(0.211,0.712),差异有统计学意义(P=0.041,图1)。
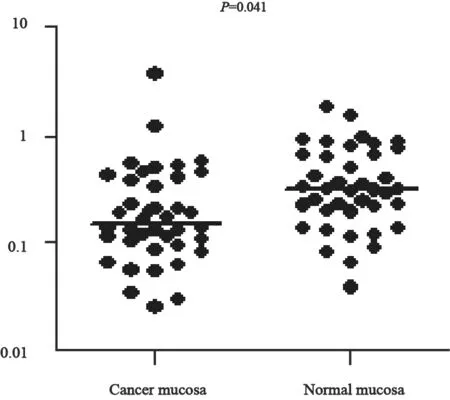
图 1 miR-187*在癌组织及正常黏膜的表达量Fig. 1 Expression of miR-187* in normal mucosa and cancer mucosa
2.2 miR-187*相对表达量与临床病理的关系
miR-187*在黏液性腺癌中的表达量为0.110(0.070,0.390),明显低于非黏液癌[0.840(0.355,1.628)],差异有统计学意义(P=0.001);低龄患者(<69岁)的表达量为1.270(0.435,1.955),高龄患者(≥69岁)为0.390(0.150, 1.070),差异有统计学意义(P=0.016)。miR-187*表达与分化程度、分期、浸润深度、淋巴结转移、远处转移、性别无明显关系,各指标组间差异无统计学意义(P>0.05,表1)。
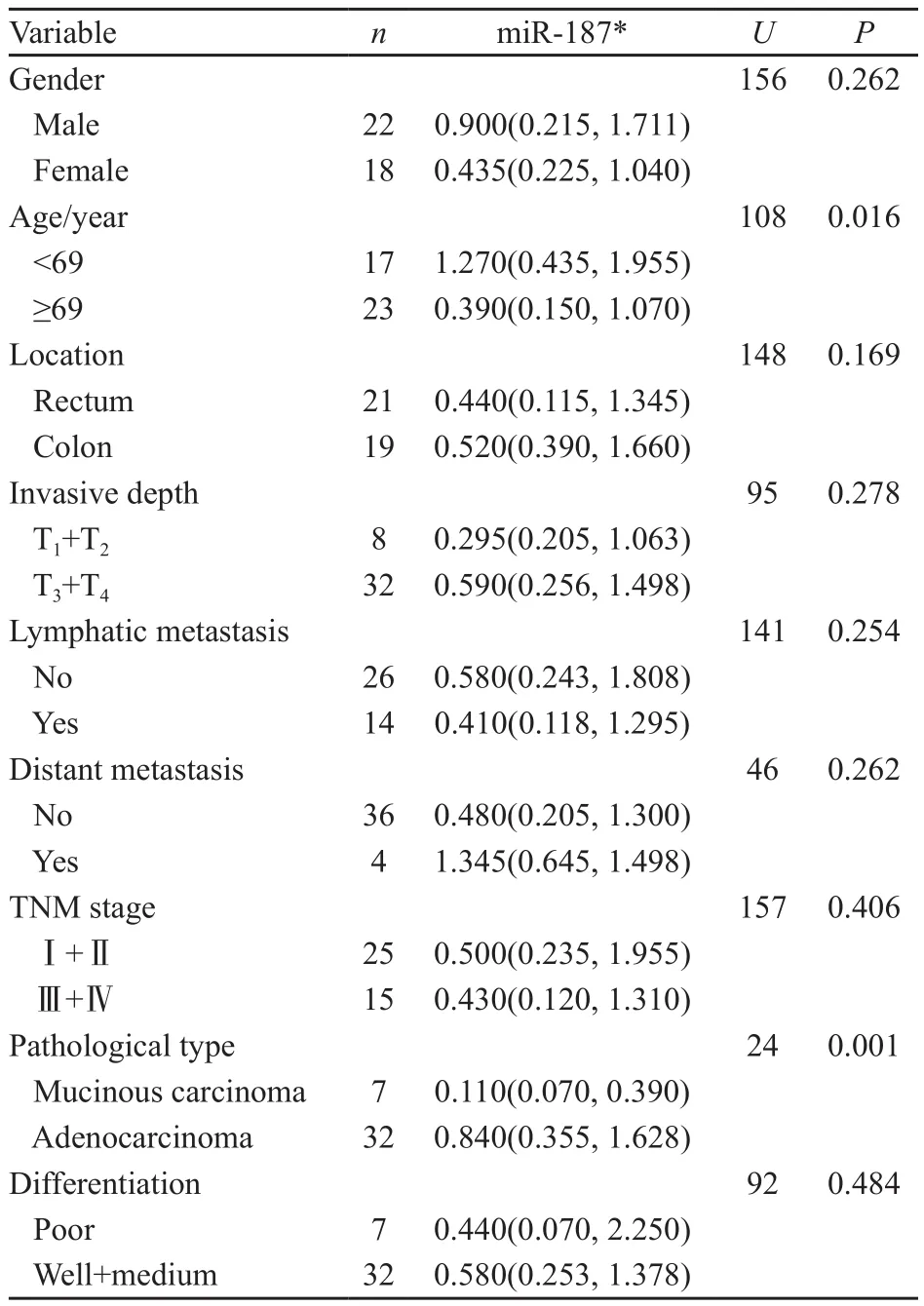
表 1 miR-187*的相对表达量与结直肠癌临床病理特征的关系Tab. 1 The correlation of miR-187* expression in CRC with clinical significance
2.3 上调miR-187*表达量对结肠癌细胞凋亡的影响
转染mimics进入HCT116细胞中,与对照组相比,实验组miR-187*表达量上调(图2)。实验组早期凋亡率为(26.748±1.098)%,高于对照组[(23.010±1.279)%],差异有统计学意义(P=0.024);实验组晚期凋亡率为(4.393±0.715)%,与对照组[(3.940±0.710)%]相比,差异无统计学意义(P>0.05,图3)。

图2 转染后miR-187*表达量Fig.2 Expression of miR-187* in the transfected cells

图3 miR-187*对HCT116细胞凋亡影响Fig.3 The effect of miR-187* on cell apoptosis of HCT116 cells
3 讨 论
miRNA主要通过与靶标基因3’非翻译区域(3’UTR)的完全或不完全配对,降解靶标基因mRNA或抑制其翻译,miRNA还可以直接作用于mRNA加快脱腺苷化,导致mRNA降解加速,从而参与调控个体发育,细胞凋亡、增殖、分化、代谢和应激等生命活动[6]。近几年研究表明,miRNA可能通过类似癌基因、抑癌基因或其他方式调控肿瘤的发生、发展和转归过程,表现出与癌基因或抑癌基因相似的生物学作用[7];并且能与信号通路或原癌基因相互作用,对环境信号作出反应,从而对细胞增殖、凋亡、周期产生影响[8]。
miR-187*是miR-187家族的一员,位于18号染色体上[9]。Ho等[10]对45例毛细胞型星形细胞瘤标本研究发现,miR-187*在癌组织中的表达水平低于正常组织表达水平的2~2.5倍。Ma等[11]在研究结直肠癌表达谱时也发现,miR-187*在结直肠癌中低表达。Liu等[12]应用基因芯片技术对miRNAs在胃癌组织中筛查,并通过RT-PCR验证发现miR-187*异常表达。随后对miR-187*在10位健康人、10例胃癌患者、10例结直肠癌患者血清中表达水平进行检测,发现其在胃癌患者血清中表达水平最高、结直肠癌次之、健康人最低,胃癌患者血清表达水平与健康人血清表达水平差异有统计学意义,提示miR-187*可能成为胃癌早期诊断的指标。
本实验首先通过qRT-PCR方法检测miR-187*在结直肠癌组织及正常黏膜组织中的表达,结果miR-187*在结直肠癌组织中低表达,与Ma等[11]的研究结果一致。
黏液癌是组织学分型中的一重要亚型。我国学者通过对2 079例结直肠癌患者的临床资料及预后生存期进行回顾性研究,发现黏液癌患者预后差[13]。本实验通过分析临床病理资料发现,miR-187*的相对表达量在黏液癌中低表达更明显,提示miR-187*对判断结直肠癌的恶性程度及预后有一定意义。Bouassida等[14]研究发现,在结直肠癌年轻患者中组织学类型恶性度高、易侵犯血管发生转移,但1年生存率无明显变化。本研究结果发现,miR-187*的表达下调与组织学类型及发病年龄均相关。国内年龄<39岁恶性肿瘤发病率处于较低水平,>40岁快速升高,80岁达到高峰[2]。Chang等[15]通过对1988—2007年124 314例在中国台湾癌症登记的结直肠癌患者进行流行病学统计分析时发现,高年龄组的比例增加。本研究分析发现,miR-187*在高龄患者中的表达量较低,提示时序性的miR-187*表达下调,可能与随年龄增长结直肠癌发病率逐步增高相关。
大量研究结果表明,miRNA参与调控细胞生物学行为。Tsang等[16]发现,由H19派生的miR-675在结直肠癌中高表达,可通过下调其靶基因RB促进肿瘤细胞增殖及细胞集落的形成,发挥癌基因的作用。miR-218在结直肠癌组织及细胞中低表达,通过下调BMI-1抑制结直肠癌细胞株HCT116及HT29的细胞增殖,延长细胞G2期,促进细胞凋亡[17]。miR-133b可通过MET信号转导通路抑制SW620及HT29的增殖,促进凋亡发挥其抑癌作用[18]。本研究发现HCT116细胞中,实验组miR-187*表达量高于对照组,提示上调miR-187*表达量可提高HCT116细胞早期凋亡率,发挥抑癌作用。
综上所述,miR-187*可通过促进凋亡发挥抑癌作用,但具体信号通路有待进一步研究。miR-187*有望作为一个新的潜在生物学标志物用于判断结直肠癌恶性程度及预后。
[1] JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2] 陈万青, 张思维, 郑荣寿, 等. 中国2009年恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2013, 22(1): 2-12.
[3] 张升, 蔡国响, 蔡三军. microRNA基因启动子甲基化的检测及其在结直肠癌临床应用中的研究进展[J]. 中国癌症杂志, 2012, 22(11): 869-872.
[4] WEBER M, BAKER M B, PATEL R S, et al. MicroRNA Expression Profile in CAD Patients and the Impact of ACEI/ ARB[J]. Cardiol Res Pract, 2011, 2011: 532915.
[5] PATUZZO C, PASQUALI A, TRABETTI E, et al. A preliminary microRNA analysis of non syndromic thoracic aortic aneurysms [J]. Balkan J Med Genetics, 2012: 51-55.
[6] WU L, FAN J, BELASCO J G. MicroRNAs direct rapid deadenylation of mRNA [J]. Proc Natl Acad Sci U S A, 2006, 103(11): 4034-4039.
[7] BARTEL D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297.
[8] LIU W, MAO S Y, ZHU W Y. Impact of tiny miRNAs on cancers[J]. World J Gastroenterol, 2007, 13(4): 497-502.
[9] FERRACIN M, PEDRIALI M, VERONESE A, et al. MicroRNA profiling for the identification of cancers with unknown primary tissue-of- origin[J]. J Pathol, 2011, 225(1): 43-53.
[10] HO C Y, BAR E, GIANNINI C, et al. MicroRNA profiling in pediatric pilocytic astrocytoma reveals biologically relevant targets, including PBX3, NFIB, and METAP2 [J]. NeuroOncol, 2013, 15(1): 69-82.
[11] MA Y, ZHANG P, WANG F, et al. miR-150 as a potential biomarker associated with prognosis and therapeutic outcome in colorectal cancer[J]. Gut, 2012, 61(10): 1447-1453.
[12] LIU H, ZHU L, LIU B, et al. Genome-wide microRNA profiles identify miR-378 as a serum biomarker for early detection of gastric cancer[J]. Cancer Lett, 2012, 316(2): 196-203.
[13] SONG W, WU S J, HE Y L, et al. Clinicopathologic features and survival of patients with colorectal mucinous, signetring cell or non-mucinous adenocarcinoma: experience at an institution in southern China[J]. Chin Med J (Engl), 2009, 122(13): 1486-1491.
[14] BOUASSIDA M, FEIDI B, MROUA B, et al. Histopathologic characteristics and short-term outcomes of colorectal cancer in young Tunisian patients: one center's experience[J]. Pan Afr Med J, 2012, 12: 10.
[15] CHANG H C, HORNG J T, LIN W C, et al. Evaluation of the appropriate age range of colorectal cancer screening based on the changing epidemiology in the past 20 years in Taiwan[J]. ISRN Gastroenterol, 2012; 2012: 960867[Epub 2012 Aug 30].
[16] TSANG W P, NG E K, NG S S, et al. Oncofetal H19-derived miR-675 regulates tumor suppressor RB in human colorectal cancer[J]. Carcinogenesis, 2010, 31(3): 350-358.
[17] HE X, DONG Y, WU C W, et al. MicroRNA-218 inhibits cell cycle progression and promotes apoptosis in colon cancer by downregulating BMI1 Polycomb Ring Finger oncogene[J]. Mol Med, 2013, 18: 1491-1498.
[18] HU G, CHEN D, LI X, et al. miR-133b regulates the MET proto-oncogene and inhibits the growth of colorectal cancer cells in vitro and in vivo[J]. Cancer Biol Ther, 2010, 10(2): 190-197.
《中国癌症杂志》2013年征订启事
《中国癌症杂志》是由国家教育部主管、复旦大学附属肿瘤医院主办的全国性肿瘤学术期刊,读者对象为从事肿瘤基础、临床防治研究的中高级工作者。主要报道内容:国内外研究前沿的快速报道、专家述评、肿瘤临床研究、基础研究、文献综述、学术讨论、临床病理讨论、病例报道、讲座和简讯等。《中国癌症杂志》已入选中文核心期刊、中国科技核心期刊及全国肿瘤类核心期刊,并为中国科技论文统计源期刊,先后被“中国期刊网”、“万方数据——数字化期刊群”和“解放军医学图书馆数据库(CMCC)”等收录。
《中国癌症杂志》为月刊,大16开,80页铜版纸(随文彩图),每月30日出版,单价8元,全年96元。国际标准刊号1007-3639,国内统一标准刊号CN31-1727/R,邮发代号4-575。
读者可在当地邮局订阅,漏订者可直接向本刊编辑部订阅。
也欢迎广大作者来稿。
主 编:沈镇宙
主 任:秦 娟
联系地址:上海市东安路270号复旦大学附属肿瘤医院内《中国癌症杂志》编辑部
邮 编:200032
电 话:021-64188274;021-64175590×3574
网 址:www.china-oncology.com
电子邮件:zgaz@163.com
Down-regulation of microRNA-187* expression in colorectal cancer and its roles in promoting cell apoptosis
LIU Bo, TIAN Yan-feng, ZHAO Zeng-ren, FAN Zhi-bin, ZHANG Li-jing, HE Xin-qi, GAO Li-fei (Department of General Surgery, First Hospital of Hebei Medical University, Shijiazhuang Hebei 050031, China)
ZHAO Zeng-ren E-mail: zzr-doctor@163.com
Background and purpose: MicroRNAs (miRNAs) play an important role in tumor biological behavior. miRNAs are down-regulated or up-regulated in various cancer types, triggering abnormal cell differentiation, proliferation and apoptosis. This study was designed to investigate the expression and clinical significance of miR-187* in colorectal cancer (CRC), and further to investigate its roles in promoting cell apoptosis. Methods: The expressions of miR-187* in 40 CRC cases were examined by real-time quantitative reverse transcription-PCR (qRT-PCR). The relationship between miR-187* expression and clinical features of CRC was analyzed. HCT116 cells were transfected with a miR-187* mimic and the apoptosis of the transfected cells were examined by flow cytometry (FCM). Results: The expression of miR-187* was down-regulated in CRC tissues 0.165 (0.106, 0.428) compared with those in normal tissues 0.334 (0.211, 0.712) (P<0.05), especially in mucinous carcinoma and older age CRC (P<0.05). Transfection of HCT116 cells with a miR-187* mimic up-regulated the expression of miR-187* and increased cell early apoptosis (P<0.05). Conclusion: The expression level of miR-187* was lower in CRC. miR-187* expression correlates with histological type and age. Transfection of HCT116 cells with a miR-187* mimic accelerates apoptosis of tumor cells, suggesting that miR-187* is a potent tumor suppressor.
Colorectal cancer; microRNA; microRNA-187*; Apoptosis
10.3969/j.issn.1007-3969.2013.09.002
R735.3
:A
:1007-3639(2013)09-0703-06
2013-05-20
2013-08-09)
国家自然科学基金资助项目(No: 81072034);河北省自然科学基金资助项目(No: C2011206103);河北省科技计划项目(No: 12396105D)。
赵增仁 E-mail:zzr-doctor@163.com
