再次宫颈锥切术在处理残留或复发宫颈上皮内瘤变中的应用
2013-06-09向礼兵蔡祎品徐晓丽杨文涛吴小华王华英李子庭杨慧娟
向礼兵蔡祎品徐晓丽杨文涛吴小华王华英李子庭杨慧娟
1.复旦大学附属肿瘤医院妇瘤科,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032
再次宫颈锥切术在处理残留或复发宫颈上皮内瘤变中的应用
向礼兵1蔡祎品1徐晓丽2杨文涛2吴小华1王华英1李子庭1杨慧娟1
1.复旦大学附属肿瘤医院妇瘤科,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:再次宫颈锥切可作为宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)初次锥切后治疗失败患者的主要治疗手段之一,但很少有临床研究证实其有效性和安全性。本研究旨在评估再次宫颈锥切术在处理初次锥切术后切缘阳性患者或随访再次发现宫颈病变患者中的诊治价值。方法:2003年9月—2010年7月在复旦大学附属肿瘤医院妇瘤科因高级别CIN接受2次宫颈锥切术的患者共65例,包括50例首次手术切缘阳性患者和15例随访中再次发现宫颈病变患者。分析65例患者再次锥切标本的组织病理及切缘情况,随访观察再次术后并发症、术后妊娠以及病变复发情况。结果:50例首次手术切缘阳性的患者经再次锥切后,2例(4.0%)被证实为浸润性宫颈癌(腺癌ⅠB1期和鳞癌ⅠA1期各1例),23例(46.0%)标本中存在残留的CIN病变。15例随访中再次发现宫颈病变的患者,11例(73.3%)被证实存在CIN病变。再次锥切后58例患者切缘阴性(89.2%),7例(10.8%)患者切缘阳性(包括1例宫颈腺癌和6例CIN)。5例患者因发现宫颈浸润癌或2次锥切切缘阳性或术后并发症而补充行子宫切除术。另有2例发生严重并发症(1例术中大出血,1例术后宫颈创面大出血)的患者经保守处理后好转。在保留子宫的60例患者中,中位随访时间为41个月(25~87个月),4例(6.7%)患者被发现有CIN病变复发。结论:再次锥切术可以切除残留或复发的宫颈病变组织而保留生育功能,并有可能发现首次手术未被发现的浸润性癌;严重的手术并发症很少见,但需要积极预防。
宫颈上皮内瘤变;再次锥切术;残留;复发
宫颈锥切术是高级别宫颈上皮内瘤变(cervical intraepithelial neoplasm,CIN)和微小浸润癌的标准诊治手段。研究发现12.7%~18.0%患者锥切标本的切缘被发现有病变累及,其中22.0%~28.9%的患者在随访中病变持续存在或复发或进展为浸润性宫颈癌[1-2]。而即使在病灶切净的患者中,仍有约3%的患者在随访中发现高级别宫颈病变的复发或进展为浸润性宫颈癌[3]。初次锥切后切缘阳性的患者和随访中发现复发的患者可行再次手术治疗。
再次手术治疗的方式根据患者年龄、对生育的要求、病变的程度和范围选择子宫切除、宫颈切除或再次宫颈锥切。子宫切除为根治性治疗方法,是目前治疗初次手术失败(切缘阳性)或复发患者的主要手段,但患者失去了生育能力。宫颈切除保留了子宫体,理论上保留了生育功能,但切除了宫颈间质,不利于妊娠[4]。再次宫颈锥切对患者生育功能影响最小,可作为年轻的有生育要求患者的首选,但是,再次锥切手术存在病灶再次残留或复发的风险。因此,临床医师急切地需要了解该治疗方式的有效性和安全性。
然而,可供参考的有关再次锥切术治疗残留或复发性宫颈上皮内瘤变的研究资料极其匮乏。本研究旨在总结分析再次锥切手术的临床病理结果和对妊娠生育的影响,阐明其在保守处理年轻CIN病变患者中的诊治价值。
1 资料和方法
1.1 研究对象
2003年9月—2010年7月在复旦大学附属肿瘤医院妇瘤科因高级别CIN接受宫颈锥切术的患者共1 359例。本研究主要纳入其中65例接受再次宫颈锥切术的患者,包括50例初次术后切缘阳性的患者和15例随访中再次发现宫颈病变的患者。患者均由阴道镜下活检病理证实。
1.2 再次宫颈锥切术的手术方法
上述患者均在静脉麻醉下行普通电刀宫颈锥切术,具体器械和方法见参考文献[5]。外切缘残留患者的补充切除视残留宫颈的大小,切除的边界平均在初次锥切切缘外1.0 cm(0.5~2.0 cm) 。部分患者因初次切除范围较广,再次手术时外界接近阴道穹窿,这些患者切除标本的厚度平均为1 cm(0.5~2.0 cm),即切除扁而宽的宫颈组织,尽量多保留正常的宫颈间质。内切缘或颈管搔刮阳性的患者再次锥切手术的范围窄而深,以切除位于颈管内的病变组织,同时仍可充分保留间质。宫颈在首次手术后一般需6~12个月完成修复,随访中再次发现的宫颈病变(持续存在和复发)切除范围视宫颈修复的状态、宫颈病变的范围和部位而定,原则上同初次锥切术[5]。部分患者同时行颈管搔刮术。
1.3 病理诊断
宫颈锥切标本的组织学诊断、切缘病变累及的判断经2位病理科医师证实,如两位医师有相反结论,则由第3位病理医师进一步判断。病变残留是指标本的外切缘、内切缘和(或)宫颈搔刮见CIN病变累及。
1.4 随访及临床观察指标
所有患者在术后的第1年内每3个月随访1次,第2~3年每6个月随访1次,以后每年随访1次。随访内容包括常规妇科检查及宫颈液基细胞学检查,部分患者接受高危型人类乳头状瘤病毒(human papilloma virus,HPV)DNA的检测。必要时行阴道镜检查及宫颈活检。近期观察指标包括术中出血量、术后3个月内有无阴道流血、阴道排液及发热、月经是否恢复正常等。远期观察指标包括月经是否通畅、有无颈管粘连、有无盆腔感染及妊娠生育情况。所有患者随访至2012年7月,中位随访时间为41个月(25~87个月)。
2 结 果
2.1 一般情况
65例患者中位年龄为35岁(25~56岁),其中35岁以下患者为40例(61.5%),未绝经者64例(98.5%),未生育者9例(13.8%),育有一胎者43例(66.2%)。
2.2 初次宫颈锥切术情况
65例患者初次锥切术后病理均提示为高级别CIN病变(其中1例为腺上皮重度不典型增生)。50例(76.9%)切缘阳性的患者中,初次锥切方式包括:宫颈环形电切术(loop electrosurgical excision procedure,LEEP),普通电刀锥切,冷刀锥切。15例(23.1%)患者为锥切后随访中发现宫颈病变。
2.3 再次宫颈锥切术情况
所有患者行再次宫颈锥切术时采用普通电刀的宫颈锥切术。初次手术后病变有残留的50例患者行再次锥切术的中位时间为初次锥切术后1个月(0.3~4.0个月)。其余15例在随访中再次发现宫颈病变的患者经病理证实后即行再次宫颈锥切手术,中位间隔时间为初次手术后8个月(2~48个月)。表1列出了两类患者再次术后的病理。再次锥切后58例患者切缘阴性(89.2%),7例(10.8%)患者切缘阳性,包括1例宫颈腺癌和6例CIN。在6例CIN患者中,外切缘阳性3例,内切缘伴颈管搔刮阳性3例。
65例患者中位术中出血量5 mL(5~200 mL),其中1例患者术中因动脉出血,电凝止血失败,经宫颈缝扎后止血,失血量为200 mL。另1例患者术后第4天发生宫颈创面大出血,总量达1 200 mL,入院后经阴道填塞应用止血药物及抗感染治疗后好转。其他患者在宫颈创面愈合前均有少量阴道出血或阴道排液。
2.4 术后补充手术及随访
再次锥切术后,宫颈腺癌ⅠB1期患者切缘阳性补充行根治性子宫切除术及双侧盆腔淋巴结清扫术。宫颈鳞癌ⅠA1患者切缘无病变累及,继续随访。再次锥切标本切缘阳性的6例CIN患者中,3例患者接受了子宫切除术。另有1例患者因严重的颈管粘连致宫颈管阻塞而闭经,保守处理无效后行子宫切除术。故65例患者经再次锥切术后,保留子宫的患者共60例,密切随访。在随访中位时间41个月内,56例(93.3%)患者未发现复发,有4例(6.7%)患者在随访中发现病变复发,时间分别为再次术后4、8、9和63个月。4例复发患者均接受了第3次手术即子宫切除术,子宫切除手术的病理结果为CIN1级2例,CIN2/3级1例,宫颈腺上皮不典型增生1例。再次宫颈锥切术后有7例患者有妊娠:5例足月妊娠,2例在早孕期人工流产终止妊娠,未见自然流产和早产发生。随访中,1例(3.1%)患者因术后宫颈感染致严重的宫颈管粘连、阻塞致月经不畅、经血逆流,出现发热及腹痛,最终在再次锥切术后8个月行子宫切除术。其他患者均未发生过严重的需要住院处理远期并发症。
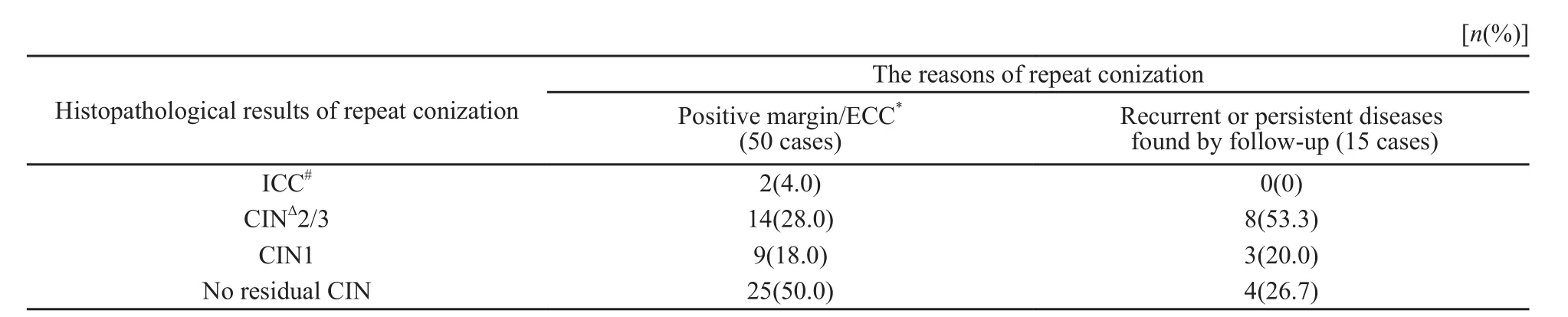
表 1 65例行再次锥切术患者的术后病理Tab.1 Histopathological results of 65 women after repeat conization
3 讨 论
美国阴道镜与宫颈病理协会(American Society for Colposcopy and Cervical Pathology,ASCCP)指南及美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南均指出:初次锥切后切缘阳性患者可选择的治疗方式包括密切随访、再次行宫颈病变诊断性切除或全子宫切除;锥切后复发患者可选择宫颈病变诊断性切除或全子宫切除[6]。满足以下条件的患者方可行再次锥切术:宫颈初次锥切后切缘阳性或术后复发的患者,患者年龄较轻,有保留子宫的意愿和(或)生育的要求,能够对宫颈上皮内瘤变有一定认识,能按要求完成定期随访。对于绝经后妇女,年龄较大,无生育要求,希望切除子宫患者,宜行子宫切除,因为CIN患者保留子宫的手术后,即使严密随访,其发生宫颈浸润癌的风险仍是正常人群的5倍[7]。无随访条件或不愿定期随访的患者、对上皮内瘤变过度忧虑的患者以及残留宫颈组织过少、实施再次锥切困难的患者也宜切除子宫。本研究的65例再次锥切患者中,≤35岁的患者有40例(61.5%),仅1例绝经后患者(系患者强烈要求保留子宫)。未生育或仅生育1胎患者有52例(80%),这些患者有生育要求或潜在的再生育要求。
宫颈LEEP术后或锥切术后切缘或颈管搔刮阳性患者的处理是较棘手的情况。首先,一部分切缘阳性患者再次手术后无残留病变发现,Chen等[8]发现锥切后切缘阳性患者中再次手术后宫颈病变残留率为43.9%;本研究中50例切缘阳性或颈管搔刮阳性的患者中,再次锥切后有CIN2+病变残留的患者16例(32%)。其次,切缘以外的残留病变中可能存在宫颈浸润癌,尤其是位于颈管内的腺癌或内生型的鳞癌,Ayhan等[9]对56例LEEP术后切缘阳性患者行再次LEEP术时发现6例(10.7%)有宫颈早期浸润癌。本研究中亦通过再次锥切发现2例(4%)浸润性宫颈癌患者。这提示对少数患者而言,诊断切缘阳性后仅作随访是不够的,间隔为3~6个月的随访中浸润癌可能生长,导致增高肿瘤期别,错失最佳治疗时间,或添加了不良预后因素。尽管Koiss等[10]的研究表明通过随访术后高危型HPV感染状况可让部分切缘阳性的患者避免再次锥切手术,但宫颈锥切后的短时间内无相关临床病理指标可以分辨出患者有无残留浸润癌。因此,从尽早发现残留浸润癌的角度考虑,在锥切后切缘阳性患者中补充切除手术是必要的、合理的。由于再次锥切既能明确有无病变残留,又可去除大多数患者的残留病变,并保留子宫,可作为切缘阳性患者首选治疗方案。
同初次锥切类似,再次锥切后仍然存在切缘阳性、病灶的残留或病变的复发。本研究中除1例宫颈腺癌ⅠB1期患者外,另有6例CIN患者再次锥切的切缘阳性。在最终保留子宫的60例患者中,4例(6.7%)切缘阴性的患者在随访期内被再次发现CIN病灶,1例在术后4个月,3例在术后6个月发现,该4例患者均被看作是治疗失败。这提示了按计划随访是保守治疗宫颈癌前期病变的重要部分,不可忽视。
再次锥切术的不良事件主要包括术中出血、早期术后出血、晚期术后出血、术后感染和颈管粘连等。本研究中3例(4.6%)患者发生严重并发症,其中1例因术后严重的远期并发症而行子宫切除术,2例分别在术中和术后的1周内发生创面大出血,经局部压迫或缝扎止血后血止。因此再次锥切术中要对创面彻底止血,如果电凝止血失败,可考虑缝扎止血,亦可在锥切术前将两侧的子宫动脉下行支缝扎后再行电切术,可以减少术中和术后的创面出血。对于因切缘阳性而行再次锥切术的患者,由于在短期内进行2次宫颈手术,发生宫颈感染的危险性增高,因此对这些患者的健康卫生指导尤其重要,如有腹痛、月经不畅等症状发生应该尽早就医。本研究中有1例患者因为严重的宫颈管粘连致阻塞而闭经,最终行子宫切除。另外,锥切后引起宫颈组织减少,会造成不良妊娠结局,如早产、胎膜早破等增加[11]。本研究因病例数有限,仅7例患者术后有妊娠,未观察到早产和胎膜早破发生,有关再次锥切术对妊娠生育的影响有待进一步研究。
总之,在初次锥切术后有病灶残留或病变复发的年轻患者中,再次锥切术可以切除残留或复发的宫颈病变组织而保留生育功能,并有可能发现首次手术未被发现的浸润性癌;严重的手术并发症很少见,但需要积极预防。
[1] REICH O, LAHOUSEN M, PICKEL H, et al. Cervical intraepithelial neoplasia Ⅲ: long-term follow-up after coldknife conization with involved margins[J]. Obstet Gynecol, 2002, 99(2): 193-196.
[2] MILOJKOVIC M. Residual and recurrent lesions after conization for cervical intraepithelial neoplasia grade 3[J]. Int J Gynaecol Obstet, 2002, 76(1): 49-53.
[3] GHAEM-MAGHAMI S, SAGI S, MAJEED G, et al. Incomplete excision of cervical intraepithelial neoplasia and risk of treatment failure: a meta-analysis[J]. Lancet Oncol, 2007, 8(11): 985-993.
[4] JENG C J, SHEN J, HUANG S H. Partial trachelectomy: a new treatment choice for persistent or recurrent high grade cervical intraepithelial neoplasia[J]. Gynecol Oncol, 2006, 100(2): 231-232.
[5] 杨慧娟, 张玉勤, 唐美琴, 等. 应用普通电刀的宫颈锥切术诊治宫颈上皮内瘤变和微小浸润癌的临床观察[J]. 中国癌症杂志, 2006, 16(11): 922-925.
[6] WRIGHT T J, MASSAD L S, DUNTON C J, et al. 2006 consensus guidelines for the management of women with cervical intraepithelial neoplasia or adenocarcinoma in situ[J]. Am J Obstet Gynecol, 2007, 197(4): 340-345.
[7] SOUTTER W P, DE B L A, FLETCHER A, et al. Invasive cervical cancer after conservative therapy for cervical intraepithelial neoplasia[J]. Lancet, 1997, 349(9057): 978-980.
[8] CHEN Y, LU H, WAN X, et al. Factors associated with positive margins in patients with cervical intraepithelial neoplasia grade 3 and postconization management[J]. Int J Gynaecol Obstet, 2009, 107(2): 107-110.
[9] AYHAN A, BOYNUKALIN F K, GUVEN S, et al. Repeat LEEP conization in patients with cervical intraepithelial neoplasia grade 3 and positive ectocervical margins[J]. Int J Gynaecol Obstet, 2009, 105(1): 14-17.
[10] KOISS R, BABARCZI E, JENEI C, et al. Repeat conisation or HPV test? What should be done if histology of the primary conisation requires a second conisation? [J]. Eur J Gynaecol Oncol, 2012, 33(2): 134-137.
[11] SHANBHAG S, CLARK H, TIMMARAJU V, et al. Pregnancy outcome after treatment for cervical intraepithelial neoplasia[J]. Obstet Gynecol, 2009, 114(4): 727-735.
Repeat conization in patients with residual or recurrent cervical intraepithelial neoplasia
XIANG Libing1, CAI Yi-pin1, XU Xiao-li2, YANG Wen-tao2, WU Xiao-hua1, WANG Hua-ying1, LI Zi-ting1, YANG Hui-juan1(1.Department of Gynecologic Oncology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2.Department of Pathology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
YANG Hui-juan E-mail: huijuanyang@hotmail.com
Background and purpose: Repeat conization is a conservative surgical choice for the treatment failure after primary conization in patients with cervical intraepithelial neoplasia (CIN), however, there were limited evidences to show its efficacy and safety. The aim of the present study was to evaluate the treatment and diagnostic value of repeat conization in the management of residual or recurrent CIN. Methods: From 2003 to 2010, 65 CIN patients underwent repeat conization for positive margin, persistent or recurrent disease after primary conization in Fudan University Shanghai Cancer Center. The medical records and pathological slides were reviewed on histopathological outcomes, margin involvement, complications during and after repeat conization, and reappearance of CIN lesions during follow-up, as well as obstetric outcomes. Results: Among the 50 patients for the treatment of positive margin after primary conization, invasive carcinoma was confirmed in 2(4.0%) patients (1 adenocarcinoma and 1 microinvasive squamous carcinoma), and residual CIN lesions were present in 23 patients (46.0%). In the rest 15 cases for the treatment of persistent or recurrent disease after primary conization, 11(73.3%) patients had CIN lesionsin the cone specimens, none had invasive carcinoma. After the secondary conization, 58 patients had clear margins. Involvement of the ectocervical or endocervical margins was found in 1 adenocarcinoma case and 6 CIN cases. Additional hysterectomy was carried out in the adenocarcinoma case, 3 cases with positive margin and 1 case with cervical occlusion and amenorrhea because of cervical adhesion. Massive hemorrhage was another severe complication and occurred in 2 cases. In the 60 cases who preserved their uteruses after secondary conization, reappearance of CIN disease was documented in 4 (6.7%) cases during the median follow-up of 41 months (25-87). Conclusion: Repeat conization appears to be a rational treatment choice for young patients with residual, persistent, recurrent CIN. Invasive carcinoma could be revealed in the repeat conization. Severe complication was uncommon, but needs active management.
Cervical intraepithelial neoplasia; Repeat conization; Residual disease; Recurrence
10.3969/j.issn.1007-3969.2013.05.009
R737.33
:A
:1007-3639(2013)05-0370-05
2013-02-04
2013-04-02)
上海市卫生局科研课题(No:2007140)。
杨慧娟 E-mail:huijuanyang@hotmail.com
