RNAi沉默HIF-1α基因调控乏氧肺腺癌A549细胞放射敏感性和自噬能力
2013-06-09
华中科技大学同济医学院附属同济医院肿瘤中心,湖北 武汉 430030
RNAi沉默HIF-1α基因调控乏氧肺腺癌A549细胞放射敏感性和自噬能力
邹燕梅 熊华 肖志平 于世英 袁响林
华中科技大学同济医学院附属同济医院肿瘤中心,湖北 武汉 430030
背景与目的:乏氧导致肿瘤细胞放射敏感性下降是引起肿瘤放疗抵抗、复发转移的根源。HIF-1α基因在乏氧调控中起关键作用,但HIF-1α基因在乏氧肺腺癌放射敏感性中的作用及其与自噬的关系尚未阐明。本研究建立利用RNAi沉默HIF-1α基因的乏氧肺腺癌A549细胞模型,以此探讨HIF-1α对乏氧细胞放射敏感性和自噬的影响。方法:构建靶向抑制HIF-1α的shRNA表达质粒,转染乏氧A549细胞,筛选稳定表达的克隆细胞,将其命名为A549/HIF-1α-shRNA,同时设阴性对照A549/Neg-shRNA。克隆形成实验检测细胞D0、SF2、SER等值。Western-blot检测细胞照射前后HIF-1α、LC3、c-parp蛋白的表达。结果:乏氧A549细胞的SF2为0.62,高于常氧A549细胞,SER为1.45;乏氧A549细胞照射后LC3Ⅱ增加,c-parp下调。乏氧A549细胞HIF-1α表达增加;A549/HIF-1α-shRNA细胞HIF-1α表达降低;A549/HIF-1α-shRNA细胞的SF2为0.45,SER为0.72,低于A549/ Neg-shRNA细胞;A549/HIF-1α-shRNA 细胞照射后LC3Ⅱ降低,c-parp上调。结论:稳定转染及RNAi技术建立的HIF-1α表达抑制克隆可以成为简单实用的细胞模型;shRNA抑制HIF-1α的表达可提高乏氧A549细胞的放射敏感性,降低自噬活性。
乏氧;自噬;放射敏感性;HIF-1α;RNAi
由于肿瘤细胞增殖速度快,氧耗多,肿瘤内血管结构和功能异常,肿瘤细胞血供和氧供少,使大多数体积>l mm3的实体肿瘤都含有相当数量的乏氧肿瘤细胞[1-2]。临床上很多肺癌患者对放射治疗不敏感,其中很重要的原因就是乏氧[3-4]。乏氧诱导肿瘤细胞对放疗抵抗[5],HIF-1α在其中起着极为重要的调控作用,抑制HIF-1α的表达可提高放射治疗的敏感性[6]。近年研究发现放疗、乏氧等均可诱导自噬的产生,通过自噬对细胞内物质的降解和循环再利用,对放射线、低氧等应激做出适应性反应;或通过隔离线粒体避免促凋亡因子扩散到细胞质,帮助细胞逃逸凋亡[7-8]。前期研究发现,乏氧诱导自噬与放疗抵抗相关。目前关于HIF-1α的研究主要集中在乏氧和放射敏感性方面,而在自噬方面则较少,为深入研究乏氧、HIF-1α、放射敏感性与自噬的关系,拟建立一个HIF-1α表达受抑制的细胞模型。RNA干扰(RNA interference, RNAi) 是在小发夹RNA (small hairpin RNA, shRNA) 的介导下特异性降解相应序列mRNA 的现象[9]。本实验利用RNAi技术构建靶向抑制HIF-1α mRNA的shRNA表达载体,稳定转染乏氧人肺腺癌细胞株A549,获得HIF-1α表达抑制的乏氧细胞模型,并对该细胞的放射敏感性和自噬活性进行初步研究。
1 材料和方法
1.1 材料
1.1.1 细胞株
人肺腺癌细胞株A549购自中国典型培养物保藏中心(CCTCC),由华中科技大学同济医学院附属同济医院肿瘤科实验室提供并传代保存。
1.1.2 主要试剂
胎牛血清、LipofectamineTM2000转染试剂购自Gibco 公司;DMEM培养基购自Hyclone公司;胰蛋白消化酶、二甲基亚砜购自Sigma公司;BCA蛋白测定试剂盒、M-PERTM哺乳动物蛋白提取液购自Pierce公司;HIF-1α小鼠抗人单克隆抗体购自NeoMarkers公司;LC3、c-parp兔抗人单克隆抗体、小鼠抗人actin单克隆抗体、羊抗鼠辣根过氧化物酶标记二抗、ECL显色试剂盒购自Santa Cruz公司。LipofectamineTM2000脂质体购自Invitrogen公司;含有U6启动子的质粒pGenesil-1购自武汉晶赛公司;限制性内切酶HandⅢ、BamHⅠ购自Takara公司;G418购自Promega公司。
1.1.3 HIF-1α表达质粒
质粒载体pGenesil-1是转录靶向抑制HIF-1α mRNA的表达质粒,是pEGFP-C1质粒经Sal-I酶切插入人U6启动子改造而成。正反义链由武汉晶赛生工合成(序列号 04112202),与pGenesil-1经HandⅢ和BamHⅠ双酶切、T4DNA连接酶作用后形成重组质粒HIF-1αshRNA。该重组质粒在细胞内表达绿色荧光蛋白(green fluorescent protein, GFP)。正义链(下划线部分为靶向抑制HIF-1α序列,19nt):5'-GATCCGUTGTGAGTTCGCATTCTTGAUTT TCAAGACGATCAAGATGCGAACTCACATTT TTTGTCGACA-3’;反义链:5'-GCACACT CAAGCGTAAGAACTAAAGTTCTGCTAGTTCT ACGCTTGAGTAAAAAACAGCTGTTCGA-3'。阴性对照Neg-shRNA的靶序列为随机序列:5'-AAGCTTCATAAGGCGCATAGC-3',此序列不与任何人类基因序列同源。
1.2 方法
1.2.1 细胞培养
A549细胞置于含10%灭活胎牛血清的DMEM培养基中。常氧培养:37 ℃、CO2和O2体积分数为5%和20%的饱和湿度条件下培养。乏氧培养:将DY-2型培养箱中的培养罐用75%酒精消毒后,将培养瓶放入培养罐中密闭,然后缓慢抽成真空,充入O2体积分数为l%、CO2体积分数为5%和N2体积分数为94%的混合气体,约在1 h内平衡至O2体积分数为l%浓度。将乏氧起始时间定为0,分别收集乏氧12、24、48 h细胞。
1.2.2 细胞照射
将对数生长期的A549细胞接种于6孔板,以1×105个细胞/孔接种,常氧或乏氧培养,贴壁生长至70%~80%融合后进行照射。照射采用直线加速器Elekta 6 MV X线,单次吸收剂量4 Gy,剂量率300 cGy/min,源皮距100 cm。
1.2.3 细胞转染和稳定筛选HIF-1α表达质粒
乏氧培养A549细胞,用胰蛋白消化酶消化细胞,以3×105个细胞/孔接种于6 cm培养皿,加入胎牛血清和DMEM培养液4 mL温育细胞24 h,贴壁生长至70%~80%后,用LipofectamineTM2000 介导质粒转染,荧光镜下观察转染效率。转染后48 h以1×105个细胞/孔接种于6孔板,G418筛选阳性克隆。每2~3 d更换1次培养液,培养10~12 d后,将G418浓度改为400 μg/mL,继续乏氧培养至克隆肉眼可见后,荧光镜下观察标记含GFP的克隆,挑出克隆继续扩大培养。将转染了HIF-1α-shRNA/ pGenesil-1和pNeg-shRNA的乏氧A549细胞分别命名为A549/HIF-1α-shRNA和A549/NegshRNA。
1.2.4 克隆形成实验检测SF2等值
将A549、A549/HIF-1α-shRNA、A549/ Neg-shRNA细胞用胰蛋白消化酶消化成单细胞悬液,计数,稀释,接种,加入DMEM培养基4~5 mL,CO2体积分数为5%的培养箱,于37 ℃静置培养。细胞贴壁后分别给予0、2、4、6、8 Gy单次吸收剂量照射(直线加速器Elekta 6 MV X线,剂量率300 cGy/min,源皮距100 cm);照射后于37 ℃常氧或乏氧条件下培养12~14 d,移弃培养液,PBS漂洗,醋酸甲醇固定,结晶紫液染色,低倍显微镜下计数大于或等于50个细胞的克隆数;计算存活分数(SF)=照射后细胞形成的克隆数/(接种细胞数×细胞种植率);根据单击多靶模型SF=1-(1-exp(-D0/D))N拟合细胞存活曲线,计算D0、N、Dq及SF2;计算放射增益比(SER): 乏氧条件下D0与常氧条件下D0的比值。
1.2.5 蛋白质印迹法(Western blot)检测HIF-1α、LC3、c-parp蛋白的表达
PBS将各种细胞洗2遍,M-PERTM哺乳动物蛋白提取液提取蛋白,测定蛋白浓度。每孔加50 μg总蛋白,10%SDS聚丙烯酰胺凝胶电泳,用含50 g/L的脱脂奶粉的T-BST,37 ℃,封闭1~2 h;加入一抗,4 ℃,温育过夜;T-BST漂洗10 min,4次;辣根过氧化物酶标记二抗(羊抗兔1∶2 000),37 ℃,温育1 h;T-BST漂洗10 min,4次;ECL显色试剂盒曝光底片,曝光后底片上蛋白条带用Image pro-plus Kodak软件分析量化吸光度,以actin蛋白的含量作为参照,分别分析HIF-1α、LC3、c-parp蛋白的表达。
1.2.6 统计学处理
数据采用SPSS 13.0软件分析,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 乏氧A549 细胞放射敏感性的变化
线性二次方程拟合生存曲线显示常氧A549和乏氧A549细胞受照射后的生存率(图1)。克隆形成实验结果显示,乏氧A549细胞Dq、D0、N、SF2值分别为1.34、1.81、2.95、0.62,而常氧分别为0.61、1.25、2.04、0.43,SER值为1.45。
2.2 乏氧A549 细胞照射后凋亡和自噬的变化
Western blot结果显示,常氧下HIF-1a蛋白低表达,乏氧下高表达。未接受照射的常氧或乏氧A549细胞无c-parp蛋白的表达,接受照射后有c-parp蛋白的表达,但乏氧A549细胞c-parp蛋白的表达低于常氧A549细胞。常氧A549细胞LC3Ⅱ蛋白表达很低,乏氧A549细胞LC3Ⅱ蛋白表达增加,乏氧A549细胞接受照射后LC3Ⅱ蛋白表达进一步增加(图2)。
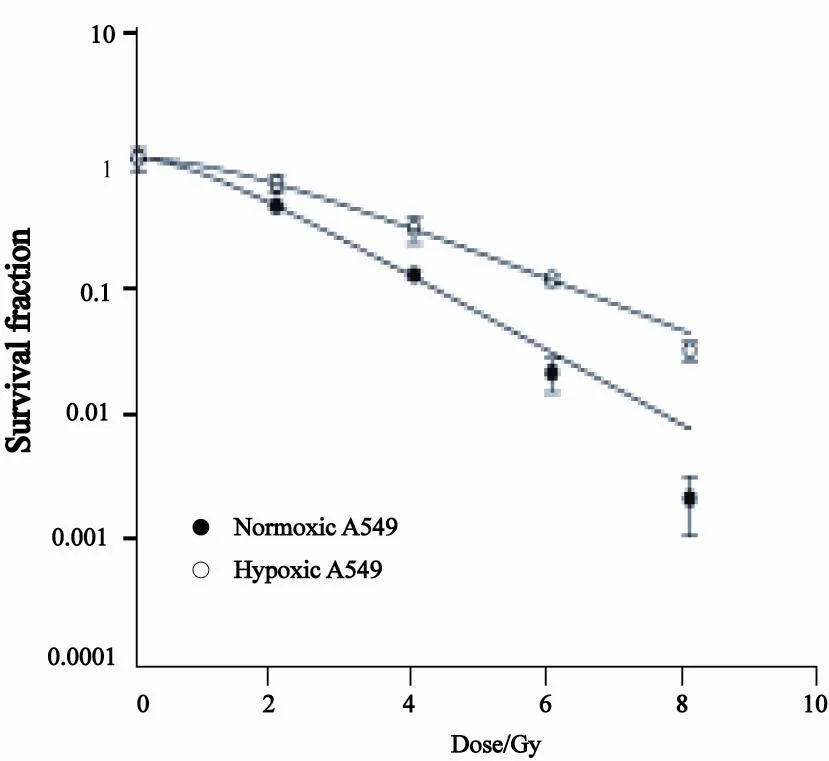
图 1 线性二次方程拟合生存曲线显示常氧(20%O2)A549和乏氧(1%O2)A549细胞的生存率Fig. 1 Survival fraction of normoxic and hypoxic A549 cells

图 2 常氧或乏氧A549细胞接受照射后HIF-1α、c-parp、LC3的表达Fig. 2 The expression of HIF-1α and c-parp and LC3 of normoxic and hypoxic A549 cells with radiation RT: Radiation.
2.3 乏氧A549细胞HIF-1α蛋白的表达
Western blot结果显示,在常氧下HIF-1α蛋白低表达,乏氧12、24、48 h时间点HIF-1α蛋白表达增加,差异均有统计学意义(P<0.05,图3)。
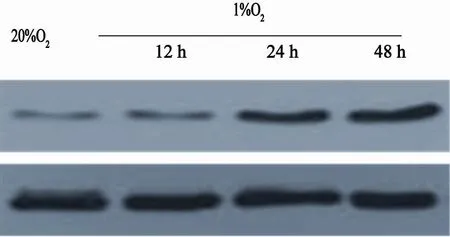
图 3 常氧或乏氧不同时间下A549细胞HIF-1α的表达Fig. 3 The expression of HIF-1α of normoxic and hypoxic A549 cells
2.4 转染HIF-1α-shRNA质粒的细胞筛选和鉴定
选取乏氧24 h A549细胞进行质粒转染,结果观察到了阳性克隆细胞上的绿色荧光蛋白的表达,即A549/HIF-1α-shRNA细胞(图4)。对A549/HIF-1α-shRNA细胞进行western blot检测,结果与A549/Neg-shRNA相比,A549/HIF-1α-shRNA细胞HIF-1α蛋白表达明显受抑制(图5)。
2.5 shRNA抑制乏氧A549细胞HIF-1α表达对放射敏感性的影响
拟合生存曲线显示,乏氧A549、A549/HIF-1a-shRNA、A549/Neg-shRNA细胞受照射后的生存率(图6)。A549/Neg-shRNA细胞的Dq、D0、N、SF2值分别为1.21、1.68、2.77、0.59,与A549细胞结果类似。A549/HIF-1α-shRNA的Dq、D0、N、SF2值分别为0.67、1.31、2.05、0.45,均低于阴性对照A549/Neg-shRNA细胞,SER为0.72。
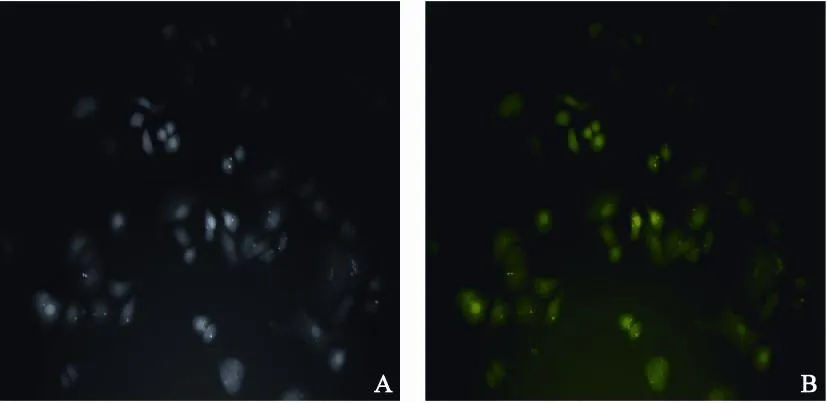
图 4 转染HIF-1α-shRNA质粒的A549细胞荧光表达Fig.4 Fluorescence expression of A549 cells transfected with HIF-1α-shRNA(×200)

图 5 A549/HIF-1α-shRNA细胞中HIF-1α蛋白的表达Fig. 5 The expression of HIF-1α of A549/HIF-1α-shRNA cells
2.6 抑制HIF-1α表达对乏氧A549细胞自噬和凋亡的影响
Western blot结果显示,与阴性对照A549/ Neg-shRNA细胞相比,乏氧条件下HIF-1α的表达被抑制后LC3Ⅱ蛋白的表达降低,c-parp蛋白的表达上调(图7)。

图 6 乏氧A549、A549/HIF-1α-shRNA、A549/Neg-shRNA细胞的生存率Fig. 6 Survival fraction of hypoxic A549 and A549/HIF-1α-
3 讨 论

图 7 抑制HIF-1α表达后乏氧A549细胞LC3、c-parp蛋白表达Fig. 7 The expression of LC3 and c-parp of hypoxic A549/HIF-1α-shRNA
乏氧是导致肿瘤对放射抵抗的因素之一[10-11]。本研究通过克隆形成实验、拟合生存曲线得出乏氧A549细胞照射后的生存率、SF2值明显高于常氧A549细胞,从多个角度、多个证据证实乏氧确实导致人肺腺癌A549细胞放射敏感性下降。进一步研究发现在这个过程中,乏氧调控蛋白HIF-1α表达上调,凋亡相关蛋白c-parp表达降低,而自噬相关蛋白LC3表达上调,由此推测乏氧导致放射敏感性下降的原因可能与细胞逃逸凋亡和(或)诱导自噬相关。凋亡作为I型程序性死亡其与放射敏感性的相关性已经有许多学者进行了深入研究[12]。但自噬作为Ⅱ型程序性死亡与放射敏感性、乏氧及HIF-1α的复杂关系尚未得到清晰阐述。
研究发现乏氧可诱导自噬的产生,自噬在肿瘤的乏氧区域表现明显[13-14]。自噬是一种防御机制,在营养缺乏、损伤、放疗等应激情况下,特别是缺氧条件下能够降解自身物质获得生存的能量,使细胞逃逸凋亡。研究显示,肿瘤细胞的放疗抗性与自噬密切相关[15]。笔者前期研究也发现,乏氧诱导自噬与放疗抵抗相关[16]。自噬活性与LC3Ⅱ表达强度密切相关,通过检测LC3Ⅱ蛋白的表达,可了解肿瘤细胞的自噬活性[17-18]。本研究发现乏氧可以诱导LC3I向LC3Ⅱ转变,尤其是乏氧A549细胞照射后表现更为明显,说明乏氧可诱导自噬的产生,自噬可能是乏氧导致放疗抵抗的重要机理之一。
在细胞乏氧调控网络中,HIF-1α是细胞乏氧状态下调控基因表达的主要转录因子之一,以其为核心,与其上下游基因及产物形成一个复杂的调节网络,从而介导相应的生物学效应。本研究还发现HIF-1α在常氧下基本上不表达,一旦氧分压降低,其表达明显增加,提示HIF-1α的表达与氧分压密切相关,这与文献报道完全一致[19]。为进一步深入探讨其功能,拟建立HIF-1α表达受抑制的乏氧细胞模型。本研究采用的质粒pGenesil-1为转录靶向抑制HIF-1α mRNA的表达质粒,为pEGFP-C1质粒经Sal-I酶切插入人U6启动子改造而成。利用RNAi及稳定转染技术筛选得到的阳性克隆A549/HIF-1α-shRNA细胞,具有绿色荧光蛋白的表达,经Western blot检测到乏氧诱导的HIF-1α蛋白表达几乎完全被抑制,与预期结果一致。在成功构建靶向抑制HIF-1α表达的乏氧细胞模型后,采用克隆形成实验检测细胞的放射敏感性,结果显示shRNA抑制HIF-1α表达可提高乏氧A549细胞的放射敏感性,逆转细胞放射抵抗。这给我们在临床研究中提供了一个思路,抑制HIF-1α可能可以作为提高放疗疗效的另一靶点。
我们在前期的研究中发现乏氧条件下细胞放射敏感性降低,细胞自噬活性增强,且均与HIF-1a的表达相关[16]。文献报道,乏氧细胞通过上调HIF-1,调控下游目的分子 BNIP3和BNIP3L的表达,BNIP3通过与其他分子之间的相互作用诱导自噬,保护自身免受乏氧造成的损伤[20];或乏氧细胞通过HIF-1α/AMPK通路诱导自噬[21]。在本研究中,我们发现乏氧条件下HIF-1α表达受抑制后 LC3Ⅱ蛋白的表达明显降低,c-parp表达量增加。乏氧可能是通过上调 HIF-1α,激活 HIF-1的转录活性,促进LC3Ⅱ的表达,导致细胞自噬活性增强。而HIF-1α 被抑制后,细胞可能出现程序性死亡即凋亡,这与细胞放射敏感性增高相吻合。由此我们认为抑制HIF-1的表达后,自噬的这种保护作用下降,细胞凋亡增加,从而提高细胞的放射敏感性。
本研究运用RNAi技术成功构建了靶向抑制HIF-1α表达的乏氧细胞模型,相对比较简便,并可用于其他细胞模型进行相关研究。利用shRNA抑制HIF-1α表达后提高乏氧A549细胞的放射敏感性,降低自噬活性,说明自噬在乏氧所致的放射抵抗中占有重要作用,并且HIF-1α在其中起到关键介导作用,但具体机制还需要深入研究。
[1] COSSE J P, MICHIELS C. Tumour hypoxia affects the responsiveness of cancer cells to chemotherapy and promotes cancer progression[J]. Anticancer Agents Med Chem, 2008, 8(7): 790-797.
[2] RUAN K, SONG G, OUYANG G. Role of hypoxia in the hallmarks of human cancer[J]. J Cell Biochem, 2009, 107(6): 1053-1062.
[3] YASUDA H. Solid tumor physiology and hypoxia-induced chemo/radio-resistance: novel strategy for cancer therapy: nitric oxide donor as a therapeutic enhancer[J]. Nitric Oxide, 2008, 19(2): 205-216.
[4] MOELLER B J, RICHARDSON R A, DEWHIRST M W. Hypoxia and radiotherapy: opportunities for improved outcomes in cancer treatment[J]. Cancer Metastasis Rev, 2007, 26(2): 241-248.
[5] HENNESSEY D, MARTIN LM, ATZBERGER A, et al. Exposure to hypoxia following irradiation increases radioresistance in prostate cancer cells[J]. Urol Oncol, 2011. [Epub ahead of print].
[6] YANG W, SUN T, CAO J, et al. Hypoxia-inducible factor-1α downregulation by small interfering RNA inhibits proliferation, induces apoptosis, and enhances radiosensitivity in chemical hypoxic human hepatoma SMMC-7721 cells[J]. Cancer Biother Radiopharm, 2011, 26(5): 565-571.
[7] CHAACHOUAY H, OHNESEIT P, TOULANY M, et al. Autophagy contributes to resistance of tumor cells to ionizing radiation[J]. Radiother Oncol, 2011, 99(3): 287-292.
[8] PURSIHEIMOJ P, RANTANEN K, HEIKKINEN P T, et al. Hypoxia-activated autophagy accelerates degradation ofSQSTM1/p62[J]. Oncogene, 2009, 28(3): 334-344.
[9] MCGINNIS K M. RNAi for functional genomics in plants[J]. Brief Funct Genomics, 2010, 9(2): 111-117.
[10] CARLSON D J, YENICE K M, ORTON C G. Tumor hypoxia is an important mechanism of radioresistance in hypofractionated radiotherapy and must be considered in the treatment planning process[J]. Med Phys, 2011, 38(12): 6347.
[11] HSIEH C H, LEE C H, LIANG J A, et al. Cycling hypoxia increases U87 glioma cell radioresistance via ROS induced higher and long-term HIF-1 signal transduction activity[J]. Oncol Rep, 2010, 24(6): 1629-1636.
[12] MOON S U, CHOI S K, KIM H J, et al. The expression of human papillomavirus type 16 (HPV16 E7) induces cell cycle arrest and apoptosis in radiation and hypoxia resistant glioblastoma cells[J]. Mol Med Report, 2011, 4(6): 1247-1253.
[13] KASPER R, TWAN B, LUDWIG D, et al. The unfolded protein response protects human tumor cells during hypoxia through regulation of the autophagy genes MAP1LC3B and ATG5[J]. J Clin Invest, 2010, 120(1): 127-141.
[14] MUHAMMAD N, BASSAM J, KRIS M, et al. Role of hypoxia induced autophagy in the resistance of tumor cells to CTL-mediated specific lysis[J]. J Immunol, 2010, 184, 95.11.
[15] APEL A, HERR I, SCHWARZ H, et al. Blocked autophagy sensitizes resistant carcinoma cells to radiation therapy[J]. Cancer Res, 2008, 68: 1485-1494.
[16] 邹燕梅, 熊华, 袁响林, 等. 乏氧诱导的自噬与肺腺癌放射抵抗的相关性研究[J]. 华中科技大学学报医学版, 2011, 4: 413-416.
[17] MCLELAND C B, RODRIGUEZ J, STERN S T. Autophagy monitoring assay: qualitative analysis of MAP LC3-I to Ⅱconversion by immunoblot[J]. Methods Mol Biol, 2011, 697: 199-206.
[18] WANG A L, BOULTON M E, DUNN W A JR, et al. Using LC3 to monitor autophagy flux in the retinal pigment epithelium[J]. Autophagy, 2009, 5(8): 1190-1193.
[19] ŁUCZAK MW, ROSZAK A, PAWLIK P, et al. Increased expression of HIF-1A and its implication in the hypoxia pathway in primary advanced uterine cervical carcinoma[J]. Oncol Rep, 2011, 26(5): 1259-1264.
[20] BELLOT G, GARCIA-MEDINA R, GOUNON P, et al. Hypoxia-induced autophagy is mediated through hypoxiainducible factor induction of BNIP3 and BNIP3L via their BH3 domains[J]. Mol Cell Biol, 2009, 29(10): 2570-2581.
[21] HU Y L, DELAY M, JAHANGIRI A, et al. Hypoxia-induced autophagy promotes tumor cell survival and adaptation to antiangiogenic treatment in glioblastoma[J]. Cancer Res, 2012, 72(7): 1773-1783.
《抗癌》杂志征稿启事
《抗癌》杂志于1988年创刊,主管单位为上海市科学技术协会,主办单位为上海市抗癌协会,杂志刊号:CN31-1664/R ISSN 1008-3065。征稿栏目及内容如下。
一、《抗癌博客》栏目
记录癌症患者自强不息、热爱生活、勇敢面对病痛和生活压力的故事,能够启发其他患者自信和勇敢的精神,帮助他们建立积极、知足、感恩和达观的生活态度。可以是你的亲身经历,也可以是医生治疗患者时的所见所闻,或是你身边发生的故事。
二、《正谊明道、大医精诚》栏目
真实记录医生对患者的关怀;或是爱岗敬业、精益求精富有专业精神的事迹,能让更多医道同仁敬重和学习。可以讲述患者眼里的医生,也可以记录你的同事。
以上稿件《抗癌》杂志编辑部在发表时有修改的权力,如果不同意修改请注明,谢谢!欢迎各位作者踊跃投稿。
来稿请寄:上海市东安路270号6号楼3楼《抗癌》杂志社
邮 编:200032 电 话:021-64043766
传 真:021-64043766 E-mail:anti-cancer@163.com
Effect of HIF-1α expression inhibition by RNA interference on radiosensitivity and autophagy of hypoxic human lung adenocarcinoma cell line A549
ZOU Yan-mei, XIONG Hua, XIAO Zhi-ping, YU Shi-ying, YUAN Xiang-lin (Cancer Center, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan, Hubei, 430030, China)
XIONG Hua E-mail: xionghua2001@yahoo.com.cn
Background and purpose: Hypoxia induced the decreased radiosensitivity of tumor cells, which was the cause of tumor radioresistance and relapse and metastasis. During the course, HIF-1a played the most important role in the regulation of hypoxia. However, it’s still unknown about the effect of HIF-1a on the radiosensitivity of hypoxia tumor cells and the relationship with autophagy. This study was to inhibit HIF-1α expression in hypoxic lung adenocarcinoma cell line A549 with RNA interference (RNAi), and explore its effect on hypoxic cell radiosensitivity and autophagy. Methods: Plasmids pHIF-1α-shRNA and Neg-shRNA (negative control) were constructed and transfected into hypoxic A549 cells, this positive clone was named A549/HIF-1α-shRNA. Clone formation array was applied to calculate the value of D0, SF2, SER. The expression of HIF-1α, LC3, c-parp was detected by Western blot. Results: The SF2 of hypoxic A549 cell was 0.62, which was higher than that of normoxic A549 cell, SER was 1.45. The level of LC3Ⅱ increased significantly and the level of c-parp decreased after the radiation of hypoxic A549 cell. The level of HIF-1a increased in hypoxic A549 cells. The expression of HIF-1α in hypoxic A549 cells was suppressed markedly after transfection of HIF-1α-shRNA; this clone was named A549/HIF-1α-shRNA. The SF2 and SER were significantly lower in A549/HIF-1α-shRNA cells, 0.45 and 0.72 respectively. Under the hypoxic condition and after the inhibition of HIF-1α, the expression of LC3Ⅱ decreased significantly and the expression of c-parp increased. Conclusion: We successfully established a cell model that HIF-1α expression was suppressed almost completely byRNAi. The inhibition of HIF-1α by shRNA may raise the radiosensitivity and decrease the autophagy of hypoxic A549 cells in vitro.
Hypoxia; Autophagy; Radiosensitivity; HIF-1α; RNAi
10.3969/j.issn.1007-3969.2013.06.003
R734.2
:A
:1007-3639(2013)06-0413-07
2013-02-22
2013-04-03)
国家自然科学基金青年科学基金(No:81201779)。
熊华 E-mail:xionghua2001@yahoo.com.cn
