新型18F-RGD二聚体的正常生物分布及U87MG荷瘤裸鼠小动物PET/CT显像研究
2013-06-09
复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海200032
新型18F-RGD二聚体的正常生物分布及U87MG荷瘤裸鼠小动物PET/CT显像研究
鲍晓 王明伟 徐俊彦 郑宇佳 蒋津津 章英剑
复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海200032
背景与目的:整合素αvβ3受体在促进、维持以及调节血管生成的过程中有着至关重要的作用,高表达于多种肿瘤细胞及新生血管内皮细胞。RGD多肽序列可与整合素αvβ3受体特异性结合,有助于评价肿瘤的生长状况和侵袭性。本实验主要研究18F标记的RGD二聚体18F-E[c(RGDfK)2]在正常昆明小鼠体内的生物分布和荷人神经胶质瘤裸鼠模型的小动物PET/CT显像情况。方法:以硝基RGD二聚体4-NO2-3-TFMBz-E[c(RGDfK)2]为前体,使用改进的自动化合成模块Explora GN,一步法直接标记合成18F-E[c(RGDfK)2]。用昆明小鼠分析18F-E[c(RGDfK)2]0.5、1、2、4 h的生物分布,计算每克组织放射性占注入量的百分比(%ID/g)。观察荷人神经胶质瘤裸鼠模型1、2、4 h的小动物PET/CT显像情况。结果:18F-E[c(RGDfK)2]的标记率约为10%,放化纯度>98%,稳定性可达10 h。18F-E[c(RGDfK)2]主要经肾排泄,血液清除迅速,注射后1 h,肾、肝、小肠、肌肉和血的放射性摄取值分别为(1.02±0.16)%ID/g、(0.24±0.06)%ID/g、(0.35±0.03)%ID/g、(0.13±0.03)%ID/g和(0.11±0.03)%ID/g。注射后1 h,肿瘤对18F-E[c(RGDfK)2]的摄取达到高峰(5.2±0.56)%ID/g,T/M为5.36。阻断显像中,可见肿瘤组织放射性摄取明显减低,T/M平均值为1.57。结论:18F-E[c(RGDfK)2]与整合素受体特异性结合,肿瘤摄取较高、显像清晰,可用于整合素表达阳性肿瘤的预后判断、血管靶向治疗适应证的选择及疗效判断。
18F-E[c(RGDfK)2];整合素;荷人神经胶质瘤裸鼠模型;小动物PET/CT
肿瘤细胞的生长、侵袭及转移依赖于血管生成[1],当肿瘤直径超过2 mm时,其继续生长就必须依靠血液供应。整合素αvβ3受体在促进、维持以及调节血管生成的过程中有着至关重要的作用,其高表达于多种肿瘤细胞(如骨肉瘤、胶质瘤、恶性黑色素瘤、肺癌、乳腺癌等)及新生血管内皮细胞,而在成熟血管内皮和正常组织中不表达或低表达[2-3]。测定肿瘤组织中整合素受体的表达水平,有助于评价肿瘤的生长状况和侵袭性。包含精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)序列的多肽,可以与整合素αvβ3受体特异性结合。整合素的这一特性,使其在肿瘤预后判断、血管靶向治疗适应证的选择及疗效判断领域中,成为非常有吸引力的靶点,已有多篇文献报道了放射性核素(18F、99Tcm、64Cu等)标记的RGD多肽对整合素αvβ3受体具有良好的靶向性和显像效果[4-7],其中18F-Galacto-RGD和18F-fluciclatide已进入临床试验阶段[8-9]。本研究主要探讨18F标记的新型RGD环肽18F-E[c(RGDfK)2]在昆明小鼠体内的生物分布和荷人神经胶质瘤裸鼠的小动物PET/CT显像研究。
1 材料和方法
1.1 材料和仪器
1.1.1 细胞
U87MG人神经胶质瘤细胞,购于中国科学院上海细胞库。
1.1.2 动物
昆明小鼠20只,雌性,4~5周龄,体质量17~20 g;BALB/c雌性裸鼠5只,4~6周龄,体质量20~25 g,均购于复旦大学上海医学院实验动物部,并在其实验中心饲养。
1.1.3 主要试剂
RGD二聚体硝基前体4-NO2-3-TFMBz-E[c(RGDfK)2](化学纯度>99%)由美国国立卫生研究院陈小元教授惠赠。药用乙醇为南京化学试剂有限公司产品;K222(Kryptofix 222)、无水乙腈和无水碳酸钾为美国Sigma-Aldrich公司产品;HPLC/光谱纯乙腈为美国TEDIA公司产品;富[18O]氧水购自上海化工研究院。其他化学试剂均为分析纯,购自国药集团上海化学试剂公司。DMEM培养基购自HyClone公司,内含10%胎牛血清、青霉素100 IU/mL、链霉素100 μg/mL;0.25%胰酶购自Gibco公司。
1.1.4 主要仪器
医用回旋加速器(40 μA×11 MeV)、Explora GN合成模块(配有可编写合成控制软件)、半制备型高效液相色谱仪(HPLC,Explora LC,配有紫外和放射性检测器)均为SIEMENS公司产品;分析型HPLC(1200系列),配有可变波长检测器、流式γ放射性检测器(Gabi Star购自德国Raytest公司)、Zorbax 300SB-C18分析柱(4.6 mm×250 mm,5 μm)为美国Agilent公司产品;放射性活度计(CRC®-15PET)为美国Capintec公司产品。电子天平购自SARTORIUS公司BSA223S;γ放射性免疫计数仪为上海日环仪器厂SN-697型;小动物PET/CT购自SIEMENS公司,型号为Inveon。
1.218F-E[c(RGDfK)2]的制备
依据参考文献[10]建立18F-E[c(RGDfK)2]的放射化学合成路线,使用参考文献[11]中改进的Explora GN模块进行自动化合成。具体制备过程是将干燥活化的18F离子与前体4-NO2-3-TFMBz-E[c(RGDfK)2](0.8~1.5 mg)在无水DMSO (0.8 mL)中140 ℃加热反应20 min,冷却后,经Sep-Pak C18柱预处理、半制备HPLC纯化、C18柱赋型,获得18F-E[c(RGDfK)2]的注射用溶液,利用Radio-HPLC分析其放射化学纯度。
1.3 细胞培养及动物模型的建立
U87MG人神经胶质瘤细胞用上述调配好的DMEM培养基,在37 ℃、CO2体积分数为5%的细胞培养箱中常规培养,每3~4 d于细胞对数生长期时1︰3传代培养。用PBS洗涤细胞后,0.25%胰酶消化,离心(1 000 r/min,5 min,离心半径为13.5 cm),DMEM培养基吹打混匀,调整细胞浓度准备接种。在每只BALB/c雌性裸鼠右腋下,皮下注射3×106~5×106个细胞(约0.2 mL),饲养于IVC级动物房2~3周,每周用游标卡尺测量肿瘤直径,待肿瘤直径长至0.8~1 cm时,即可用于实验。
1.4 正常小鼠体内生物分布
20只昆明小鼠,均从尾静脉注射18F-E[c(RGDfK)2] 30 μCi(1.11 MBq)。按照完全随机法分为4组(n=5),分别于注射后0.5、1、2、4 h脱颈处死,收集血液及相应脏器(肝、肾、骨等),称其湿重并测量各脏器放射性计数,计算每克组织放射性占注入量的百分比(%ID/g)。
1.5 荷瘤裸鼠小动物PET/CT显像
5只荷瘤裸鼠分别自尾静脉注射18F-E[c(RGDfK)2] 100 μCi(3.7 MBq),于注射后1、2、4 h在异氟烷麻醉状态下,行小动物PET/CT扫描,三维模式采集10 min静态图像。OSEM3D/ MAP法重建,获得衰减校正后荷瘤裸鼠体内18F-E[c(RGDfK)2]分布融合图像,在肿瘤部位和对侧肌肉勾画感兴趣区域(regions of interest,ROI),测定%ID/g。
1.6 荷瘤裸鼠阻断实验
将18F-E[c(RGDfK)2] 30 μCi(1.11 MBq)与300 μg F-RGDfK2混匀,经荷瘤裸鼠尾静脉注入(n=3),注射后1 h在异氟烷麻醉状态下,行小动物PET/CT扫描,采集10 min静态图像。
2 结 果
2.118F-E[c(RGDfK)2]的制备
基于硝基前体4-NO2-3-TFMBz-E[c(RGDfk)2]的一步直接标记法制备18F-E[c(RGDfK)2],反应过程简单,易于自动化合成。利用改进的Explora GN模块实现了18F-E[c(RGDfK)2]的自动化合成,放化产率为0.5%~1%,标记率为10%,放化纯度>98%,稳定性可达10 h(约5个半衰期)。
2.2 正常小鼠体内生物分布
18F-E[c(RGDfK)2]在小鼠体内吸收迅速、清除较快,以肾脏放射性摄取最高,且显著高于其他组织器官,注射后0.5、1、2、4 h肾脏放射性摄取值分别为(1.74±0.47)%ID/g、(1.02±0.16)%ID/g、(0.74±0.23)%ID/g、(0.33±0.14)%ID/g,其在1、2、4 h较0.5 h分别下降了41.38%、57.47%、81.03%,可见18F-E[c(RGDfK)2]主要经泌尿系统排泄。肝、胃、小肠的放射性摄取值相近且明显低于肾脏的摄取,注射后0.5 h分别为(0.50±0.19)%ID/g、(0.71±0.28)%ID/g、(0.61±0.27)%ID/g,由此可见药物经消化系统排泄相对较少。血液、肌肉及脑组织具有低于其他组织器官的放射性摄取值,注射后0.5 h分别为(0.33±0.07)%ID/g、(0.22±0.06)%ID/g、(0.08±0.04)%ID/g(表1)。
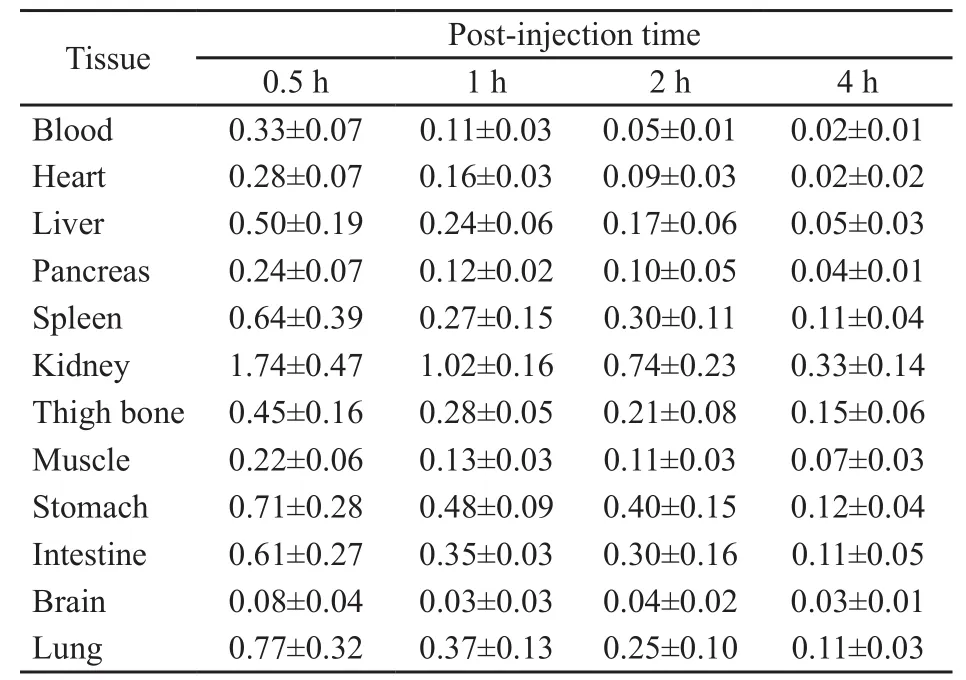
表 118F-E[c(RGDfK)2]在正常昆明小鼠体内生物分布Tab. 1 Biodistribution of18F-E[c(RGDfK)2] in healthy KM mice (%ID/g, n=5)
2.3 荷瘤裸鼠小动物 PET/CT显像
注射18F-E[c(RGDfK)2]后1 h肿瘤组织清晰可见,放射性摄取最大值为(5.2±0.56)%ID/g,随时间延长,肿瘤放射性浓聚程度略有减低,2、4 h的放射性摄取最大值分别为(4.77±0.15) %ID/g、(4.4±0.70)%ID/g(图1)。因药物经泌尿系统排泄,故两侧肾脏可见大量生理性放射性分布,全身其余组织器官放射性摄取较低,注射后1 h,T/M比值为5.36。
2.4 荷瘤裸鼠阻断实验
大剂量阻断后1 h,小动物PET/CT显像可见肿瘤放射性摄取明显减低(图2),接近本底,T/M平均值为1.57,下降了71%,说明18F-E[c(RGDfK)2]能够与整合素αvβ3受体特异性结合。
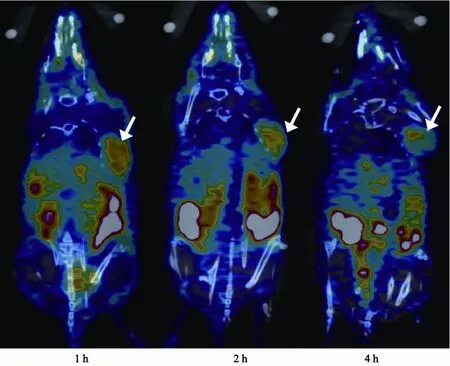
图 1 荷瘤裸鼠在各时相的18F-E[c(RGDfK)2] 小动物PET/CT显像(箭头所指为肿瘤)Fig. 1 Representative micro PET/CT images of U87MG tumor-bearing mice at 1, 2, 4 h postinjection of 18F-E[c(RGDfK)2] (100 μCi)

图 2 荷瘤裸鼠注射18F-E[c(RGDfK)2]后1 h的非阻断(A)和阻断(B)显像(箭头示肿瘤灶)Fig. 2 Micro PET/CT images of U87MG tumor-bearing nude mice at 1 h postinjection of 100 μCi18F-E[c(RGDfK)2] (A) and corinjection with 300 μg F-RGDfK2(B)(arrow showed tumor foci)
3 讨 论
RGD多肽序列与整合素αvβ3的结合是特异性的配体-受体结合过程,因此提高结合位点局部的配体浓度以及与受体的亲和性,是改善显像效果的必要途径。Chen等[12]和Li等[13]的研究证实,RGD二聚体比RGD单体具有更高的受体亲和性、更多的肿瘤摄取及更长的瘤内滞留时间,而RGD四聚体、八聚体则依次更胜一筹。虽然多聚体在肿瘤中摄取增高,但在肾脏等正常组织器官中也有较高的摄取,排泄时间延长,而且多聚体的合成制备较复杂。综合上述因素,本研究选用18F标记的RGD二聚体18F-E[c(RGDfK)2]作为分子影像探针。
18F-E[c(RGDfK)2]在U87MG胶质瘤裸鼠体内主要经泌尿系统排泄,肝脏摄取较低,注射后1 h肿瘤摄取较高(5.2±0.56)%ID/g。血液中放射性清除迅速,注射后4 h较0.5 h下降93%,肾脏下降81%,肌肉的放射性摄取持续低水平,注射后1 h T/M为5.36,可以获得较好的显像效果。随着时间延长,肿瘤的放射性摄取轻度下降(15%),可能原因是血液清除速度较快,肿瘤组织在一定时间点后无法继续从血液中摄取更多的18F-E[c(RGDfK)2]。潘栋辉等[14]报道,18F-E[c(RGDfK)2]注射到荷人胰腺癌BxPC-3裸鼠体内30、60、120 min后,肿瘤区的放射性摄取值分别为(4.03±0.32) %ID/g、(3.31±0.20)%ID/g和(2.72±0.17)%ID/g,下降趋势与本研究结果基本一致,而30 min后肠的摄取值为(1.62±0.24)%ID/g,2 h后则上升至(3.91±0.37)%ID/g,与本研究结果相反。Chen等[12]将18F-E[c(RGDfK)2]注入MDA-MB-435乳腺癌裸鼠模型中,发现肠道放射性摄取值亦呈现上升趋势。上述2篇文献在计算生物分布时,均在小动物PET/CT图像上勾画ROI,计算放射性浓度(GBq/L),所得值除以注射剂量得到%ID/g(假设组织密度为1 kg/L),所以勾画肠道ROI时难免包含肠道内容物及分泌物。而本研究采用正常昆明小鼠,于各时相处死获取各脏器组织,称重并用γ放射性免疫计数仪测量其放射性,所获结果更为准确。Chen等[12]在MDA-MB-435乳腺癌裸鼠模型中,获得的肿瘤放射性摄取值随时间延长有轻微上升趋势,这可能与肿瘤模型异质性有关。Schnell[9]等应用18F-Galacto-RGD对恶性胶质瘤患者行动态扫描亦得出相似结论,即肿瘤内放射性摄取值随时间延长逐渐下降,并认为肿瘤组织放射性摄取值在40~60 min时处于平台期,是进行图像采集及SUV分析的恰当时段。
18F-E[c(RGDfK)2]与整合素受体特异性结合,肿瘤摄取较高、显像清晰,适宜用于整合素表达阳性肿瘤的早期诊断、预后判断、血管靶向治疗适应证的选择及疗效判断。本研究中18F-E[c(RGDfK)2]的放化产率较低,有待进一步提高。
[1] FOLKMAN J. Tumor angiogenesis: therapeutic implications[J]. N Engl J Med, 1971, 285(21): 1182-1186.
[2] RUOSLAHTI E. Specialization of tumour vasculature [J]. Nat Rev Cancer, 2002, 2(2): 83-90.
[3] NIU G, CHEN X. Why integrin as a primary target for imaging and therapy [J]. Theranostics, 2011, 1: 30-47.
[4] YAN Y, CHEN K, YANG M, et al. A new 18F-labeled BBNRGD peptide heterodimer with a symmetric linker for prostate cancer imaging [J]. Amino Acids, 2011, 41(2): 439-447.
[5] DUMONT R A, DEININGER F, HAUBNER R, et al. Novel (64)Cu- and (68)Ga-labeled RGD conjugates show improved PET imaging of α(ν)β(3) integrin expression and facile radiosynthesis [J]. J Nucl Med, 2011, 52(8): 1276-1284.
[6] 赵慧云, 刘妍, 贾兵, 等. 双靶点分子探针68Ga-RGD-BBN用于乳腺癌的microPET显像 [J]. 生物物理学报, 2011, 27(4): 335-344.
[7] 锁耀宇, 杨卫东, 马晓伟, 等. 99Tcm标记RGD环肽在荷肺腺癌裸鼠中的显像研究 [J]. 中华核医学杂志, 2011, 31(6): 405-409.
[8] TOMASI G, KENNY L, MAURI F, et al. Quantification of receptor-ligand binding with [18F] fluciclatide in metastatic breast cancer patients [J]. Eur J Nucl Med Mol Imaging, 2011, 38(12): 2186-2197.
[9] SCHNELL O, KREBS B, CARLSEN J, et al. Imaging of integrin alpha(v)beta(3) expression in patients with malignant glioma by [18F] Galacto-RGD positron emission tomography [J]. Neuro Oncol, 2009, 11(6): 861-870.
[10] JACOBSON O, ZHU L, MA Y, et al. Rapid and simple onestep F-18 labeling of peptides [J]. Bioconjug Chem, 2011, 22(3): 422-428.
[11] 张勇平, 章英剑, 王明伟, 等. 应用Explora GN/LC模块进行16a-[18F]氟-17β-雌二醇全自动化合成 [J]. 中华核医学杂志, 2011, 31(3): 196-200.
[12] CHEN X, TOHME M, PARK R, et al. Micro-PET imaging of alpha(v)beta(3)-integrin expression with 18F-labeled dimeric RGD peptide [J]. Mol Imaging, 2004, 3(2): 96-104.
[13] LI Z B, CAI W, CAO Q, et al. (64)Cu-labeled tetrameric and octameric RGD peptides for small-animal PET of tumor alpha(v)beta(3) integrin expression [J]. J Nucl Med, 2007, 48(7): 1162-1171.
[14] 潘栋辉, 杨敏, 徐宇平, 等. 18F-RGD环肽二聚体的自动化合成及小动物PET显像 [J]. 中华核医学与分子影像杂志, 2012, 32(2): 90-94.
Biodistribution in healthy KM mice and micro PET/CT imaging in U87MG tumor-bearing nude mice of a new 18F-labeled cyclic RGD dimer
BAO Xiao, WANG Ming-wei, XU Jun-yan, ZHENG Yu-jia, JIANG Jin-jin, ZHANG Ying-jian (Department of Nuclear Medicine, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
Background and purpose: Integrin αvβ3receptor plays an important role in promoting, sustaining and regulating the angiogenesis. It is overexpressed on neovascular endothelial cells and tumor cells. RGD peptide specifically binds to integrin αvβ3, which could evaluate growth status and invasiveness of tumor. This study aimed to investigate the biodistribution in healthy KM mice and micro PET/CT imaging in U87MG tumor-bearing mice of18F-E[c(RGDfK)2]. Methods:18F-E[c(RGDfK)2] was produced using an automated synthesis module via a simple one-step18F-labeling strategy of the precursor 4-NO2-3-TFMBz-E[c(RGDfK)2]. The percentage activity of injection dose per gram of tissue (%ID/g) was calculated at 0.5, 1, 2, 4 h post injection of the probe. Micro PET/CT images of U87MG tumor-bearing nude mice with or without18F-E[c(RGDfK)2] blocking were acquired at each time point. Results: The labeling efficiency and radiochemical purity of18F-E[c(RGDfK)2] were 10% and 98%, respectively.18F-E[c(RGDfK)2] was excreted via renal route, with a high blood clearance. The other organs had backgroundlevel activity accumulation. At 1 h, the %ID/g of kidney, liver, intestine, muscle and blood was (1.02±0.16)%ID/g,(0.24±0.06)%ID/g, (0.35±0.03)%ID/g, (0.13±0.03)%ID/g and (0.11±0.03)%ID/g18F-E[c(RGDfK)2] had initial high tumor uptake [(5.2±0.56)%ID/g] and good tumor-to-background contrast (5.36) at 1 h post injection. Tumor uptake for blocking group was lower than those without blocking, and T/M reduced to 1.57. Conclusion:18F-E[c(RGDfK)2] appears a promising PET molecular imaging probe targeting integrin αvβ3, with high tumor uptake. It could be suitable for prognosis evaluation of integrin-positive tumor, selection of vascular targeting therapy and therapy effect monitoring.
18F-E[c(RGDfK)2]; Integrin; Nude mice bearing U87MG human glioma xenogrfts; Micro PET/CT
10.3969/j.issn.1007-3969.2013.06.002
R739.4
:A
:1007-3639(2013)06-0408-05Correspondence to: ZHANG Ying-jian E-mail: yjzhang111@yahoo.com.cn
2012-11-08
2013-04-10)
国家自然科学基金(No:11275050;No:30700188)。
章英剑 E-mail:yjzhang111@yahoo.com.cn
