改性海泡石的特性及其对重金属离子的吸附研究
2013-06-08郑淑琴张建策余红霞
郑淑琴,任 劭,张建策,余红霞
(湖南理工学院化学化工学院,湖南 岳阳 414000)
在去除重金属离子方面的研究中,选择的粘土类吸附剂大多为膨润土[1-3]、硅藻土[4-5]和蒙脱土[6-7],而对海泡石[8-9]类矿产相关的研究相对较少。海泡石是一种纤维状富镁硅酸盐粘土矿物,化学式为Mg8Si12O30(OH)4(OH2)4·8H2O,结构属于2∶1层链过渡型结构,沿C轴方向有一系列孔道,具有大的比表面积和孔体积,正是这种独特的层状结构使得海泡石在吸附和离子交换性能方面具有突出的特点。本文在对海泡石改性研究的基础上,将其应用于重金属Cu2+、Zn2+、Ni2+离子的吸附,探讨含重金属离子溶液的pH值、吸附时间、吸附温度、吸附浓度等因素对改性海泡石吸附重金属离子的影响。
1 试验部分
1.1 原料及试剂
海泡石由湖南湘潭鸿雁海泡石有限公司提供,组成为(%):SiO254.36,MgO 16.68,Al2O30.42,CaO 1.53,Fe2O30.69,Na2O 0.25,K2O 0.13;氯化铜、氯化锌和硝酸镍,分析纯,天津市福晨化学试剂厂生产;盐酸,分析纯,湖南省株洲开发区石英化玻有限责任公司。
1.2 试验方法
1.2.1 海泡石改性
称取海泡石样品5.0g,采用盐酸对海泡石进行改性,在固液比为10∶1、盐酸浓度为1mol/L条件下,通过不同反应时间,分别制取海泡石脱镁率为5%、10%、15%、20%和25%等5个样品,海泡石和以上5个改性海泡石样品分别记为S-0、S-1、S-2、S-3、S-4和S-5。
1.2.2 吸附试验
分别配制浓度为1000mg/L的Cu2+、Zn2+和Ni2+溶液作为储备液,使用时稀释到相应浓度。在带塞的试管中加入一定量的海泡石和已配制的标准溶液,用1.0mol/L的HCl和1.0mol/L的NaOH溶液调整溶液的pH值,然后放在恒温振荡器上,保持一定频率,振荡2h。改变Cu2+、Zn2+和Ni2+初始浓度、pH值、温度等条件分别进行平衡吸附试验,用移液管取5mL混合液离心分离,取上层清夜用原子吸收分光光度仪分析溶液中Cu2+、Zn2+和Ni2+的浓度。
1.3 样品测试
1.3.1 脱镁率
脱镁率采用AAS-400型(美国PE公司)原子吸收分光光度仪测定,配有镁空心阴极灯。仪器工作条件:波长285.2nm,灯电流4mA,空气流量10L/min,乙炔流量2.5L/min。
首先配制镁离子浓度分别为0.00、0.50、1.00、2.00、3.00、4.00、5.00、6.00、7.00mg/L的标准溶液,按仪器工作条件进行工作曲线的绘制。样品的脱镁率由下式得到:

式中:w(Mg1)表示提纯海泡石中的镁含量;w(Mg2)表示酸改性海泡石中镁含量;w(Mg1)-w(Mg2)表示在酸溶液中的镁含量,由原子吸收得到。
1.3.2 吸附量
利用原子吸收分光光度仪分析溶液中Cu2+、Zn2+和Ni2+的浓度。按下式计算吸附量:

式中:q 表示吸附量(mg/g);C0和C 分别为吸附前后标准溶液的浓度(mg/L);V 为被吸附溶液的体积(mL);W 表示海泡石的量(g)。
1.4 样品表征
1.4.1 比表面积和孔径分布
采用美国Micromeritics TriStar3000吸附仪测定样品的比表面积、孔体积和孔径分布。测定时,样品先于300℃脱气4h,脱气压力低于0.1333Pa。以氮气为吸附质,在-196℃吸附。以氦气作载气。脱气条件:300℃及6.67Pa残压,抽空8h。
1.4.2 XRD物相分析
采用日本理学Rigaku-D-Max rA 12kW型X射线转靶衍射仪进行物相分析,选用Cu靶,波长0.154056nm,管电压40kV,管电流30mA。
1.4.3 FT IR分析
在美国Nicolet公司生产的AVTATAR 370型红外光谱仪上进行红外光谱测定,常温常压,KBr压片。
1.4.4 SEM分析
采用JEOL JSM-6360电子扫描电镜(SEM)测定样品的形貌,电压为25kV。
2 结果与讨论
2.1 改性海泡石的性能
2.1.1 改性海泡石比表面和孔结构的变化
利用试验条件改性海泡石,其比表面、孔体积和孔径分布的变化见表1。从表中的数据可以看到,随酸改性强度增大,改性海泡石的比表面和孔体积不断提高,特别是中大孔的孔体积增加的更多,这是由于随着改性海泡石在酸性的作用下,脱镁率增加,海泡石的微孔逐渐向中大孔扩展,晶体结构逐渐转变为硅氧四面体结构,可提高其吸附性能。

表1 改性前后海泡石的比表面和孔结构
2.1.2 改性海泡石结构的变化
2.1.3 改性海泡石的红外光谱吸收

图1 改性前后海泡石的XRD图

图2 改性前后海泡石的IR图
图2为改性前后海泡石的红外光谱,海泡石结构中,3700~3000cm-1波段内的较强吸收带为羟基伸缩振动引起的,1700~1600cm-1吸收带反映了分子水中羟基的弯曲振动,1650~1660cm-1吸收带是沸石水中羟基的弯曲振动,1200~900cm-1处很强的吸收带是Si-O-Si伸缩振动的表现,600~400cm-1波段内很强的吸收带是由Si-O弯曲振动引起的[11]。图中a~f依次为海泡石样品S-0~S-5的红外图谱,可以看出,与a(天然海泡石)相比,b~f(改性海泡石)的3675 cm-1处Mg-OH基吸收带以及3630 cm-1和3551cm-1处结晶水中的羟基吸收带均逐渐减弱,而3414cm-1处Si-OH基振动峰增强。这说明了在酸改性过程中,H+逐渐取代了按八面体配位的镁离子,逐渐失去海泡石中的Mg-OH和与Mg相配位的结晶水。在改性过程中还伴随着Si-OH基的产生,这是H+与Si-O骨架形成的。这与XRD分析结果一致。从图中还可以看出,当改性海泡石脱镁率达到15%后,图谱上1384cm-1处出现了振动峰,关于这个峰的来源还有待于进一步研究。
2.1.4 改性海泡石的SEM分析

图3 改性前后海泡石的SEM照片
改性前后海泡石的SEM照片,如图3所示。由图3(a)可以清晰地看出海泡石的形貌呈现出纤维态的片状和针状,经过改性后的海泡石样品图3(b),纯度提高,主要由呈交错松散分布的细小海泡石纤维组成,片状、粒状的杂质物质减少。
2.2 改性海泡石对重金属离子吸附的影响
2.2.1 天然海泡石与改性海泡石的吸附性能
在pH值=4.0,室温下,向浓度分别为1000 mg/L的Cu2+、Zn2+和Ni2+溶液中分别加入1.0g改性海泡石(S-1)和天然海泡石吸附剂,振荡吸附8h后,测定溶液中Cu2+、Zn2+和Ni2+的浓度,结果见表2。

表2 改性海泡石和天然海泡石对Cu2+、Zn2+和Ni2+的吸附量
由表2可知,改性海泡石的吸附性能明显优于天然海泡石,且改性海泡石对Cu2+、Zn2+和Ni2+的吸附量大小为Cu2+>Zn2+>Ni2+。
2.2.2 不同脱镁率对海泡石吸附性能的影响
在固液比为1∶200、pH值=4的条件下,改性前后海泡石样品分别对50mg/L浓度的Cu2+、Zn2+和Ni2+离子溶液进行吸附,结果见表3。

表3 脱镁率对改性海泡石吸附Cu2+、Zn2+和Ni2+离子的影响
由表3可知,脱镁率约在10%时,样品的吸附量最大。当脱镁率在0~10%之间变化时,随着脱镁率的增加,改性海泡石对Cu2+、Zn2+和Ni2+离子的吸附量均增加;当脱镁率大于10%时,改性海泡石对Cu2+、Zn2+和Ni2+离子的吸附量反而减小。这可能是因为当脱镁率较小时,部分金属化合物溶解,海泡石中的网状孔径变大,两方面的结果使海泡石中更多的表面酸性羟基暴露,这些暴露的表面酸性羟基(-OH)和水分子可与重金属离子Cu2+、Zn2+和Ni2+形成稳定的配离子,导致吸附量增加;当脱镁率达到一定程度时,金属氧化物溶解的更多,使得作为吸附活性中心的Mg-OH数目减少以及可发生离子交换反应的阳离子减少,导致吸附量减少。
2.3 吸附条件对吸附性能的影响
2.3.1 固液比的影响
在pH值=1、吸附时间为4h时,固液比对改性海泡石样品(S-2)吸附50mg/L浓度的重金属离子的影响如表4所示。结果表明,随着固液比的增大,改性海泡石对Cu2+、Zn2+和Ni2+离子的吸附量均呈现增大趋势。
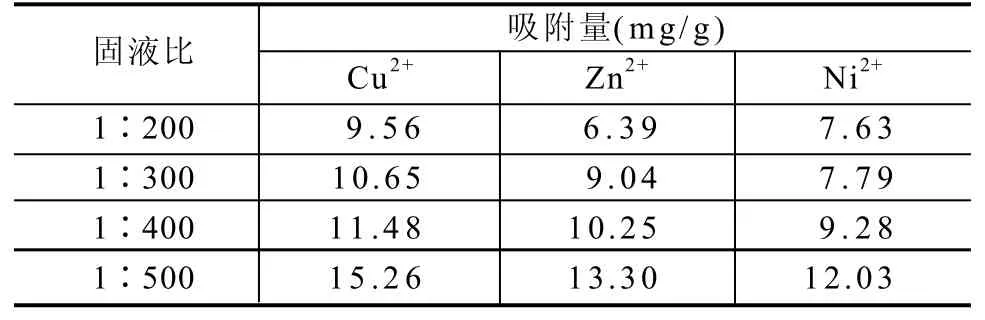
表4 固液比对改性海泡石吸附Cu2+、Zn2+和Ni2+的影响
2.3.2 pH值的影响
取浓度分别为50mg/L的Cu2+、Zn2+和Ni2+溶液各25mL,分别加入50mg改性海泡石(S-2),控制吸附时间为2h,考察不同pH值对Cu2+、Zn2+和Ni2+离子吸附量的影响,结果见表5。

表5 溶液pH值对改性海泡石吸附Cu2+、Zn2+和Ni2+的影响
pH值的改变从两个方面影响了Cu2+、Zn2+和Ni2+在吸附剂上的吸附:①重金属离子Cu2+、Zn2+和Ni2+与H+的竞争吸附。随着pH值的升高,溶液中的H+浓度下降,从而减少了H+对重金属离子的竞争吸附的影响,使得重金属离子有更多的机会接近表面活性位。②表面羟基的变化。随着pH值的升高,有利于表面羟基的质子转移,从而形成质子表面电荷。从表5中可以看出,pH值显著影响了Cu2+、Zn2+和Ni2+在吸附剂上的吸附,在pH值<4.0的酸性条件下,改性海泡石对Cu2+、Zn2+和Ni2+的吸附量较小;在pH值>4.0 的弱酸性至中性溶液中,改性海泡石对Cu2+、Zn2+和Ni2+的吸附量较大。但当pH值>6.0时,开始出现沉淀。因此,吸附的最佳pH值为4.0~6.0。
2.3.3 吸附时间的影响
控制溶液pH值=5.0,在室温下,取浓度分别为50mg/L的Cu2+、Zn2+和Ni2+溶液各25mL,分别加入50mg改性海泡石(S-2),考察不同的吸附作用时间对Cu2+、Zn2+和Ni2+去除率的影响。结果见表6。

表6 吸附时间对改性海泡石吸附Cu2+、Zn2+和Ni2+的影响
从表6可以看出,改性海泡石对Cu2+、Zn2+和Ni2+离子的吸附和吸附作用时间有关,其去除率随吸附时间的延长而相应增大;当吸附时间超过6h后,吸附速度减慢,并且随吸附时间的增加,吸附量缓慢增加;当吸附时间超过8h后,若再延长时间,吸附量的增大已不明显。因此本文选择适宜的吸附时间为6h。
2.3.4 金属离子浓度对吸附量的影响
分别配制10、20、30、40、50、60、80和100mg/L浓度的Cu2+、Zn2+和Ni2+离子溶液,在pH值=4,固液比为1∶500时,用改性海泡石(S-2)在同样条件下进行吸附实验,得到不同浓度下改性海泡石对Cu2+、Zn2+和Ni2+离子的吸附量,见图4。

图4 重金属离子浓度与改性海泡石吸附量的关系
对图4中Cu2+、Zn2+和Ni2+离子浓度与改性海泡石吸附量的关系进行线性拟合分析,发现三种金属离子的吸附曲线均符合Freundlich方程:

式中:C为平衡浓度(mg/L),q为平衡吸附量(mg/g),n 和KF均为常数。以lgq 对lgC作图,回归分析后得到三个线性方程:

式(2)为改性海泡石吸附Cu2+离子的线性方程,相关系数为0.9943(见图5(a));式(3)为改性海泡石吸附Zn2+离子的线性方程,相关系数为0.9941(见图5(b));式(4)为改性海泡石吸附Ni2+离子的线性方程,相关系数为0.9957(见图5(c)),由此可见改性海泡石对Cu2+、Zn2+和Ni2+的吸附符合Freundlich吸附方程。

图5 改性海泡石吸附重金属离子吸附方程的线性拟合
3 结论
通过在室温下利用改性海泡石在不同条件下对重金属离子Cu2+、Zn2+和Ni2+进行吸附,得出了如下结论:
(1)改性海泡石的比表面和孔体积都有提高,其中大孔的孔体积增加的更多。
(2)改性海泡石对重金属离子Cu2+、Zn2+和Ni2+均具有较强的吸附作用,以脱镁率10%的改性海泡石的吸附能力最强,且对重金属离子吸附作用依次为Cu2+>Zn2+>Ni2+。在室温、pH值=5.0、吸附时间为6h条件下,浓度分别为50mg/L的Cu2+、Zn2+和Ni2+溶液,经改性海泡石吸附后,其吸附量分别为21.97、20.36和14.37mg/g。
(3)pH值是影响吸附作用的重要因素,pH值<4.0的酸性条件不利于吸附;pH值>6.0时会有微沉淀产生;在pH值=4.0~6.0弱酸性条件下吸附效果较好。增加溶液中Cu2+、Zn2+和Ni2+离子的浓度,延长吸附作用时间都能不同程度地提高改性海泡石对重金属离子Cu2+、Zn2+和Ni2+的去除率。
(4)改性海泡石对Cu2+、Zn2+和Ni2+离子的吸附符合Freundlich吸附方程。
[1]MELLAHAND A,CHEGROUCHE H.The removal of zinc from aqueous solutions by natural bentonite[J].Water Research,1997,31(3):621-629.
[2]CHEGROUCHE H,MELLAH A,TELMOUNE S.Removal of lanthanum from aqueous solutions by natural bentonite[J].Water Research,1997,31(7):1733-1737.
[3]NASEEM R,TAHIR S S.Removal of Pb(Ⅱ)from aqueous/acidic solutions by using bentonite as an adsorbent[J].Water Research,2001,35(16):3982-3986.
[4]AL-DEGS Y,KHRAISHEH M A M,TUTUNJI M F.Sorption of lead ions on diatomite and manganese oxides modified diatomite[J].Water Research,2001,35(15):3724-3728.
[5]DE CASTRO DANTAS T N,DANTAS NETO A A,MOURA M C P D A.Removal of chromium from aqueous solutions by diatomite treated with microemulsion[J].Water Research,2001,35(9):2219-2224.
[6]SU-HSIA L,RUEY-SHIN J.Heavy metal removal from water by sorption using surfactant modified montmorillonite[J].Journal of Hazardous Materials,2002,B92:315-326.
[7]KRISHNA B S,MURTY D S R,JAI PRAKASH B S.Surfactant modifed clay as adsorbent for chromate[J].Applied Clay Science,2001,20:65-71.
[9]SABAH E,TURAN M,CELIK M S.Adsorption mechanism of cationic surfactants onto acid and heat-activated sepiolites[J].Water Research,2002,36:3957-3964.
[11]杨秀雅,张乃娴,等.中国粘土矿物[M].北京:地质出版社,1994:178-184.
