DAC及TSA对结肠癌细胞系中TIP30基因表达的影响及伊立替康敏感性探讨
2013-06-07马一杰吕慧芳尚艺曼罗素霞陈小兵颜才华
马一杰,吕慧芳,尚艺曼,罗素霞,陈小兵,颜才华
郑州大学附属肿瘤医院(河南省肿瘤医院)肿瘤内科,河南郑州450008
最新研究显示,抑癌基因的失活不仅与基因突变等遗传学改变有关,还与基因的表观遗传学调控密切相关[1-2]。甲基化、组蛋白乙酰化作为重要的基因表观遗传学调控机制之一,受到广泛关注[3-6]。TIP30作为受到众多关注的抑癌基因之一,在许多研究中均已证实与结肠癌预后密切相关[7-9]。
我们在前期研究中发现,TIP30启动子CpG岛高甲基化状态与其基因表达密切相关,且与结肠癌细胞对5-氟尿嘧啶、奥沙利铂的化疗敏感性高度相关[10-11]。本实验旨在前期研究的基础上,通过TIP30基因在结肠癌细胞系HCT116和HT29中药物干预前后的表达,探讨甲基化及乙酰化对该抑癌基因表达的调控以及伊立替康(CPT-11)敏感性的改变,从而探讨结肠癌的发生机制,并为结肠癌为个体化治疗提供新思路。
1 材料与方法
1.1 实验材料 结肠癌细胞株HCT116及HT29购自中国医学科学院细胞中心,注射用盐酸伊立替康(亿迈林)购自齐鲁制药(海南)有限公司,5-aza-2'-deoxy-cytidine(DAC)、Trichostatin A(TSA)购自 Sigma,总RNA抽提试剂Trizol购自Invitrogen,RT-PCR试剂盒购自Promega公司。
1.2 实验方法
1.2.1 细胞培养:结肠癌细胞株HCT116、HT29,含20 ml/L小牛血清的RPMI-1640培养基,37℃、5%CO2饱和湿度培养箱中无菌培养,采用质量分数为0.25%的胰蛋白酶进行消化传代。
1.2.2 试验分组:对照组:同期培养不加药的结肠癌细胞;实验组:(1)DAC组:加 5 μmol/L DAC培养72 h;(2)TSA组:加TSA 300 nmol/L培养24 h;(3)联合组:加5 μmol/L DAC培养48 h后加TSA 300 nmol/L继续培养24 h。
1.2.3 RT-PCR检测各组TIP30基因的mRNA表达:购自Invitrogen公司的Trizol试剂盒,依说明书进行结肠癌HCT116及HT29细胞总RNA抽提,逆转录合成cDNA,PCR反应扩增目的基因。上游引物5'-GTCTTTATTTTGGGCGCCAG-3',下游引物5'-CCCAGCTTTCCCTCTGGTGG-3',内参照由TaKaRa公司合成,上游引物5'-GCCTCC GGCA GGACCACCGG-3',下游引物 5'-CGGTGAGATCGCG GCCCGCC-3'。
1.2.4 检测结肠癌细胞对CPT-11的敏感性:分别取HCT116及HT29对照组和DAC组对数生长期细胞,将1×104/ml的结肠癌细胞接种于96孔板,24 h后加入不同浓度的CPT-11,同时设阴性对照组和空白对照组。48 h后,每孔加入MTT 150 μl。4 h后离心,弃去液体,每孔加入DMSO 100 μl。10 min后,全自动酶标仪测吸光度A,计算生长抑制率,绘制生长抑制曲线,确定结肠癌细胞不同组别的CPT-11半数抑制浓度(IC50)。
2 结果
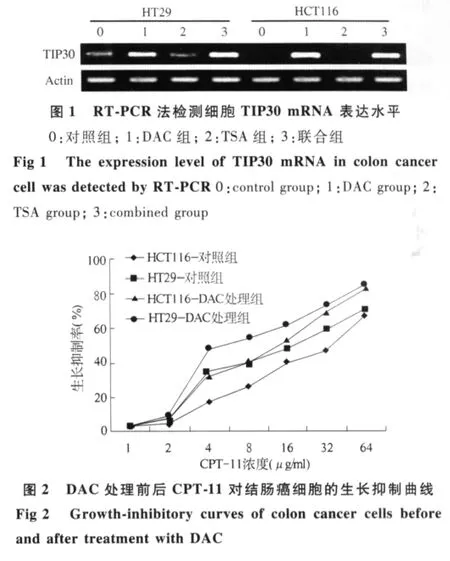
2.1 HT29和HCT116结肠癌细胞经 DAC或/和TSA处理前后TIP30 mRNA在结肠癌细胞中表达水平的变化 RT-PCR结果示:HT29细胞TIP30 mRNA在经药物处理前mRNA低表达,经TSA处理后表达较前无明显变化,经DAC处理后有较强表达,经DAC+TSA处理后与DAC单药干预效果相似。HCT116细胞TIP30 mRNA在经药物处理前mRNA不表达,经TSA处理后仍表达缺失,经DAC处理后由不表达变为较强表达,经DAC+TSA处理后与DAC单药干预效果相似(见图1)。
结肠癌细胞对 CPT-11的敏感性 CPT-11对HCT116及 HT29细胞的生长抑制曲线见图 2。HCT116及HT29细胞的IC50(半效抑制浓度)分别为38.4 μg/ml和 19.6 μg/ml,DAC 处理后分别为 13.1 μg/ml和 5.2 μg/ml。
3 讨论
表观遗传学是基因的DNA序列不发生改变的情况下,基因的表达水平与功能发生改变,并产生可遗传的表型。DNA甲基化和组蛋白乙酰化是哺乳动物最重要的两种表观遗传学调控机制,大量基础研究显示,其在包括结肠癌在内的多种肿瘤病理生理过程中发挥着重要作用[12-14]。
DAC是一种嘧啶类药物,能够通过和DNA甲基转移酶形成复合物抑制其活性,实现去甲基化。TSA则是一种组蛋白去乙酰化转移酶(HDACs)抑制剂,能够抑制 HDACs活性,实现 DNA组蛋白高乙酰化。TIP30基因是近年新发现的一种与肿瘤转移抑制相关的基因。既往研究发现,TIP30基因在包括大肠癌在内的多种肿瘤组织中表达下降或缺失,提示TIP30基因表达与肿瘤发生、发展及预后密切相关。张霞等[8]采用回顾性分析方法,检测了46例结直肠癌中TIP30蛋白及P53蛋白的表达水平,分析研究结果发现癌组织中TIP30蛋白表达水平明显低于癌旁组织,并且表达水平与肿瘤临床分期和侵袭转移有关。Li等[9]用RT-PCR法检测30例结直肠癌、结直肠腺瘤及配对正常肠组织中TIP30基因表达水平,发现TIP30 mRNA的表达率与肿瘤的恶性程度呈反比(正常肠黏膜:96.7%;腺瘤:83%;结直肠癌:23.3%),其表达水平与肿瘤的生长呈反比。进一步研究发现在腺瘤组织及癌组织中,TIP30基因表达水平均与细胞凋亡率呈正相关(r结直肠腺瘤=0.288,t=0.035)。这一研究提示TIP30基因可以通过调节细胞凋亡从而发挥抗肿瘤作用。我们前期研究同样发现[15],人结肠癌组织中抑癌基因TIP30的表达下降与其启动子的高甲基化有关,TIP30启动子甲基化在结肠癌组织里普遍存在,而在正常结肠黏膜组织中则很少出现。TIP30启动子高甲基化与结肠癌淋巴结转移、CEA水平及临床分期呈正相关。
在既往研究的基础上,为了进一步探讨乙酰化在TIP30表达下降中的调控作用,以及其与甲基化是否存在协同作用,我们进行了本研究。结果显示,DAC干预能够逆转TIP30基因启动子甲基化状态,使该基因重新表达或表达增加,而TSA组则效果较差,联合用药与DAC单药干预效果相似,这再次证实在结肠癌HCT116和HT29细胞中导致TIP30沉默的主要原因为DNA甲基化,而乙酰化在沉默TIP30表达方面与去甲基化无明显协同作用。同时,HCT116及HT29对CPT-11的化疗敏感性存在差异,甲基化水平更高的HCT116细胞系与HT29相比CPT-11敏感性更差,经DAC处理后,二者对CPT-11敏感性增加,提示TIP30启动子高甲基化状态不仅是预后的不良指标,更可能是化疗疗效不佳的预测指标。
以上结果提示,结肠癌发病及其药物敏感性不仅与基因突变、基因缺失等经典遗传学有关,还与DNA甲基化等表观遗传学有关。深入研究DNA甲基化与肿瘤预后及疗效预测的关系及作用机制,可能成为结肠癌早期诊断及指导临床决策的依据之一,为个体化治疗提供了可能。然而,这仍有待进一步深入验证,个体化治疗之路,任重而道远。
[1]Center MM,Jemal A,Smith RA,et al.Worldwide variations in colorectal cancer[J].CA Cancer J Clin,2009,59(6):366-378.
[2]Esteller M.Epigenetics in cancer[J].N Engl J Med,2008,358(11):1148-1159.
[3]Choo KB.Epigenetics in disease and cancer[J].Malays J Pathol,2011,33(2):61-70.
[4]Gao T,Wang S,He B,et al.The association of RAS association domain family Protein1A(RASSF1A)methylation states and bladder cancer risk:a systematic review and meta-analysis[J].PLoS One,2012,7(11):e48300.
[5]Zhang QC,Jiang SJ,Zhang S,et al.Histone deacetylase inhibitor trichostatin A enhances anti-tumor effects of docetaxel or erlotinib in A549 cell line [J].Asian Pac J Cancer Prev,2012,13(7):3471-3476.
[6]Chou YW,Chaturvedi NK,Ouyang S,et al.Histone deacetylase inhibitor valproic acid suppresses the growth and increases the androgen responsiveness of prostate cancer cells [J].Cancer Lett,2011,311(2):177-186.
[7]Dong SW,Cui YT,Zhong RR,et al.Decreased expression of retinoblastoma protein-interacting zinc-finger gene 1 in human esophageal squamous cell cancer by DNA methylation[J].Clin Lab,2012,58(1-2):41-51.
[8]Zhang X,Ouyang XN,Li XD,et al.Relationship between TIP30 expression and colon cancer metastasis and prognosis[J].Acad J Sec Mil Med Univ,2005,26(5):488-491.张霞,欧阳学农,李晓冬,等.肠癌组织中TIP30基因的表达与转移、预后间的关系及机制[J].第二军医大学学报,2005,26(5):488-491.
[9]Li X,Zhang Y,Cao S,et al.Reduction of TIP30 correlates with poor prognosis of gastric cancer patients and its restoration drastically inhibits tumor growth and metastasis [J].Int J Cancer,2009,124(3):713-721.
[10]Chen XB,Lv HF,Cao XG,et al.Correlation of the methylation status of CpG islands in the promoter region of TIP30 tumor suppressor gene with the 5-Fu chemosensitivity in colorectal cancer cells[J].Chin J Gastroenterol Hepatol,2012,21(2):133-136.陈小兵,吕慧芳,曹新广,等.TI30基因启动甲基化与大肠癌细胞5-氟尿嘧啶化疗敏感性的关系[J].胃肠病学和肝病学杂志,2012,21(2):133-136.
[11]Chen XB,Ma YJ,Chen BB,et al.Study on correlation of the methylation status of CpG islands in the promoter region of TIP30 tumor suppressor gene with the L-OHP chemosensitivity in 2 colorectal cancer cells[J].China Medicine and Pharmacy,2012,2(4):14-16.陈小兵,马一杰,陈贝贝,等.TIP30基因启动子甲基化与大肠癌细胞奥沙利铂化疗敏感性关系的研究[J].中国医药科学,2012,2(4):14-16.
[12]Pilozzi E,Onelli MR,Ziparo V,et al.CDX1 expression is reduced in colorectal carcinoma and is associated with promoter hypermethylation [J].J Pathol,2004,204(3):289-295.
[13]Yang E,Kang HJ,Koh KH,et al.Frequent inactivation of SPARC by promoter hypermethylation in colon cancers [J].Int J Cancer,2007,121(3):567-575.
[14]Habold C,Poehlmann A,Bajbouj K,et al.Trichostatin A causes p53 to switch oxidative-damaged colorectal cancer cells from cell cycle arrest into apoptosis[J].J Cell Mol Med,2008,12(2):607-621.
[15]Chen X,Cao X,Dong W,et al.Expression of TIP30 tumor suppressor gene is down-regulated in human colorectal carcinoma[J].Dig Dis Sci,2010,55(8):2219-2226.
