紫杉醇脂质体的制备及其表征*
2013-06-07匡长春符旭东
王 薇 ,许 鑫 ,2,胡 戴 ,2,匡长春 ,李 欧 ,2,符旭东
(1.中国人民解放军广州军区武汉总医院药剂科,湖北 武汉 430070;2.湖北中医药大学,湖北 武汉 430065)
紫杉醇(paclitaxel,PTX)是从红豆杉属植物中提取出来的一种高效抗肿瘤活性的天然物质,具有促进微管蛋白聚合、抑制解聚、抑制细胞有丝分裂的作用[1-2],临床主要用于卵巢癌和乳腺癌的治疗。目前临床上使用较多的是紫杉醇注射剂,但注射剂中的溶剂无水乙醇和聚氧乙烯蓖麻油易引起过敏反应,且由于缺乏靶向性,副作用较大[3]。因此,紫杉醇脂质体靶向制剂成为了研究热点。本课题组拟研究具有主动靶向功能的长循环脂质体,在他人研究的基础上,对紫杉醇脂质体的处方和工艺进行了优化,研制出了包封率高、粒径较小、稳定性好的紫杉醇脂质体,以期为后续研究奠定基础。现将紫杉醇脂质体的制备、含量测定方法和特性表征报道如下。
1 仪器与试药
BP211D型电子天平(SARTOTIUS,Amerca);Anke TGL-16G-A型高速冷冻离心机(上海安亭科学仪器厂);RE-52A型旋转蒸发仪(上海亚荣生化仪器厂);KT-300Y型超声波药品处理机;SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂);JY92-2D型超声波细胞粉碎机(宁波新芝生物科技有限公司);Malvern Nano-ZS90激光粒度仪;JEM-2100(HR)透射电子显微镜;Agilent 1100型高效液相色谱仪;透析袋(8000-14000,BIOSHARP);SHZ-82型恒温振荡器(常州国华电器有限公司)。紫杉醇(武汉远城科技发展有限公司,批号为1007001,纯度99.7%);大豆卵磷脂(Sigma);胆固醇(上海伯奥生物科技有限公司);其他试剂均为分析纯。
2 方法与结果
2.1 脂质体制备
精密称取处方量的胆固醇0.5 g、大豆卵磷脂0.5 g、紫杉醇0.01 g,充分溶解于氯仿中,置250 mL的圆底烧瓶中,将烧瓶置旋转蒸发仪中,于40℃水浴下减压旋转45 min,以彻底挥去有机溶剂,用含5% -乳糖的pH=7.4磷酸盐缓冲液(PBS)10 mL水化,探针超声6 min后分别过0.45和0.22 μm的聚碳酸脂膜各3次,即得紫杉醇脂质体溶液。
2.2 含量测定
2.2.1 色谱条件
色谱柱:依利特 C18柱(250 mm ×4.6 mm,5 μm);流动相:甲醇 -水 -乙腈(23∶41∶36);检测波长:227 nm;流速:1.0 mL/min;柱温:25 ℃;进样量:20 μL。
2.2.2 溶液制备
取异丙醇/无水乙醇/无水乙醚[4],按体积比为2∶2∶1,混合均匀,作为破乳剂。精密称取紫杉醇5.0 mg,置10 mL容量瓶中,加适量破乳剂溶解,稀释至刻度,摇匀,得对照品贮备液。精密量取该贮备液2 mL,置10 mL容量瓶中,加破乳剂稀释至刻度,摇匀,即得对照品溶液(紫杉醇质量浓度为100 μg/mL)。精密量取1 mL脂质体,置10 mL容量瓶中,加适量破乳剂溶解,稀释至刻度,摇匀,过滤,取续滤液过0.45 μm微孔滤膜,即得供试品溶液。
2.2.3 方法学考察
专属性试验:取2.2.2项下的紫杉醇对照品溶液,按上述色谱条件注入液相色谱仪;另取处方量辅料,置10 mL容量瓶中,按拟订方法制备空白对照溶液,注入液相色谱仪,分别记录高效液相色谱图(图1),考察系统适用性。结果表明,在该色谱条件下,辅料对紫杉醇的测定无干扰。
线性关系考察:分别精密移取2.2.2项下对照品贮备液0.02,0.1,0.2,0.5,1,2,3,5 mL,置 10 mL 容量瓶中,加入破乳剂定容至刻度,摇匀,分别注入液相色谱仪,按上述色谱条件测定色谱峰面积,以峰面积(A)为纵坐标、质量浓度(C)为横坐标进行线性回归,得回归方程 A=3 933.9 C -919.06,r2=1(n=8)。结果表明,紫杉醇质量浓度在1~250 μg/mL范围内与峰面积线性关系良好。
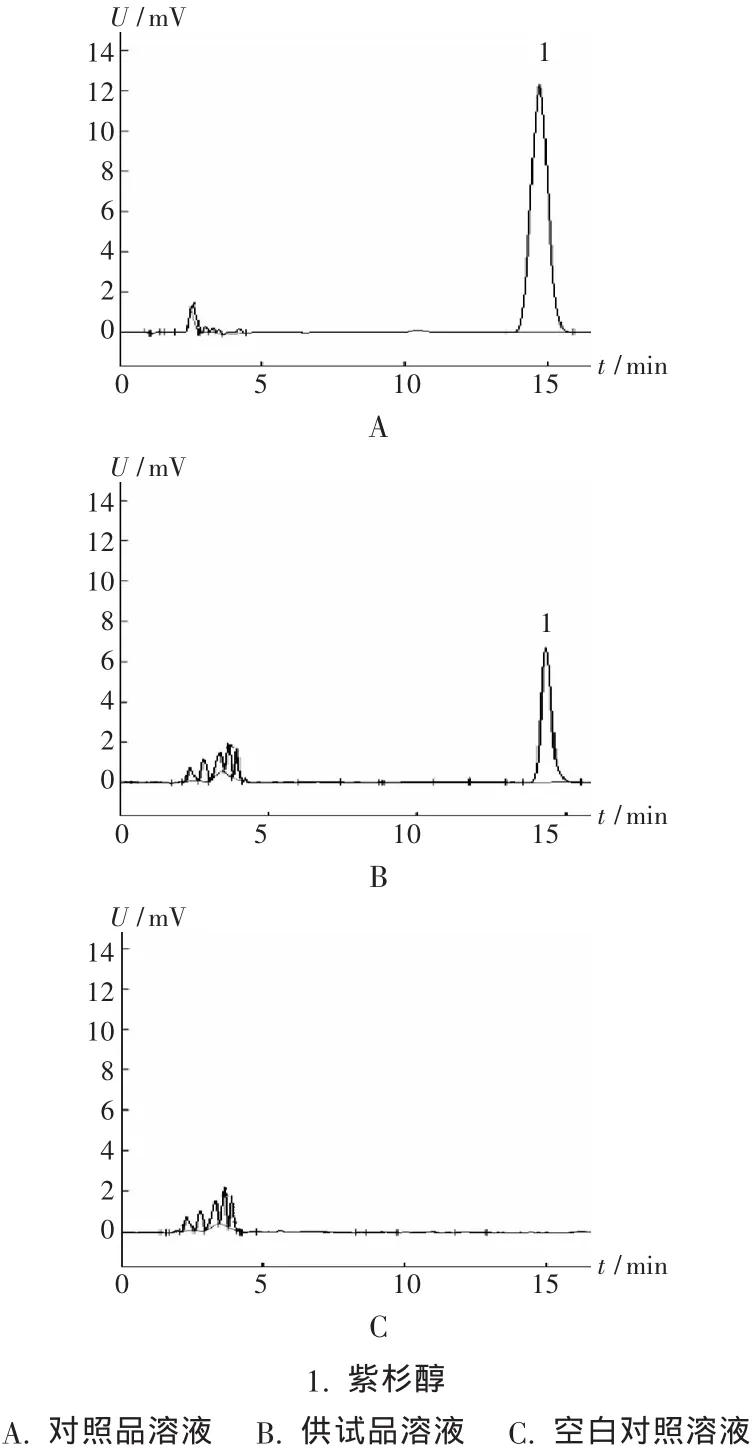
图1 高效液相色谱图
精密度试验:取同一对照品溶液,重复进样6次,按拟订色谱条件测定色谱峰面积。结果 RSD=1.01%,表明方法精密度良好。
稳定性试验:分别取2.2.2项下对照品溶液和供试品溶液,分别于放置 0,3,6,12,24,48 h时注入液相色谱仪,记录峰面积。在上述时间点处的峰面积分别为392 206,392 470,393 450,395 208,394 119,393 417,溶液中紫杉醇的 RSD 为 0.28%,表明对照品溶液和供试品溶液均在48 h内稳定性良好,能满足测量需要。
加样回收试验:精密量取脂质体1 mL,置10 mL容量瓶中,分别加入 0.6,0.45,0.33 mL 对照品贮备液,用破乳剂定容至刻度,摇匀,过滤,取续滤液过0.45 μm微孔滤膜,即得。每份平行操作2次,分别取20 μL注入液相色谱,以峰面积按外标一点法计算回收率。结果见表1。
2.3 紫杉醇脂质体表征考察
2.3.1 粒径分布和电荷
取制备好的紫杉醇脂质体,适当稀释后,用Malvern Nano-ZS90激光粒度仪进行测定,平均粒径在54.6 nm左右,电位-40.9 mV。
2.3.2 形貌观察
取制备好的紫杉醇脂质体,适当稀释后,滴加在有支持膜的专用铜网上,用3%的磷钨酸钠溶液染色后,自然晾干后在透射电镜下观察脂质体形态,见图2。可见,脂质体的形态呈圆形或类圆形。

表1 加样回收试验结果(n=9)

图2 紫杉醇脂质体的外观形态
2.3.3 包封率及载药量测定
按照2010年版《中国药典(二部)》中的相关规定,脂质体包封率=系统中包封药量/系统中包封与未包封总药量×100%。脂质体载药量=药量/脂质体重量×100%。
包封率测定:取1 mL制备好的脂质体溶液,加入3 mL破乳剂后水浴超声15 min,充分破乳后取20 μL进高效液相色谱检测紫杉醇的含量,得到脂质体溶液中总的紫杉醇含量;另取1 mL脂质体溶液,在15 000 r/min离心15 min后取上清液[5],加入3 mL破乳剂后水浴超声15 min,充分破乳后取20 μL进高效液相色谱检测紫杉醇的含量,得到脂质体溶液中被包载的紫杉醇含量。测得试验制备的紫杉醇脂质体的包封率为(97.95±1.32)%,RSD=1.35%(n=8)。
载药量测定:将制备好的脂质体溶液采用低温冷冻干燥的方法冻干得到冻干粉,称取少量的干粉,加入破乳剂/水(3/1,V/V)的混合溶液后水浴超声15 min,充分破乳后取20 μL进高效液相色谱检测紫杉醇的含量;另配置紫杉醇的对照品溶液。计算得紫杉醇脂质体的载药量,试验测得该脂质体的载药量约为2.48%(n=4)。
2.3.4 体外释放度测定
取紫杉醇脂质体溶液2.0 mL,加入透析袋(截留分子量为8 000-14 000)内,两端夹紧后置20 mL的30%乙醇溶液中,于37℃恒温摇床中以100 r/min的速度持续震摇。紫杉醇注射液溶为阳性对照。分别在 0,0.25,0.5,1,2,4,6,8,12,24 h 取出1 mL透析液,同时补充相同体积的释放介质,48 h时取出全部的脂质体溶液,直接破乳计算出紫杉醇的量。采用高效液相色谱测定,计算紫杉醇的释放百分率。释放百分率 F%=At/Ao×100%。其中 F为累积释放度,At为累积释放紫杉醇的量,Ao为加入透析袋中紫杉醇的总量。
2.3.5 稳定性考察
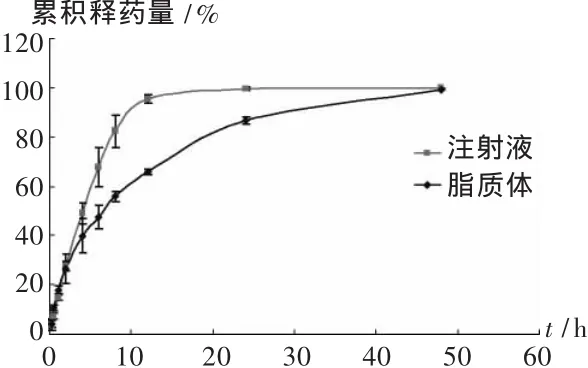
图3 紫杉醇注射液和脂质体的体外释药曲线
将制备好的脂质体分别于4℃和室温(20~25℃)放置,定时观察脂质体溶液的外观变化并测定包封率。结果表明,在4℃条件下放置 0,1,2,3,4 周,包封率分别为 97.77% ,94.49% ,93.72% ,86.84% ,82.35%;室温下放置 0,1,2,4,6 d,包封率分别为 98.76% ,92.33% ,81.27% ,63.91% ,58.78% ,且脂质体溶液发生浑浊,有絮状物出现。由此可见,脂质体溶液应在4℃保存。
3 讨论
本试验采用薄膜分散法制备脂质体,紫杉醇的最终质量浓度为1 g/L,制备的脂质体粒径较小,稳定性好,在4℃条件下存放1个月亦没有药物析出。体外释放结果显示紫杉醇注射液的释放曲线符合零级动力学模式(r2=0.992 1),而脂质体溶液的体外释放曲线符合Higuchi方程(r2=0.991 1),与紫杉醇注射液相比,脂质体具有明显的缓释效果。
迄今脂质体的制备工艺已较成熟,脂质体给药前的粒径成为该制剂应用的较大障碍,如何制备出粒径较小的脂质体及选择合适的冻干保护剂和冻干技术,使脂质体冻干粉在复溶时粒径改变最少,且同时保持脂质体原有的特性,是脂质体类药物必须解决的难题。同时,粒径较大的脂质体容易被网状内皮系统(RES)吞噬,靶向到肝肾等部位,而长循环脂质体通过将亲水性大分子如聚乙二醇(PEG)等镶嵌到脂质体表面,能降低血液成分(主要是网状内皮系统的血浆调理素)对脂质体的识别,以降低脂质体的血液清除率,延长脂质体在血浆中的稳定时间,提高药物的生物利用度[6-7]。本实验室制备的紫杉醇脂质体粒径较小、稳定性好,为后期的长循环脂质体的制备奠定了基础。
[1]Horwitz SB,Lothstein L,Manfredi JJ,et al.Taxol:mechanisms of action and resistance[J].Ann N Y Acad Sci,1986,466:733 - 744.
[2]Perez EA.Microtubule inhibitors:Differentiating tubulin-inhibiting agents based on mechanisms of action,clinical activity,and resistance[J].Mol Cancer Ther,2009,8(8):2 086 - 2 095.
[3]胡 佳.47例紫杉醇注射液过敏反应文献分析[J].中国药业,2012,21(6):53-54.
[4]杨 涛,金大德,崔福德.紫杉醇脂质体药物含量及包封率的测定[J].药物分析杂志,2008,28(2):231-234.
[5]赵 慧,王坚成,罗春蕾,等.多肽GRGDS修饰的紫杉醇长循环靶向脂质体的体外评价[J].中国新药杂志,2008,23(17):2 034-2 038.
[6]Yang C,Liu HZ,Fu ZX,et al.Oxaliplatin long -circulating liposomes improved therapeutic index of colorectal carcinlma[J].BMC Biotechnology,2011,11:21.
[7]Ko YT,Bhattacharya,Bickel U.Liposome encapsulated polyethylenimine/OND polyplexes for brain targeting[J].J Control Release,2009,133(3):230-237.
