小鼠胚胎附植研究现状
2013-06-06吴中红田见晖
陶 俐,苗 凯,安 磊,吴中红,田见晖
(1.吉林农业大学 动物科技学院,吉林 长春 130118;2.中国农业大学 动物科技学院,农业部畜禽遗传育种重点开放实验室,北京 100193)
小鼠胚胎附植研究现状
陶 俐1,2,苗 凯2,安 磊2,吴中红2,田见晖2
(1.吉林农业大学 动物科技学院,吉林 长春 130118;2.中国农业大学 动物科技学院,农业部畜禽遗传育种重点开放实验室,北京 100193)
体外胚胎生产效率低以及胚胎质量不高已成为制约我国人类生殖辅助技术以及畜牧业健康快速发展的重要因素。胚胎在体外环境下发育的基因调控机制及附植前后母胎互作机理不清是其重要原因。因此,对于体外胚胎发育的网络调控及母胎对话分子机制的揭示成为亟待解决的重大科学问题。随着生物技术的发展,应用基因组学、蛋白质组学、表观遗传学等研究手段深入探讨体外胚胎发育的基因网络调控以及表观遗传学修饰机制,解析胚胎与母体子宫对话的分子调节机制成为现在研究的热点。
小鼠;胚胎;附植
E-mail:Eunice8023@yahoo.cn
胚胎附植是哺乳动物繁殖的一个关键环节,附植前后胚胎内部mRNA和蛋白的性质和数量都发生着复杂的变化,这些变化构成了一个庞大而复杂的基因表达调控网络,而母体环境确保了早期胚胎内正常的基因表达网络调控,并确保了胚胎与子宫的识别、信息交流及其在子宫内的定点、适时附植。然而,体外胚胎先天缺失母体环境,常常造成早期胚胎基因表达异常,致使胚胎发育潜力不足和妊娠时母胎对话紊乱,最终影响了胚胎附植[1~4]。例如体外发育技术最为完善的牛,也只有30%~40%成熟卵母细胞体外受精后可发育至囊胚[5]。近年来的研究证实,不同于体内母体环境,体外成熟(IVM)和体外培养(IVC)的环境及条件影响到许多早期胚胎发育相关基因的表达,并影响到了胚胎的发育及附植。例如,文献报道,约30%的体外胚胎犊牛患有巨胎综合症(large offspring syndrome,LOS)是由于体外条件下胚胎发育相关基因表达异常造成的[6]。因此,揭示体外胚胎发育网络调控以及母胎对话分子调节机制成为亟待解决的重大科学问题。
本文综述了利用小鼠模型得出的附植相关早期胚胎发育调控、囊胚附植能力和子宫接受附植能力的研究结果,希望探索母胎对话的神秘机制,为人类生殖健康和临床医学以及畜牧业生产提供理论指导。
1 早期胚胎发育
哺乳动物胚胎附植前经历了受精和第1次卵裂及持续的细胞分裂、细胞全能性的建立及紧缩形成桑葚胚、细胞分化形成囊胚等一系列发育过程(图1)[7],囊胚成熟到一定程度后,从透明带中孵化出来并逐步获得了附植能力。成熟囊胚由滋养外胚层、原始内胚层和多能性内细胞团3种细胞组成,内细胞团分化形成各种胎儿细胞,而滋养外胚层则与母体子宫腔上皮发生生理联系直接参与了附植。
早期胚胎基因表达受多层次调控,主要是转录水平的调控。通过检测胚胎不同发育时期的差异表达基因,可为进一步研究基因表达调控提供依据。2004年,Hamatani等[8]和Wang等[9]分别利用芯片技术系统检测了小鼠体内不同发育阶段早期胚胎基因表达,初步筛选到一大批不同发育阶段差异表达基因。Wang等[10]利用基因芯片检测了体外8个不同发育时期胚胎基因表达情况,并与Wang[9]的体内芯片结果进行比较,试图揭示造成体内外胚胎表型差异的分子机制,但由于其样本含量较小(20个桑椹胚,15个囊胚),结果不理想。Kageyama等利用mRNA扩增系统及基因芯片技术对附植前不同发育阶段胚胎转录调控因子的表达分析发现,转录因子在1-细胞和2-细胞,也就是合子基因组激活(zygotic genome activation,ZGA)时期表达变化较大[11]。Goossens等构建了2-细胞和8-细胞抑制消减杂交文库,并利用实时定量PCR验证了部分差异表达基因,进一步利用免疫荧光标记从蛋白质水平上验证了KRT18,FN1和MYL6三个基因在附植前不同发育阶段胚胎差异表达[12],提出可将这三个基因作为牛囊胚形成的标记基因。
高通量转录谱的对比研究对解析早期胚胎发育的复杂网络调控起到一定积极作用,但这些差异表达基因与不同阶段胚胎差异的关系还需要进一步研究。因此,很多学者通过单个基因过表达或抑制表达研究基因在早期胚胎发育中的功能。Sheth等将紧密连接相关蛋白ZO-1或ZO-2的siRNA显微注射到合子或2-细胞胚胎,延迟了囊胚腔发育[13]。Foygel等利用反义 morpholino寡核苷酸(morpholino oligonucleotide,MO)介导Oct4基因敲降,发现Oct4敲降的胚胎不能发育至囊胚,表明该基因对囊胚的发育至关重要。作者进一步利用芯片技术检测了由Oct4调控的基因表达,初步推测了其在早期胚胎发育中的分子调控网络,在30多个受Oct4调控的基因中,Rest和Mta2在2-细胞阶段受到 Oct4 的严格调控[14]。
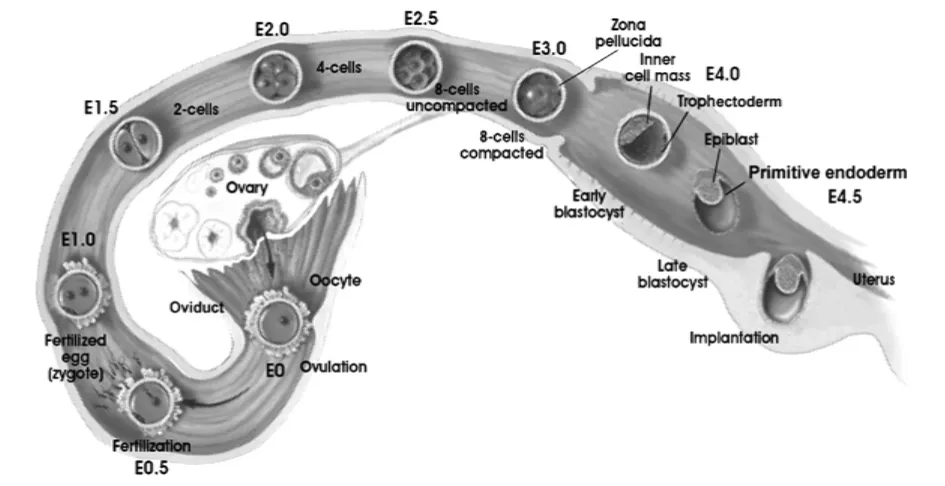
图1 小鼠附植前胚胎发育过程(E0-E5)
2 附植的重要生理过程
早期胚胎发育到囊胚期,进入子宫,开始附植(implantation),这是决定哺乳动物繁殖性状成败的关键一步,附植成功与否,取决于胚胎和子宫两个方面。受精之后,子宫内膜和胚胎均发生了一系列显著的形态学变化,最终子宫内膜高度敏感,具备了接受胚胎粘附和侵入的能力,子宫这一可接受囊胚期胚胎附植的状态称为“植入窗口”,亦即窗口期[15~18]。然而,妊娠第4天(以见栓为第1天,妊娠第4天相当于E3.5,依次类推)摘除小鼠卵巢诱发了延迟植入(delayed implantation),并且将延缓植入的囊胚移植到“植入窗口期”子宫内亦不能附植[19],表明,胚胎植入前还需要经历“激活”过程。同时,对于附植来说,子宫处于窗口期与激活的囊胚两个条件缺一不可。
2.1 附植前后子宫的重要生理变化
大多数哺乳动物,排卵后子宫内膜的腔上皮(luminal epithelium)、腺上皮(glandular epithelium)和基质(stroma)3种组织均发生了明显的细胞增生。子宫内膜细胞尤其是腺上皮的增生方式及程度表现出一定的种间差异[20~23]。以小鼠为例,临近排卵时,腔上皮细胞有丝分裂达到峰值,腺上皮个别细胞出现有丝分裂,而基质细胞则不分裂。排卵及其稍后的时间内,腔上皮、腺上皮和基质均无细胞增生,排卵后3天,腺上皮细胞突然出现有丝分裂峰,腔上皮细胞也出现一个小的增殖峰。第4天,上皮细胞增殖现象急剧减少,而基质细胞有丝分裂增多,并持续至第5天。如果植入失败,子宫内膜细胞有丝分裂维持在低水平,直到下一个周期开始。而灵长类动物,如果植入失败,子宫内膜迅速退化细胞发生凋亡,无植入发生的子宫内膜碎片将以月经的形式排出。但一旦胚胎附着,子宫内膜变化达到极致,对囊胚非常敏感并接受其附着。子宫附植的准备受母体性腺甾类激素(雌激素和孕酮)的调节,按照子宫接受胚胎的能力,子宫可分为接受前期、接受期(即窗口期)和非接受期三个发育阶段(图2),窗口期发生在雌激素峰之后。如果未发生囊胚植入,则子宫进入非接受期。
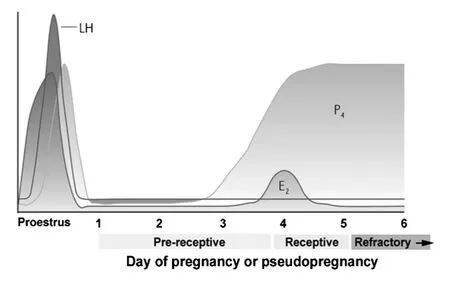
图2 小鼠子宫3个发育阶段
如果囊胚成功植入,子宫内膜基质则发生蜕膜反应(decidualization)。在与胚胎接触的子宫内膜上形成植入小室(implantation chamber)[25]。小鼠妊娠后5~5.5天,子宫系膜对侧的植入小室周围形成初级蜕膜带(primary decidual zone)。初级蜕膜带中的蜕膜细胞分化成伪表皮表型,体积增大,细胞核增多,富含内质网,并形成大量的紧密连接、桥粒连接和缝隙连接[26],当胚胎向系膜对侧延伸时,初级蜕膜带的蜕膜细胞开始从植入小室向外发生凋亡,并被滋养层细胞吞噬。初级蜕膜带形成后不久,系膜侧蜕膜形成系膜极(mesometrial pole)。而系膜极的蜕膜细胞体积较小,只有单个核,细胞间存在大量的缝隙联接和桥粒联接[25]。整个妊娠期间,蜕膜始终存在。
2.2 附植胚胎的重要生理过程
胚胎附植过程可分为胚胎定向期(apposition),附着期(Attachment)和侵入期(Penetration)3个阶段[27]。胚胎附植过程发生在窗口期子宫。
2.2.1 定向期
在小鼠中,由于子宫基质水肿、膨大导致的子宫腔体闭合,或因囊胚体积增大,胚胎滋养层与子宫内膜腔上皮开始接触。由于动物排卵数目和子宫结构不同,胚胎在宫腔相对位置和滋养层与子宫内膜的接触程度存在显著差异,据此,可将胚胎植入分为3个类型:一是中央或表面植入,特点是胚胎体积增大,充满宫腔,滋养层与内膜大面积接触,胚泡不侵入子宫壁内部。代表动物包括食肉类、兔形类和某些灵长类动物;二是偏心植入,胚泡体积小,而宫腔相当大,胚泡深嵌于一侧宫腔上皮的陷凹或腺窝中,胚泡生出微绒毛插入内膜上皮细胞间隙,并侵入内膜基质。许多啮齿类动物的植入属于此类型。三是完全侵入植入,胚泡附着于子宫内膜后,侵蚀内膜上皮,穿透上皮基膜,完全侵入内膜基质当中。胚胎在子宫壁内生长发育。蝙蝠、灵长类中的狭鼻猴、猩猩和人属于这种类型[28]。
2.2.2 附着期
胚胎定位后,子宫内膜上皮和胚胎滋养层接触程度逐步增强。交错排列的滋养层细胞和子宫内膜上皮细胞表面的微绒毛开始发生变化,逐渐变得钝圆而无规则;与此同时,部分细胞质形成球状突起,滋养层细胞与内膜细胞顶部或侧壁形成一些坚实的半桥粒连接或共胞质区,使滋养层与内膜上皮的接触更趋紧密。子宫内膜的上述变化称为粘附反应(attachment reaction)。发生粘附反应同时,子宫内膜的血管通透性增大,胚泡周围的子宫内膜明显水肿。如果给小鼠静脉注射大分子染料Chicago blue B,可在子宫植入位点清楚地观察到染料分子从血管渗出形成的蓝色条带[29](图3)。

图3 静脉注射Chicago blue B后的子宫
2.2.3 侵入期
胚泡粘附后,与子宫内膜联接的滋养外胚层细胞分化成为初级滋养层细胞(primary trophoblast giant cells),并分泌降解子宫内膜基质的蛋白酶,吞噬凋亡的子宫内膜细胞成分,促使胚胎侵入子宫内膜基质[25]。根据滋养层及绒毛膜和子宫内膜的关系,胎盘分为上皮绒毛膜型(epithelio-chorial type)、内皮绒毛膜型(endothelio-chorial type)、血内皮型(haemo-endothelial type)和血绒毛膜型(haemo-chorial type)。除上皮绒毛模型胎盘动物外,其它动物胚胎均需侵入子宫壁,与母体血管建立紧密联系。动物胚胎的侵入方式大体归为以下几类(图4)[15]。

图4 不同物种的胚胎植入方式
3 附植时胚胎-子宫的信号通路
虽然附植不同时期的细胞事件已经比较清楚[15,27],但对于附植过程分子调控机理的研究相对滞后,并且这个非常复杂的过程也存在物种差异,因此在哺乳动物中建立一个统一的模型是不现实的。为深入研究附植机理,有必要搞清哪个信号通路是决定性的,哪个是互补或对抗的,他们之间是如何相互调节的,哪个信号通路在正常妊娠时并无太大作用,而在某些应激情况下是重要的。对这些问题的探究对解决女性生殖健康问题同样有益。
3.1 信号分子
研究显示,白血病抑制因子(leukemia inhibitory factor,LIF)、同源框蛋白Hoxa10、Wnt等局部分泌的信号分子与卵巢释放的激素以自分泌、旁分泌和临分泌的方式介导胚胎和子宫的相互作用。
3.1.1 雌激素和孕酮
卵巢释放的孕酮和雌激素[16]是决定子宫接受能力的重要激素。孕酮对所有哺乳动物附植和妊娠都非常重要,而雌激素却存在种间差异。例如孕酮和雌激素是小鼠和大鼠附植的必要因素,而猪、豚鼠和仓鼠的附植则不需要卵巢分泌的雌激素。虽然小鼠和人雌激素对于附植非常重要,但其在小鼠和人胚胎附植过程中的作用尚不十分清楚[30]。雌激素和孕酮对子宫的影响是通过各自核受体(雌激素受体ER和孕激素受体PR)实现的。选择性删除ER和PR不同亚型的研究显示,Erα-/-子宫发育不全,不能支持附植[31],而Erβ-/-子宫仍然可以发生附植。有趣的是在人工诱导蜕膜化的Erα-/-小鼠模型中,单靠P4就能使子宫发生蜕膜反应,说明ERα对于胚胎粘附可能是必要的,而对于后续的蜕膜化并无作用[32,33]。正常子宫中表达PRA和PRB,缺失PRA和PRB小鼠则表现卵巢和子宫功能异常,进而产生雌性不育[34]。
3.1.2 细胞因子
细胞因子LIF是白细胞介素6家族成员,可与白细胞介素6信号传感器gp130共同结合到LIF受体上,对子宫附植准备非常重要。LIF最先在妊娠第4天的小鼠子宫腺体中表达,然后在附着期囊胚周围的基质细胞中表达[35,36],表明 LIF有起始子宫准备和后续粘附两重功能。Lif-/-小鼠囊胚始终处于休眠期而不能附植。目前仅gp130对LIF功能的必要性得到验证[37],而妊娠过程中LIF行使功能的分子机制尚不清楚。
3.1.3 同源框蛋白
同源框转录因子对于子宫的接受能力和植入非常重要。B型同源框基因Hoxa10和Hoxa11在接受期小鼠子宫基质细胞中表达,并一直持续到附植后的蜕膜化过程,暗示这两种同源框基因在子宫接受期、植入和蜕膜化过程中功能的重叠[38~41]。大多数 Hoxa10-/-雌鼠由于基质细胞增殖的减弱及后续蜕膜化的失败导致不育[38,40]。而 Hoxa10 对于子宫接受能力并非必不可少,因为Hoxa10-/-小鼠囊胚可与子宫发生粘附,而Hoxa10在Lif-/-小鼠中表达正常。相比之下,Hoxa11-/-小鼠子宫发育不正常,腺体较少,比Hoxa10-/-小鼠表型更不正常。更重要的是,Hoxa11-/-小鼠子宫不表达Lif,说明Hoxa11对于子宫接受和后续的植入能力都至关重要[42]。人子宫分泌期Hoxa10和 Hoxa11都上调表达[43]。不同于Hox,Hmx3属于另一同源框基因家族,在子宫肌层表达,基因打靶实验显示,Hmx3-/-小鼠胚胎不能发生附植,原因尚不清楚[44]。同源框基因Msx1仅在接受期子宫上皮中表达,但囊胚粘附期或子宫非接受期不表达[45],Lif-/-小鼠 Msx1的持续表达更证实了其在子宫接受期的重要性。然而,Msx1在接受期人子宫内膜却下调表达[46]。
3.1.4 形成素
妊娠过程中 hedgehog(HH),WNT和BMP(bone-morphogenetic-protein,骨形成蛋白)等形成素备受关注。子宫中Ihh(Indian hedgehog)、Ptc(HH-binding protein/receptor Patched)及转录因子Gli1-3等HH信号通路成员[47,48]参与了子宫接受过程,妊娠第 4天,子宫上皮细胞中Ihh的表达依赖于孕酮,同时基质中 Ptc、Gli1和 Gli2上调表达。WNT4和BMP2则在附植和附植后发挥了重要作用。sfrp4是WNT的拮抗剂,与anti-BMP在接受期子宫基质中表达[49]。Wnt4和Bmp2在这一时期并不表达,而一旦胚胎附着到子宫上,它们都被激活,同时其拮抗剂立即消失[49]。Lif-/-小鼠子宫中 sfrp4显著地下调,说明WNT信号通路成员对于附植前子宫的准备非常重要[45]。Wnt2缺失的小鼠胎出现胎盘缺陷,主要表现为胎盘组织形态异常,包括水肿、组织结构破坏和积血[50]。Wnt7a在成年雌性动物子宫腔上皮表达,其功能的缺失导致生殖道发育的不正常及Hoxa10和Hoxa11的缺失。Wnt7a-/-雌性小鼠子宫缺乏腺体,并且子宫基层组织异常,导致不育,说明Wnt7a对正常构建子宫细胞具有重要作用[51]。
3.2 信号传递方式
妊娠时,子宫和胚胎通过分泌信号分子相互传递信息完成母胎对话,这些信号分子主要通过旁分泌(Paracrine)、临分泌(Juxtacrine)和自分泌(Autocrine)3种方式进行传递。旁分泌的特点是,发出信号的细胞会分泌一种特异分子,通过某些方式传递给受体细胞。信号的发出者和接受者不必接触,但必须是异种细胞。而临分泌中,信号的发出者和接受者相互临近,细胞发出的表面信号分子直接被接受细胞表面的相应受体所识别和接受,类似于抗原-抗体反应,不需要特异的信号传递。自分泌则是细胞分泌的信号分子再传递给自身的一种信息传递方式,一般靠此种方式进行信号放大。
HB-EGF(Heparin binding epidermal growth factor-like growth factor)是已验证的在小鼠胚胎和子宫上皮发生粘附之前表达的基因,并通过旁分泌、临分泌及自分泌方式调节胚胎和子宫的相应生理过程,HB-EGF通路调节机制见图5。

图5 HB-EGF信号通路总览
4 研究胚胎附植的模型
4.1 延迟附植模型
小鼠囊胚一般在妊娠第4.5天进行附植,在妊娠第4天早上(9时)切除卵巢则会导致胚胎进入休眠状态不发生附植,这一状态被称作延迟附植,持续注射孕酮后可维持这一状态,如果给小鼠注射雌激素,胚胎会迅速被激活重新发生附植[53]。正常情况下也会发生延迟附植,例如,小鼠产后排卵并交配,卵子受精发育到囊胚,但由于母鼠处于哺乳期,仔鼠吮吸乳头的刺激使囊胚处于休眠期,直到哺乳期过后才会起始附植。利用基因芯片对休眠期和激活胚胎进行的转录谱分析表明,细胞周期、能量代谢、细胞信号尤其是HB-EGF信号通路等许多功能基因都存在差异表达[54]。
小鼠延迟附植模型对于研究母胎对话机制,分析基因功能非常重要,与胚胎移植等相结合,可以建立“休眠胚胎-体外激活-胚胎移植”模型,从而分析某些物质对于胚胎激活是否有作用。具体而言:利用延迟附植模型获取休眠状态囊胚,用未知功能物质处理胚胎,再将胚胎移植到假孕受体中,如果胚胎发生附植,则说明该未知功能物质可以激活胚胎发生植入(图 6)[54]。
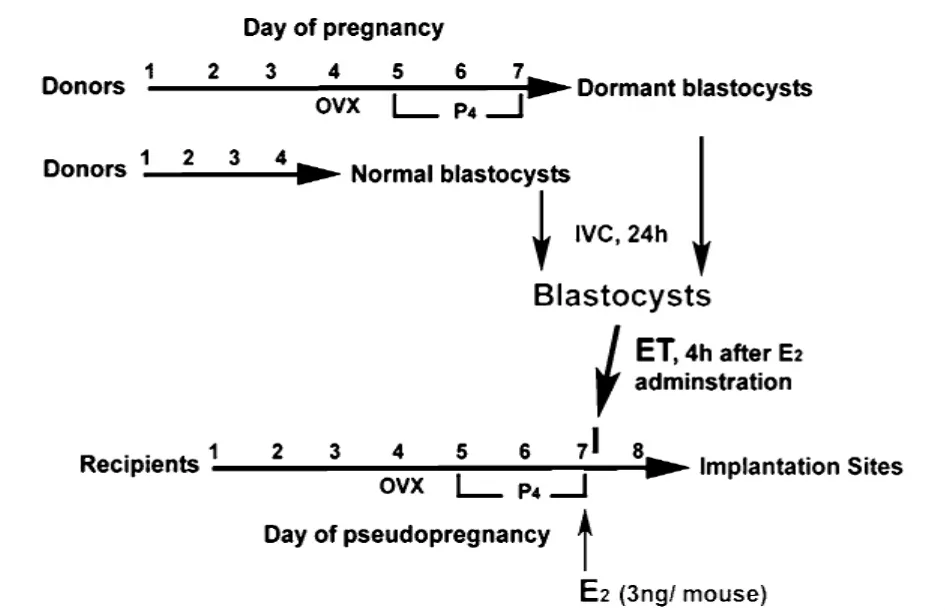
图6 “休眠胚胎-体外激活-胚胎移植”模型
4.2 磁珠模型
母胎对话是诸多基因共同协调进行的结果,很难划分出某一特定基因并对其进行功能研究。Paria等2001年建立的磁珠模型解决了这一问题[49]。Paria首先选取和囊胚直径一样大小的磁珠,然后和纯化的目的蛋白溶液浸润,使蛋白吸附到磁珠之上,在合适的时间将磁珠移植到小鼠子宫中(方法与囊胚移植相同),分析子宫后续的基因表达及组织学变化情况(图7)[17]。该模型可用于研究特定基因(蛋白)在胚胎附植时的功能,而屏蔽了其他因素的干扰,为体内研究通路机制提供了途径。

图7 磁珠移植
4.3 基因敲除模型
基因敲除模型是研究基因功能的一种常规模型。2006年,Wang向转基因小鼠(LacZ ROSA26 reporter mice,带有 LoxP位点的LacZ失活基因)的子宫中注射一定剂量的ADV-Cre(携带Cre重组酶的腺病毒),使子宫中特异组织表达Cre重组酶,从而证明该方法能使子宫特异组织转基因[55]。Qinghua Liu等利用CHK1敲除鼠研究了该基因在围附植期的功能,发现Chk1-/-小鼠发生围附植期胚胎丢失[56]。Yoon Jeon等为研究TopBP1基因功能,构建了条件敲除的TopBP1缺陷小鼠。TopBP1在染色体附植与DNA损伤应答中起重要作用。作者发现TopBP1缺陷的小鼠倾向于在围附植期发生死亡,表明该基因对早期胚胎发育中的细胞增殖起着重要作用[57]。
5 结语
针对胚胎与母体子宫对话分子机制的探索和研究将有助于体外胚胎生产体系的优化和完善,提高体外胚胎妊娠效率,从而减少人工辅助生殖的早期胚胎丢失和后代健康缺陷,改善优良种畜的育种和扩繁效率、促进地方品种和稀缺良种的保种等[1~4]。然而目前为止,利用上述技术对附植过程的认识主要集中在特定的基因或通路。随着基因芯片、转录组测序、蛋白质谱等高通量测序手段的应用,人们可以遴选出更多的候选基因和通路,并研究其在母胎对话和附植过程中的作用。更重要的是,这些高通量技术手段结合生物信息学分析,可以更加完整的描述附植过程中各个基因/蛋白间的协调和互作关系,为母胎对话机制的研究提供详尽的参考。近年来,利用人[58,59]、小鼠[9]、猪[60]、牛[61]、羊[62]等物种的早期胚胎或子宫内膜已经建立了大量的转录组和蛋白质组数据库。此外,近年来,甲基化、miRNA等表观修饰在胚胎附植和母胎对话过程同样扮演着重要的角色。Julie Borgel和 Zachary D.Smith等先后建立了小鼠附植前后胚胎的甲基化组数据库[63,64]。Shi- Jun Hu 和 Ren -Wei Su等分别证实了子宫内膜miRNA的异常表达是导致小鼠胚胎附植延迟的重要原因[65,66]。随着信息分析技术不断发展,将转录组或蛋白质组等基因(蛋白)表达数据与甲基化或miRNA数据进行整合分析,为遴选附植前母胎对话的关键表观因子或位点,真正深入理解调控胚胎附植的分子基础提供了很好的思路。
[1]Fernandez-Gonzalez R,de Dios H J,Lopez-Vidriero I,et al.Analysis of gene transcription alterations at the blastocyst stage related to the long-term consequences of in vitro culture in mice.Reproduction,2009,137(2):271-283.
[2]Fauque P,Mondon F,Letourneur F,et al.In vitro fertilization and embryo culture strongly impact the placental transcriptome in the mouse model.PLoS One,2010,5(2):e9218.
[3]Bauer B K,Isom S C,Spate L D,et al.Transcriptional profiling by deep sequencing identifies differences in mRNA transcript abundance in in vivo-derived versus in vitro - cultured porcine blastocyst stage embryos.Biol Reprod,2010,83(5):791 -798.
[4]Kepkova K V,Vodicka P,Toralova T,et al.Transcriptomic analysis of in vivo and in vitro produced bovine embryos revealed a developmental change in cullin 1 expression during maternal-to-embryonic transition.Theriogenology,2011,75(9):1582-1595.
[5]Wrenzycki C,Herrmann D,Lucas- Hahn A,et al.Gene expression patterns in in vitro-produced and somatic nuclear transfer-derived preimplantation bovine embryos:relationship to the large offspring syndrome?Anim Reprod Sci,2004,82-83:593-603.
[6]Lazzari G,Wrenzycki C,Herrmann D,et al.Cellular and molecular deviations in bovine in vitro-produced embryos are related to the large offspring syndrome.Biol Reprod,2002,67(3):767-775.
[7]National Institutes of Health.Stem Cells:Scientific Progress and Future Research Directions.Stem Cell Information[online],http://stemcells.nih.gov/info/scireport(2001).
[8]Hamatani T,Carter M G,Sharov A A,et al.Dynamics of global gene expression changes during mouse preimplantation development. Dev Cell,2004,6(1):117-131.
[9]Wang Q T,Piotrowska K,Ciemerych M A,et al.A genome-wide study of gene activity reveals developmental signaling pathways in the preimplantation mouse embryo.Dev Cell,2004,6(1):133 -144.
[10]Wang S,Cowan C A,Chipperfield H,et al.Gene expression in the preimplantation embryo:in-vitro developmental changes. Reprod Biomed Online,2005,10(5):607-616.
[11]Kageyama S,Gunji W,Nakasato M,et al.Analysis of transcription factor expression during oogenesis and preimplantation development in mice.Zygote,2007,15(2):117-128.
[12]Goossens K,Van Soom A,Van Poucke M,et al.I-dentification and expression analysis of genes associated with bovine blastocyst formation. BMC Dev Biol,2007,7:64.
[13]Sheth B,Nowak R L,Anderson R,et al.Tight junction protein ZO-2 expression and relative function of ZO-1 and ZO -2 during mouse blastocyst formation.Exp Cell Res,2008,314(18):3356-3368.
[14]Foygel K,Choi B,Jun S,et al.A novel and critical role for Oct4 as a regulator of the maternal-embryonic transition.PLoS One,2008,3(12):e4109.
[15]Carson D D,Bagchi I,Dey S K,et al.Embryo implantation.Dev Biol,2000,223(2):217 -237.
[16]Dey S K,Lim H,Das S K,et al.Molecular cues to implantation.Endocr Rev,2004,25(3):341 -373.
[17]Paria B C,Reese J,Das S K,et al.Deciphering the cross- talk of implantation:advances and challenges.Science,2002,296(5576):2185 -2188.
[18]Red-Horse K,Zhou Y,Genbacev O,et al.Trophoblast differentiation during embryo implantation and formation of the maternal- fetal interface.J Clin Invest,2004,114(6):744 -754.
[19]Paria B C,Huet - Hudson Y M,Dey S K.Blastocyst's state of activity determines the“window”of implantation in the receptive mouse uterus.Proceedings of the National Academy of Sciences,1993,90(21):10159-10162.
[20]Finn C A,Martin L.Patterns of cell division in the mouse uterus during early pregnancy.J Endocrinol,1967,39(4):593-597.
[21]Zhinkin L N,Samoshkina N A.DNA synthesis and cell proliferation during the formation of deciduomata in mice.J Embryol Exp Morphol,1967,17(3):593-605.
[22]Marcus G J.Hormonal control of proliferation in the guinea- pig uterus.J Endocrinol,1974,63(1):89-97.
[23]Marcus G J.Mitosis in the rat uterus during the estrous cycle,early pregnancy,and early pseudopregnancy.Biol Reprod,1974,10(4):447-452.
[24]Wang H,Dey S K.Roadmap to embryo implantation:clues from mouse models.Nat Rev Genet,2006,7(3):185-199.
[25]Welsh A O,Enders A C.Chorioallantoic placenta formation in the rat.III.Granulated cells invade the uterine luminal epithelium at the time of epithelial cell death.Biol Reprod,1993,49(1):38 -57.
[26]Tung H N,Parr M B,Parr E L.The permeability of the primary decidual zone in the rat uterus:an ultrastructural tracer and freeze-fracture study.Biology of Reproduction,1986,35(4):1045-1058.
[27]Enders A C,Schlafke S.A morphological analysis of the early implantation stages in the rat.American Journal of Anatomy,1967,120(2):185 -225.
[28]杨利国.动物繁殖学.第二版.北京:中国农业出版社,2010.
[29]Yoon S J,Choi D H,Lee W S,et al.A molecular basis for embryo apposition at the luminal epithelium.Mol Cell Endocrinol,2004,219(1-2):95-104.
[30]Simon C,Dominguez F,Valbuena D,et al.The role of estrogen in uterine receptivity and blastocyst implantation.Trends Endocrinol Metab,2003,14(5):197-199.
[31]Lubahn D B,Moyer J S,Golding T S,et al.Alteration of reproductive function but not prenatal sexual development after insertional disruption of the mouse estrogen receptor gene.Proc Natl Acad Sci U S A,1993,90(23):11162-11166.
[32]Curtis S W,Clark J,Myers P,et al.Disruption of estrogen signaling does not prevent progesterone action in the estrogen receptor alpha knockout mouse uterus.Proc Natl Acad Sci U S A,1999,96(7):3646-3651.
[33]Paria B C,Tan J,Lubahn D B,et al.Uterine decidual response occurs in estrogen receptor-alpha-deficient mice.Endocrinology,1999,140(6):2704 -2710.
[34]Lydon J P,DeMayo F J,Funk C R,et al.Mice lacking progesterone receptor exhibit pleiotropic reproductive abnormalities.Genes Dev,1995,9(18):2266-2278.
[35]Song H,Lim H,Das S K,et al.Dysregulation of EGF family of growth factors and COX-2 in the uterus during the preattachment and attachment reactions of the blastocyst with the luminal epithelium correlates with implantation failure in LIF-deficient mice.Mol Endocrinol,2000,14(8):1147 -1161.
[36]Stewart C L,Kaspar P,Brunet L J,et al.Blastocyst implantation depends on maternal expression of leukaemia inhibitory factor.Nature,1992,359(6390):76 -79.
[37]Ernst M,Inglese M,Waring P,et al.Defective gp130-mediated signal transducer and activator of transcription(STAT)signaling results in degenerative joint disease,gastrointestinal ulceration,and failure of uterine implantation.J Exp Med,2001,194(2):189-203.
[38]Benson G V,Lim H,Paria B C,et al.Mechanisms of reduced fertility in Hoxa-10 mutant mice:uterine homeosis and loss of maternal Hoxa-10 expression.Development,1996,122(9):2687 -2696.
[39]Hsieh - Li H M,Witte D P,Weinstein M,et al.Hoxa 11 structure,extensive antisense transcription,and function in male and female fertility.Development,1995,121(5):1373 -1385.
[40]Lim H,Ma L,Ma W G,et al.Hoxa-10 regulates uterine stromal cell responsiveness to progesterone during implantation and decidualization in the mouse.Mol Endocrinol,1999,13(6):1005 -1017.
[41]Satokata I,Benson G,Maas R.Sexually dimorphic sterility phenotypes in Hoxa10-deficient mice.Nature,1995,374(6521):460-463.
[42]Gendron R L,Paradis H,Hsieh - Li H M,et al.Abnormal uterine stromal and glandular function associated with maternal reproductive defects in Hoxa-11 null mice.Biol Reprod,1997,56(5):1097 -1105.
[43]Taylor H S,Arici A,Olive D,et al.HOXA10 is expressed in response to sex steroids at the time of implantation in the human endometrium.J Clin Invest,1998,101(7):1379-1384.
[44]Wang W,Van De Water T,Lufkin T.Inner ear and maternal reproductive defects in mice lacking the Hmx3 homeobox gene.Development,1998,125(4):621-634.
[45]Daikoku T,Song H,Guo Y,et al.Uterine Msx-1 and Wnt4 signaling becomes aberrant in mice with the loss of leukemia inhibitory factor or Hoxa-10:evidence for a novel cytokine-homeobox-Wnt signaling in implantation. Mol Endocrinol,2004,18(5):1238-1250.
[46]Riesewijk A,Martin J,van Os R,et al.Gene expression profiling of human endometrial receptivity on days LH+2 versus LH+7 by microarray technology.Mol Hum Reprod,2003,9(5):253-264.
[47]Takamoto N,Zhao B,Tsai S Y,et al.Identification of Indian hedgehog as a progesterone-responsive gene in the murine uterus. Mol Endocrinol,2002,16(10):2338-2348.
[48]Matsumoto H,Zhao X,Das S K,et al.Indian hedgehog as a progesterone-responsive factor mediating epithelial-mesenchymal interactions in the mouse uterus.Dev Biol,2002,245(2):280 -290.
[49]Paria B C,Ma W,Tan J,et al.Cellular and molecular responses of the uterus to embryo implantation can be elicited by locally applied growth factors.Proc Natl Acad Sci U S A,2001,98(3):1047-1052.
[50]Monkley S J,Delaney S J,Pennisi D J,et al.Targeted disruption of the Wnt2 gene results in placentation defects.Development,1996,122(11):3343 -3353.
[51]Parr B A,McMahon A P.Sexually dimorphic development of the mammalian reproductive tract requires Wnt-7a.Nature,1998,395(6703):707 -710.
[52]Lim H J,Dey S K.HB - EGF:a unique mediator of embryo-uterine interactions during implantation.Exp Cell Res,2009,315(4):619 -626.
[53]Yoshinaga K,Adams C E.Delayed implantation in the spayed,progesterone treated adult mouse.J Reprod Fertil,1966,12(3):593 -595.
[54]Hamatani T,Daikoku T,Wang H,et al.Global gene expression analysis identifies molecular pathways distinguishing blastocyst dormancy and activation.Proc Natl Acad Sci U S A,2004,101(28):10326 -10331.
[55]Wang H,Xie H,Zhang H,et al.Conditional gene recombination by adenovirus-driven Cre in the mouse uterus.Genesis,2006,44(2):51 -56.
[56]Sakaki- Yumoto M,Kobayashi C,Sato A,et al.The murine homolog of SALL4,a causative gene in Okihiro syndrome,is essential for embryonic stem cell proliferation,and cooperates with Sall1 in anorectal,heart,brain and kidney development.Development,2006,133(15):3005-3013.
[57]Jeon Y,Ko E,Lee K Y,et al.TopBP1 deficiency causes an early embryonic lethality and induces cellular senescence in primary cells.J Biol Chem,2011,286(7):5414-5422.
[58]Fang H,Yang Y,Li C,et al.Transcriptome analysis of early organogenesis in human embryos.Dev Cell,2010,19(1):174 -184.
[59]Haouzi D,Dechaud H,Assou S,et al.Transcriptome analysis reveals dialogues between human trophectoderm and endometrial cells during the implantation period.Hum Reprod,2011,26(6):1440 -1449.
[60]Samborski A,Graf A,Krebs S,et al.Deep sequencing of the porcine endometrial transcriptome on day 14 of pregnancy.Biol Reprod,2013,88(4):84.
[61]Mansouri - Attia N,Aubert J,Reinaud P,et al.Gene expression profiles of bovine caruncular and intercaruncular endometrium at implantation.Physiol Genomics,2009,39(1):14 -27.
[62]Gray C A,Abbey C A,Beremand P D,et al.Identification of endometrial genes regulated by early pregnancy,progesterone,and interferon tau in the ovine uterus.Biol Reprod,2006,74(2):383 -394.
[63]Borgel J,Guibert S,Li Y,et al.Targets and dynamics of promoter DNA methylation during early mouse development.Nat Genet,2010,42(12):1093 -1100.
[64]Smith Z D,Chan M M,Mikkelsen T S,et al.A unique regulatory phase of DNA methylation in the early mammalian embryo. Nature,2012,484(7394):339-344.
[65]Hu S J,Ren G,Liu J L,et al.MicroRNA expression and regulation in mouse uterus during embryo implantation.J Biol Chem,2008,283(34):23473 -23484.
[66]Su R W,Lei W,Liu J L,et al.The integrative analysis of microRNA and mRNA expression in mouse uterus under delayed implantation and activation.PLoS One,2010,5(11):e15513.
S814.3
A
1005-2739(2013)03-0003-10
2013-03-19
陶俐 (1989-),在读硕士研究生,专业方向:动物遗传育种与繁殖。
