无血清培养基悬浮培养BHK21细胞驯化的研究
2013-06-05井莲娜付智财黄炯
井莲娜,付智财,黄炯
(1.新疆天康畜牧生物技术股份有限公司,新疆 乌鲁木齐830011)
(2.新疆畜牧科学院兽医研究所,新疆 乌鲁木齐830000)
无血清培养基悬浮培养BHK21细胞驯化的研究
井莲娜1,付智财1,黄炯2
(1.新疆天康畜牧生物技术股份有限公司,新疆 乌鲁木齐830011)
(2.新疆畜牧科学院兽医研究所,新疆 乌鲁木齐830000)
本研究主要探索用常规BHK21贴壁细胞(F38)驯化为适应无血清培养基的全悬浮细胞的过程并使用生物反应器放大进行了相关研究。实验表明:常规BHK21细胞通过运用相应的商品化培养基进行低血清贴壁驯化、再到低血清全悬浮驯化、最后到无血清全悬浮驯化,使细胞达到全悬浮的状态。经过四十代的传代后,细胞在无血清悬浮培养基中生长细胞数量可达3.0×106/mL以上,且形态较好,倍增时间稳定,活力在90%以上。实验中采用速降和缓降两种方法进行过渡驯化,结果表明,在贴壁状态下,细胞对缓降方式比速降方式适应性要好,细胞的形态较好,活力在90%以上。细胞从低血清悬浮到无血清悬浮过程中,两种过渡方式无明显差异,均经过了5~10代驯化,细胞就完全适应了无血清悬浮培养基。无血清悬浮细胞从液氮中复苏后,采用直线放大的形式从1.5 mL到250 mL再到5 L反应器最后到650 L反应器中生长。在培养参数方面进行了摸索,最终验证用直线放大的方法是可行的。细胞数量可达4.5×106/mL左右,细胞活力在90%以上,且细胞在放大过程中,形态良好,倍增时间稳定在18 h。
无血清悬浮培养;BHK21;驯化
口蹄疫(FMD)是哺乳动物的高度接触性传染病,该病对易感动物具有严重的潜在危害,可造成巨大的经济损失。高效、安全、稳定的病毒性疫苗是防止口蹄疫疫情发生最有效的方法。因此,对改进生产工艺、提高疫苗质量提出了更高的要求。
细胞悬浮培养技术是指细胞在生物反应器中自由悬浮于培养液内生长增殖的一种培养方法。悬浮细胞的驯化是口蹄疫悬浮培养工艺中最关键的技术之一。而细胞筛选驯化的实质是应用现代细胞生物学技术,在降低细胞凋亡率、提高细胞活力、延长细胞生命周期、提高产物尝试等方面进行研究,结合特定细胞的营养需求进行培养基优化,筛选适用于生产的细胞株[1]。本文结合实际生产需要,从常规生产细胞株中筛选出合适的细胞株,进行生物反应器的放大培养,为工艺的改革与提升提供了可靠的依据。
1 材料与方法
1.1 驯化用细胞
BHK21贴壁细胞株来自新疆天康畜牧生物技术股份有限公司种子细胞库。
1.2 培养基
低血清贴壁培养基和低血清悬浮培养基来自北京清大天一公司;无血清全悬浮培养基来自兰州百灵生物技术股份有限公司;新生牛血清来自兰州民海生物。
1.3 主要实验器材
倒置显微镜(OLYMPOS,CKX41),移液器(Thermo F2),250 mL摇瓶(进口产品),摇床,血细胞计数板等,均为国产产品。
1.4 实验方法
细胞驯化分为三个阶段,即贴壁阶段,细胞培养时血清量添加从10%下降至3%~5%;贴壁转悬浮阶段,细胞培养从低血清贴壁状态经处理转为低血清悬浮培养状态;低血清悬浮阶段转至无血清悬浮阶段,悬浮细胞培养时更换无血清培养基,使细胞适应无血清悬浮培养基。在以上三个阶段,分别采用迅速下降和缓慢下降的方法进行细胞培养,观察细胞适应情况。
1.4.1 贴壁阶段的驯化
1.4.1.1 快速降低血清含量从液氮中复苏一支常规贴壁细胞,转移至方瓶中进行培养,细胞形态及生长速度恢复正常。用含有0.25%胰蛋白酶-0.02%的EDTA消化液将细胞进行分离,500~1 000 rad/min离心,使用低血清贴壁培养基重新混合均匀,以30~50万/mL进行传代培养驯化。血清含量从10%、8%、5%降至3%,每个含量传一代,就过渡到下一个血清含量。观察细胞的生长情况。
1.4.1.2 缓慢降低血清含量细胞准备同方法1。待细胞在10%血清中稳定传代三代后,转到下一个血清含量。观察细胞的生长情况。
1.4.2 细胞从贴壁转向全悬浮状态的驯化
按上述方法将细胞进行分散离心,加入含5%低血清悬浮培养液将细胞重悬为细胞液,按30~60万/mL的接种密度接种于250 mL三角瓶内,置于37℃,105 rad/min在摇床内进行培养。观察细胞的增殖与活力情况。细胞计数采用台盼兰血细胞计数板计数法进行。
1.4.3 低血清悬浮细胞转向无血清悬浮细胞的驯化
准备生长良好的低血清悬浮细胞,经500~1 000 rad/min进行离心,按30~50万/mL加入100%低血清悬浮培养液,培养三代后,按同样方法,更换第二种培养液,以此方法进行悬浮细胞传代培养。细胞培养48 h后,进行计数。观察细胞数量及细胞活力的变化。
1.4.3.1 快速过渡的方法。本方法是分三步将悬浮细胞所用的培养基从低血清悬浮培养基过渡到无血清悬浮培养的方法,即100%低血清悬浮培养液、50%低血清悬浮培养液+50%无血清悬浮培养液、100%无血清悬浮培养液,悬浮细胞在每一种培养液中培养三代,观察细胞生长情况。
1.4.3.2 缓慢过渡的方法。本方法是分五步将悬浮细胞所用的培养基从低血清悬浮培养基过渡到无血清悬浮培养基的方法,即100%低血清悬浮培养液、75%低血清悬浮培养液+25%无血清悬浮液、50%低血清悬浮培养液+50%无血清悬浮培养液、25%低血清悬浮液+75%无血清悬浮液、100%无血清悬浮培养液。细胞传代方法同上。
1.4.4 无血清悬浮细胞在生物反应器中放大的摸索实验
用常规方法从液氮中复苏无血清悬浮细胞,经500~1 000 rad/min进行离心,加入无血清悬浮培养液,并将细胞密度调整为30~60万/mL。将细胞液100 mL加入到250 mL三角瓶内,置于37℃,105 rad/min在摇床内进行培养。细胞生长到300万/mL以上即可进行传代培养,以此方法进行放大培养。待细胞培养体积达到300 mL时,可以将悬浮细胞转至5 L生物反应器中进行培养。依此将细胞转入5 L、50 L、100 L、650 L生物反应器中,摸索细胞生长的最佳条件。本实验主要验证两个参数(DO、pH),将pH分别设定为7.0和7.25,DO设定为30%、80%,观察在两种情况下无血清悬浮细胞在生物反应器中的增殖情况。
2 结果
2.1贴壁细胞从高血清降至低血清实验结果
贴壁细胞从10%血清降至3%血清过程中,快速降低培养液中血清含量时,细胞表现不适应。表现为:细胞贴壁速度较慢,有大量的细胞漂浮在培养液中,培养液pH偏高,48 h仅长满90%;相反,在缓慢降低培养液中血清含量时,细胞适应较好,从10%降至5%的过程中,传代三代后细胞生长状态与常规细胞基本一致。从5%降至3%的过程中,传第一代时,培养液中有少量漂浮细胞,但不影响贴壁与生长,细胞传三代后可按常规方法进行分瓶传代。因此,贴壁细胞在降低血清含量过程中宜采用缓慢降低的方法进行驯化。见表1。
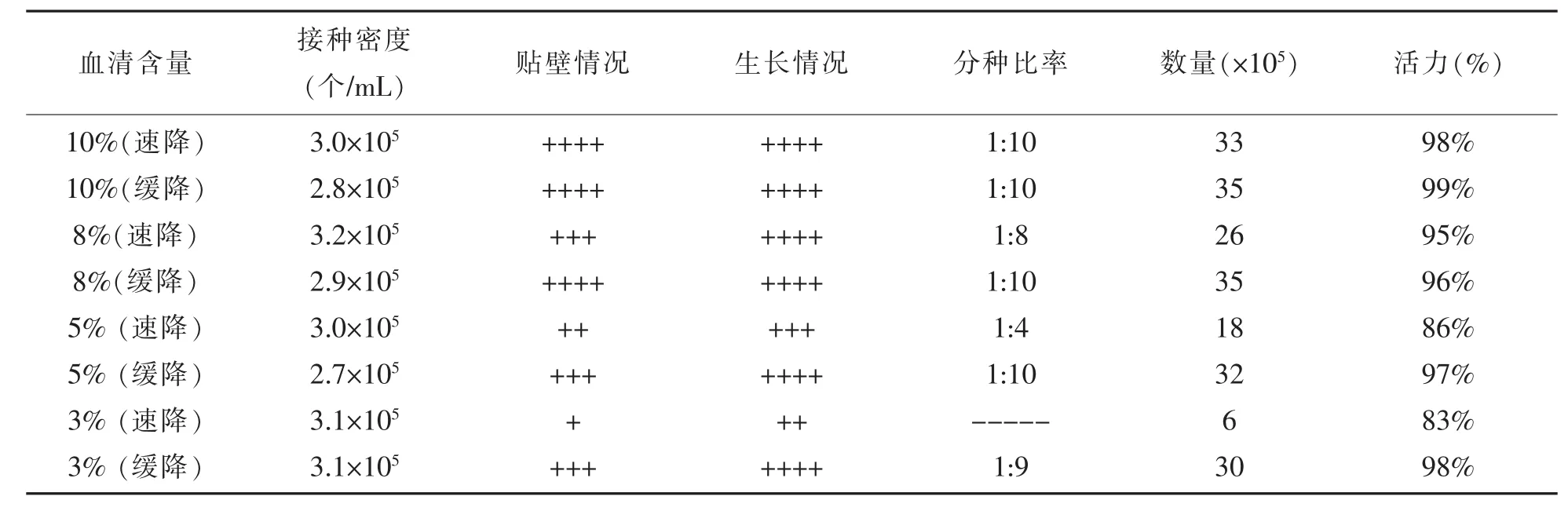
表1 贴壁细胞从高血清降至低血清实验结果
2.2 悬浮细胞过渡实验结果
悬浮细胞在培养基过渡时,分别采用缓慢过渡和快速过渡。实验证明两种过渡方式对细胞数量的增长和活力无明显的差异。结果见表2。
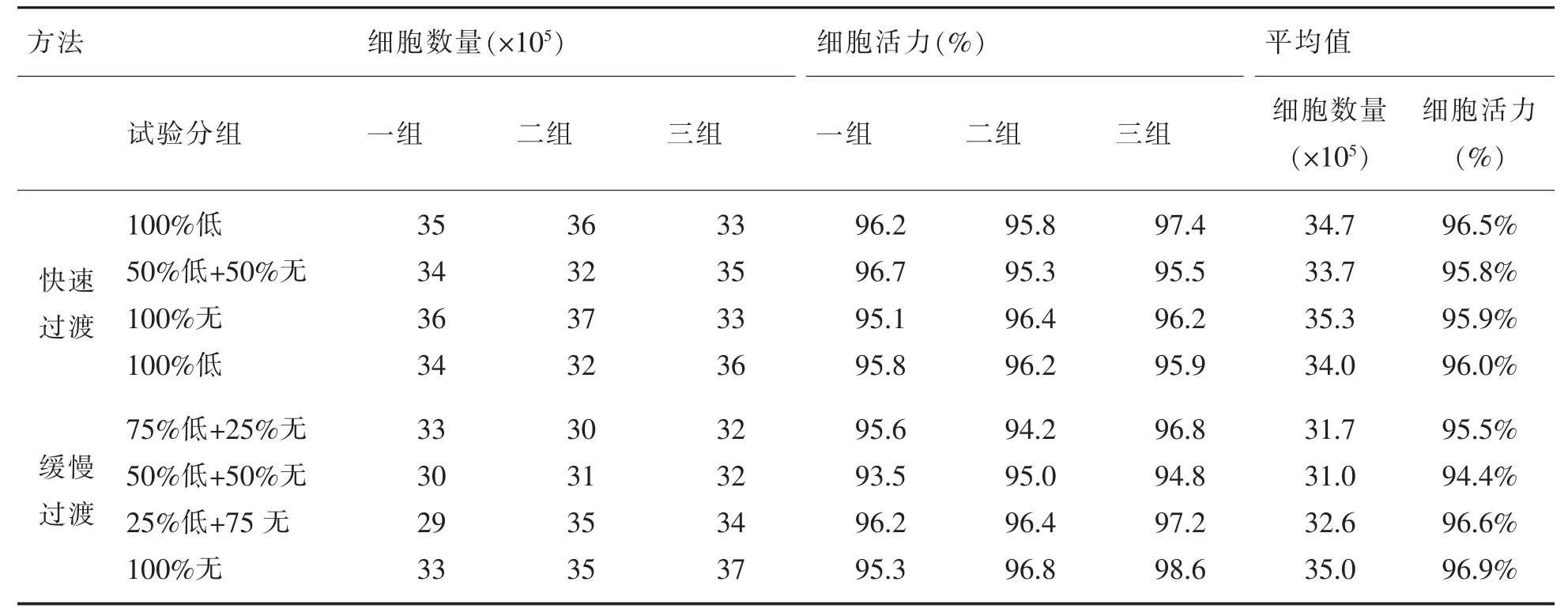
表2 悬浮细胞驯化过渡试验结果
2.3 细胞在悬浮状态时的驯化结果
细胞从贴壁转到悬浮状态时,在前10代内,细胞结团较严重,在培养的24 h和48 h都要进行消化离心处理。从第11代开始悬起来的细胞数量开始增多,细胞倍增时间在24 h。从第18代开始细胞数量断续增加,细胞倍增时间开始缩短。驯化至30代时,细胞倍增时间基本稳定在18~20 h,细胞形态均一。此时,细胞形态及增长速度达到了悬浮细胞的基本要求。(见图1、2、3、4)
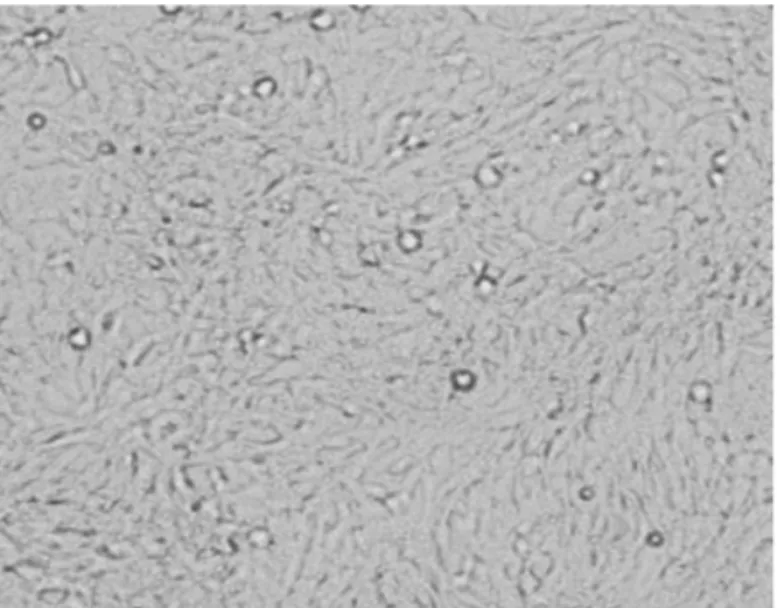
图1 常规BHK21细胞
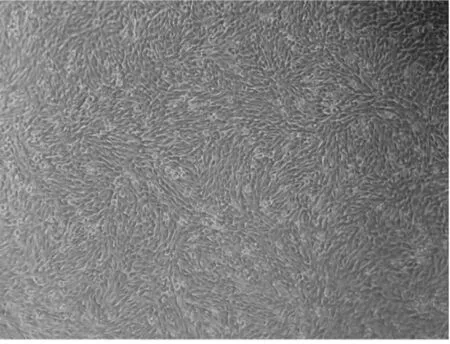
图2 低血清贴壁细胞

图3 低血清悬浮细胞
图4 无血清悬浮细胞
2.4 悬浮细胞在反应器中的驯化结果
根据设定的参数,悬浮细胞通过流加培养的方式在反应器中生长。试验结果表明,悬浮细胞的数量和活力基本一致,各反应器之间没有明显差异。另外,从试验中还可看出,驯化的悬浮细胞在反应器中生长时,pH在7.2~7.3之间,DO在30%和80%时细胞生长均适宜。细胞在反应器中生长要比在摇瓶中生长数量要高,最高可达4.6×106/mL,形态也较为理想。实验结果见表3。
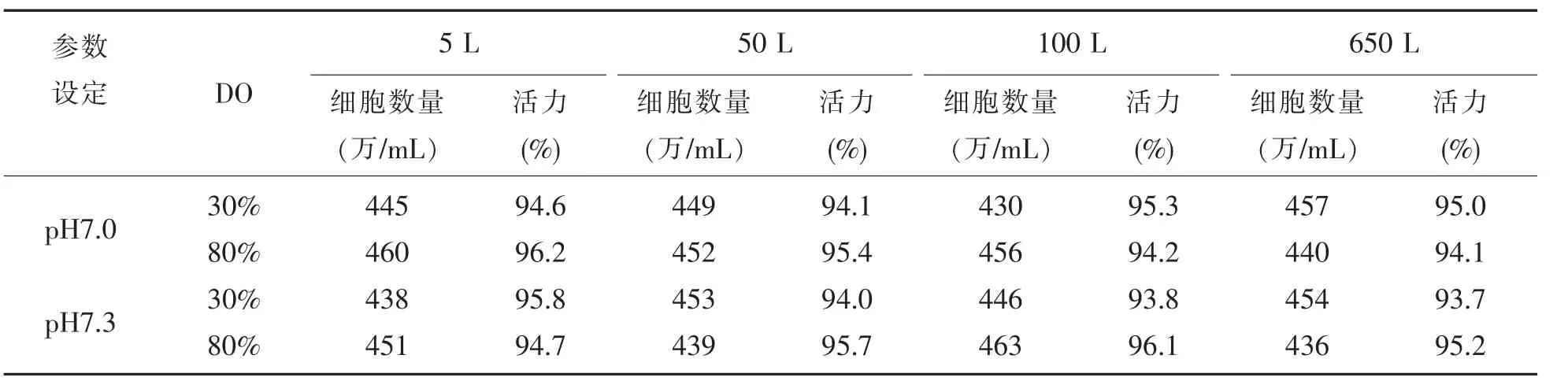
表3 悬浮细胞在各反应器中生长试验结果
从细胞驯化的过程中可以看出,该支细胞在贴壁阶段血清含量从10%降至3%经过12代的驯化,细胞数量及活力均能达到实验要求。而从贴壁到悬浮这个过程,则通过20代的驯化培养,细胞才能适应悬浮的状态,并且能稳定增殖到3.5×106/mL。从低血清向无血清过渡时,只需要3~5代就可过渡,且细胞在无血清培养基中增殖稳定,细胞活力也在90%以上。在条件合适时,通过这种方法可以将BHK21贴壁细胞驯化为悬浮细胞。整个驯化结果见表4。
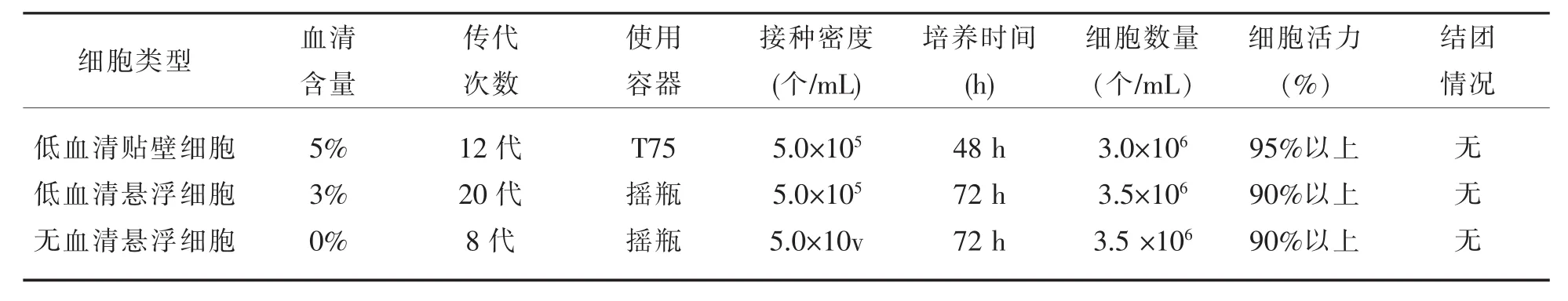
表4 悬浮细胞驯化结果
3 讨论与分析
在悬浮细胞驯化过程中,要考虑多种因素。首先细胞从贴壁到悬浮,细胞改变了存在的形态,此时细胞的非常重要。需要做大量的工作从大量常规传代的细胞中选择出适合驯化的细胞。其次,为实现驯化的稳定,在驯化过程中应控制好参数。如驯化时细胞活力应保持在90%以上;保持细胞的表达特性不发生变化;驯化后细胞的增殖能力、活力及生产能力要能够满足大规模生产的需要等等。最后一点也是最重要的一种因素,是要有合适的悬浮培养基。目前,在国外悬浮培养基已经是较为成熟的产品,各疫苗生产厂家加强与研发单位的合作,主要是通过合同制造外包(CMO)和合同研发外包(CRO),有针对性的开发出适合的培养基进行疫苗生产[2]。在国内,悬浮培养基大多数仍处于实验室阶段,商品化悬浮培养基刚刚起步。对于无血清全悬浮技术的成熟,还需要整合行业内各方力量,共同完成。
有研究表明,悬浮细胞的接种密度在小于1.0×105和大于1.0×106时,细胞的倍增时间达不到18~20 h,会延长至24 h甚至更长[3]。因此,在驯化过程中要严格控制细胞数量。另外,在驯化过程中要注意保留各阶段驯化细胞种子,可避免在驯化过程中浪费大量的时间做重复工作。
悬浮细胞处于悬浮状态时,无论是以哪一种培养方式,气升式或是搅拌式进行培养,在培养基中都要加入抗剪切保护剂如Pluronic F-68,对细胞进行保护,以达到高密度培养[4]。此时,病毒对细胞的敏感性,就要做更加深入的研究。有研究表明,细胞在无血清全悬浮培养基中生长,数量可达8×106个/mL,细胞活力均可在90%以上。要使病毒在如此高密度的细胞中培养进行病毒的增殖,就需要考虑病毒对细胞的敏感性。众所周知,病毒对细胞的敏感性是定向选择的。同一种病毒对同一细胞的不同克隆株的敏感性不同,同一细胞所处外环境不同,同一病毒的敏感性也会有所差异[5]。因此,当BHK21细胞分别处于贴壁和悬浮状态时,口蹄疫病毒的敏感性也会有所变化,可以通过传代驯化的方式,使病毒逐步适应,最终满足生产需求。
无血清悬浮培养工艺的放大及优化还有待进一步实践。无血清悬浮培养工艺在放大的过程中,涉及到生物反应器的控制。国内生物反应器市场还处于起步阶段,反应器的设计、安装、调试应有相应的技术平台为支撑,以此来加快生物反应器市场成熟的进程,降低生产成本,提高生产竞争力。
无血清悬浮工艺的优化还有待更深入的研究。如反应器深层通汽的研究、无血清悬浮细胞培养的控制以及口蹄疫各种毒型对该细胞的适应性、病毒的高效表达与疫苗免疫之间的关系、生物反应器放大过程中各参数的控制等等,都需要更加细致的研究工作。这些也是以后研究的方向。
[1]李荣.悬浮培养在口蹄疫疫苗中的应用.[J].中国兽药杂志,2011,45(7):14~16.
[2]陈文庆,王建超,刘华杰,高飞,张韧.悬浮培养教育工艺与转瓶培养工艺的比较分析[J].中国兽药杂志,2010,44(10):37-41.
[3]薛英,王延,王玉红,等.BHK-21细胞的悬浮驯化及其在悬培条件下对口蹄疫A型病毒的培养[J].广东畜牧兽医科技,2008,33(1):35-37.
[4]Wei M,Qi R,Zhang Y,Yu J.Combined effects of polyethylene glycol and Pluronic F68 on the growth of hybridoma cells and protection to cells from damage of bubble in serum free medium.In:Funatsu K. Animal Cell TECHNOLOGY:Basic and Applied Aspects.Vol8.The Netherland:Kluwer Academic Publishers,1997,155-159
The Study on BHK21 Cells Domesticated by Serum-Free Medium Suspension Culture
JIN Lian-na1,FU Zhi-cai1,HUANG Jong2
(1.Xinjiang Tiankang Animal Husbandry biotechnology limited liability Company,Urumqi 830011,China;2.Institute of Veterinary Science,Xinjiang Academy of Animal Scince,Urumqi 830000,China)
In this research,BHK21 cells(F38)was domesticated with serum-free medium and could be in suspended state and at the same time,used biological reactor amplifier doing some experiments.The results showed that the usual BHK21 cells was slowly becoming suspended cell through low serum adherence cell culture,low serum suspended cell culture,and serum-free suspended cell culture.Cells number can reach over 3.0×106/ml in serum-free suspended medium and these cells have good forms,stabilizing doubling time, and more than 90%cell vitality.The fast drop and slow drop was adopted to domesticate in this research.The results showed that in adherence state,the cells adapted better to slow drop than fast drop.The cells showed good forms and high cell vitality.But in the suspended state,two methods have no obvious differences,and after 5-10 generations suspended cell culture,cells can adapt to the suspension culture medium.Serum-free suspended cells were recovered from liquid nitrogen.The volume of cell culture was added from 1.5ml to 250ml to 5L to 650L using the linear amplification form.Through researching related culture parameter,the researcher have found that this method was practicable.The cell mumble can reach 4.5×106/ml and the cells vitality was more than 90%and have good forms,stable doubling time(in 18h).
serum-free suspension culture;BHK21 cells;domesticationinternational PVP.
S852.5
A
1003-6377(2013)03-0051-06
2013-01-08
井莲娜(1979-),女,兽医硕士,从事口蹄疫疫苗生产工作。
