超声心动图评价慢性肺动脉高压猪心室形态变化与肺动脉压的关系
2013-06-05郭丽萍,吴棘,郑宝石
左向右分流型先天性心脏病引起高肺血流量所致肺动脉高压是临床研究的热点和难点。建立左向右分流慢性肺动脉高压动物模型,有助于提高临床对左向右分流型先天性心脏病所致肺动脉高压的诊治水平[1,2]。实验性肺动脉高压的评估常需应用右心导管技术,但肺动脉测压后易致实验动物死亡,不利于动态观察[3]。彩色多普勒超声已广泛运用于监测肺动脉压[4],但对于心室形态变化与肺动脉压关系的研究较少。本实验以小型巴马幼猪为实验对象,采用颈动-静脉吻合术建立慢性肺动脉高压模型,探讨心室形态参数变化与肺动脉压的关系及心室形态参数变化反映肺动脉压变化的可行性,为临床肺动脉高压的超声评价提供实验依据。
1 材料与方法
1.1 实验动物 1月龄小型巴马幼猪36只(购自广西巴马县畜牧场),体重6~8 kg,饲养环境清洁,符合动物检验检疫标准。按完全随机区组设计法分为实验组(30只)与假手术组(6只)。以专用饲料喂养实验猪,未添加任何可能影响实验结果的药物或试剂。以建模成功后存活1年以上为满足观察条件。
1.2 动物模型建立 实验组30只猪麻醉后,于左颈部作一长约4 cm切口,分离组织暴露左侧颈外静脉,耳缘静脉注射肝素钠1 mg/kg抗凝。游离左侧颈总动脉,以小血管夹阻断其近心端血流。于颈内、外动脉分叉处下方0.5~1.0 cm处结扎并斜行切断左颈总动脉。用小血管夹阻断左侧颈外静脉近心端血流,于颈外静脉内侧适当位置作一约6 mm切口,在显微镜下使用7-0 Prolene线行颈动-静脉端侧吻合。先后松开颈外静脉和颈总动脉近心端的血管夹,如发现颈外静脉近心端充盈并出现搏动,证实吻合口通畅良好。假手术组6只,除未行左颈动-静脉吻合术外,其余外科操作步骤同实验组。术后1年观察猪的生长发育情况,每隔2个月称体重(BW),测量身体长度,利用超声仪自动计算体表面积(BSA)。
1.3 超声仪器 采用Philips iE33彩色多普勒超声诊断仪,二维探头:S5-1相控探头,频率1.7~3.4 MHz;L11-3高频探头,频率4.0~8.0 MHz;三维探头:X3-1矩阵探头,频率1.9~3.8 MHz。
1.4 超声检查 术后采用高频超声检查吻合口通畅情况。所有猪均于术前及术后每2个月进行检查,连续观察1年。二维超声(2DE):测量主肺动脉内径、右心室舒张末期横径、长径、右心室壁厚度。标准心尖四腔心切面:手动勾画出右心室舒张末期面积(RVAd)、收缩末期面积(RVAs),并计算出右心室面积变化率(RVFAC):RVFAC=(RVAd-RVAs)/RVAd×100%。于胸骨旁乳头肌水平观察左心室短轴切面:分别于舒张末期、收缩末期测量经过室间隔中点并垂直于室间隔的左心室内径(D1)和垂直于D1的左心室内径(D2),分别计算出舒张末期、收缩末期左心室偏心指数(LVEId、LVEIs、),LVEI=D2/D1。测量三尖瓣反流(TR)、肺动脉瓣反流(PR)压差,估测肺动脉收缩压(SPAP)及平均压(MPAP):SPAP=三尖瓣反流压差+右心房压(5~15 mmHg),一般设定为10 mmHg;MPAP=肺动脉瓣反流压差+右心室舒张末压(右心房压)。以SPAP>30 mmHg或MPAP>25 mmHg为肺动脉高压形成标准。实时三维超声清晰显示标准心尖四腔心切面时采集获取全容积成像数据库,调节失状切面和冠状切面位于右心室正中,横切面位于右心室瓣环水平,分别于舒张末期、收缩末期描记心内膜面3个参考点的位置,软件自动勾画出心内膜边界,自动计算出右心室射血分数(RVEF)。
1.5 统计学方法 采用SPSS 17.0软件,计量资料行球形检验(Mauchly's test of sphericity),满足sphericity假设时,采用重复测量数据的方差分析;不满足sphericity假设时,用Huynh-Feldtε校正系数校正自由度。RVFAC、LVEIs、LVEId与SPAP、MPAP的相关性采用偏相关分析,P<0.05表示差异有统计学意义。
2 结果
2.1 建模情况 实验组30只小猪中,3只术中麻醉意外死亡,3只术后1~2 d切口感染死亡,其余24只猪术后3 d食欲及精神状态逐渐恢复正常,无呼吸困难及活动减少表现;实验组2只猪于术后4个月因感染其他疾病腹泻死亡,3只猪分别于术后6、7个月食欲不振、逐渐消瘦死亡;19只猪存活至建模术后1年以上。高频超声监测左颈动-静脉吻合口通畅情况:3只于术后2个月探查发现吻合口阻塞;1只吻合口重度狭窄,未能形成有效的左向右分流;15只吻合口通畅,形成左向右分流,建模成功率为50%(15/30)。假手术组6只猪均存活1年以上。实验组15只成模猪及假手术组6只猪在观察过程中体重及体表面积逐渐增大,组内不同时点比较,差异有统计学意义(P<0.05),术后8、10、12个月实验组15只成模猪BSA小于假手术组,差异有统计学意义(P<0.05),见表1。
2.2 超声观察结果 所有猪均获得较满意的超声图像。随着术后观察时间延长,实验组成模猪SPAP及MPAP逐渐升高,于术后4个月形成肺动脉高压,术后2个月主肺动脉内径、右心室各径线开始逐渐增大,右心室壁逐渐增厚,经BSA校正后,组内不同观察点间及与假手术组比较,差异均有统计学意义(P<0.05),但实验组成模猪术后2个月RVFAC、LVEIs较术前及假手术组差异无统计学意义(P>0.05)(图1)。随着SPAP及MPAP逐渐升高,RVEF逐渐降低,RVFAC逐渐减小,LVEIs逐渐增大(图2),术后4个月后,任意两观察点间RVFAC、LVEIs比较,差异有统计学意义(P<0.05),且均大于假手术组(P<0.05);LVEId于术后2个月开始增大,但术后10个月与12个月比较,差异无统计学意义(P>0.05)。假手术组各形态指标经BSA矫正后差异无统计学意义(P>0.05)。见表2、3。
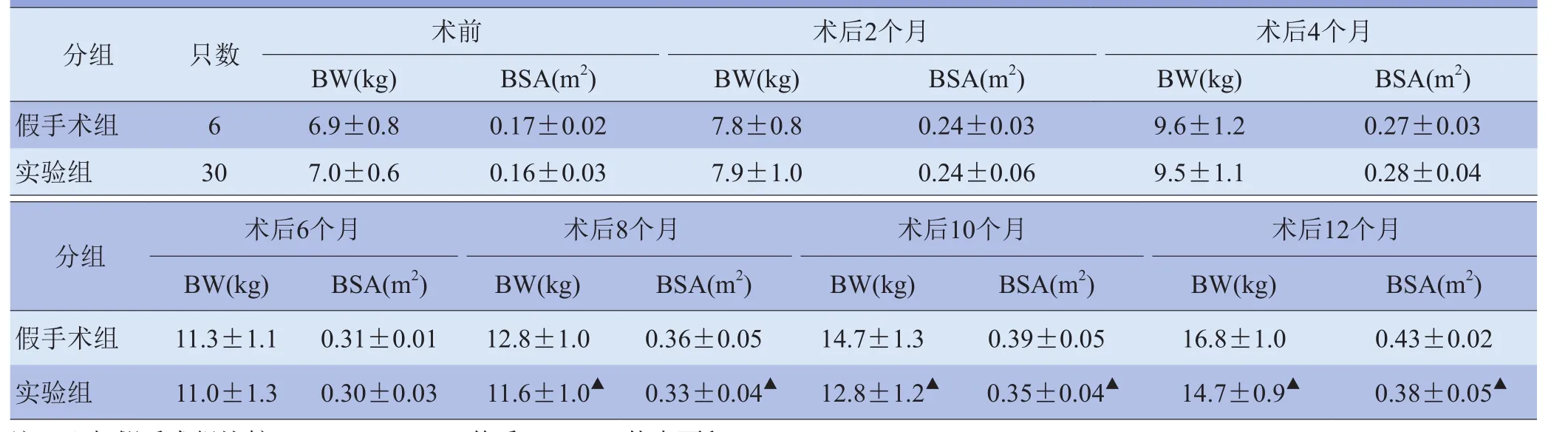
表1 实验组成模猪与假手术组猪观察期间体重及体表面积变化
图1 假手术组术后12个月,收缩期左心室乳头肌水平短轴切面为圆形,LVEIs为1.03
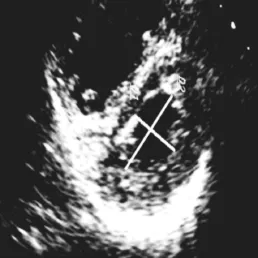
图2 实验组成模猪术后12个月,肺动脉高压(SPAP=56 mmHg),收缩期左心室乳头肌水平短轴切面呈“D”形,LVEIs为1.21

表2 实验组成模猪肺动脉高压演变过程
2.3 偏相关分析结果 分别对RVFAC、LVEIs、LVEId与SPAP、MPAP进行偏相关分析,控制左向右分流量、三尖瓣、肺动脉瓣反流量等前负荷影响因素后,RVFAC与SPAP、MPAP呈负相关(r=-0.76、-0.69,P<0.01);LVEIs与 SPAP、MPAP 呈正相关(r=0.81、0.75,P<0.01);LVEId与SPAP无显著相关性(r=0.26、0.23,P>0.05)。
3 讨论
小型巴马幼猪接近人的心血管解剖结构及循环生理,且大型的动物可获得更清晰的超声图像,故本实验以其为建立动物模型。
右心室形态易受后负荷影响,导致心室腔扩张,收缩功能降低[5]。本实验结果显示15只成模猪术后4个月形成肺动脉高压,随着肺动脉压升高,肺动脉逐渐增宽,右心室壁增厚,右心室逐渐扩大,收缩功能降低,与以往研究结果一致[6]。术后2个月时主肺动脉内径、右心室内径、横径、长径经BSA校正后较术前及假手术组增大,说明前负荷(颈动-静脉分流量、三尖瓣、肺动脉瓣反流量)增加也可以导致右心室形态发生改变。假手术组主肺动脉内径、右心室内径、横径、长径经BSA校正后无显著差异,提示肺动脉内径、右心室常规测量指标可间接反映肺动脉压变化,但需校正前负荷及BSA等影响因素。RVFAC作为研究指标之一,形成肺动脉高压后,反映右心室整体收缩功能的RVEF降低,RVFAC随SPAP、MPAP升高而逐渐减小,与以往研究结果相似[7]。偏相关分析显示,在控制前负荷的影响后,RVFAC与SPAP、MPAP仍呈显著负相关,提示RVFAC是反映肺动脉压变化的有效指标。

表3 实验组成模猪与假手术组猪术前及术后1年心室形态及功能指标比较
左、右心室间存在复杂的相互关系,功能上相互匹配、依赖,解剖上被室间隔分开,右心室压和容量变化可使左心室形态发生改变,正常猪左心室短轴切面为圆形,D1与D2几乎完全相等,LVEI接近于1。长期右心室容量或压力负荷增加使室间隔向左心室偏移,左心室心腔变狭长,其短轴切面失去正常圆形状态而呈“D”形,导致LVEI增大[8]。本研究结果显示,实验组成模猪在形成肺动脉高压后,随着肺动脉压升高,LVEIs增大,不同观察点间差异显著;而LVEId于术后2个月开始增大,且在建模术后10个月与12个月间无明显差异,可能与左向右分流及含有相同的中至重度三尖瓣、肺动脉瓣反流例数有关,引起右心室容量负荷增加,使舒张末期室间隔的位置向左心室偏移导致左心室形态发生改变有关。LVEIs是压力依赖性的,与容量负荷无关,而LVEId主要与容量负荷有关。本研究中偏相关分析结果显示,在控制引起前负荷增加的影响因素后LVEIs与SPAP、MPAP仍显著相关,而LVEId与SPAP、MPAP则无明显相关。
虽然RVFAC的正常值变异较大且不能直接给出肺动脉压的数据,但它和LVEIs的规律变化与肺动脉压增加相关。本研究发现,有2只成模猪始终无TR及PR,无法通过TR、PR压差估测肺动脉压,而其RVFAC、LVEIs指标已明显发生改变,提示可通过RVFAC、LVEIs间接反映肺动脉压变化。
本研究拟以右心导管测压及心肺组织病理学检查对实验结果进行验证,目前实验仍在进行中,拟于术后1年半对实验组成模猪及假手术组猪经右心导管测出右心室及肺动脉收缩压、肺动脉平均压后,取心、肺标本行心、肺组织病理学检查。
总之,超声心动图RVFAC、LVEIs指标可无创、便捷、较准确地追踪评估颈动-静脉分流法猪慢性肺动脉高压模型的肺动脉压变化,为临床肺动脉高压的超声评价提供实验依据。
[1]李波, 何巍. 肺动脉高压动物模型的理论研究及其制备特点.中国组织工程研究与临床康复, 2010, 14(11): 2039-2042.
[2]刘成珪, 王永生, 孟刘坤, 等. 分流型兔肺动脉高压模型的建立及改进. 华中科技大学学报(医学版), 2011, 40(6):724-726.
[3]曾春来, 李开军, 林莉, 等. 实验性慢性肺动脉高压右心功能的超声心动图评估. 中国超声医学杂志, 2010, 26(9):773-776.
[4]吕锦蓉, 杨莉.超声心动图在肺动脉高压的应用价值. 广州:中山大学硕士学位论文, 2008: 2-39.
[5]高云华, 唐红. 实用超声心动图学. 北京: 人民军医出版社,2011: 301-303.
[6]陈洪茂, 段云友, 李娟, 等. 超声引导下兔急性肺动脉高压模型及建立及其意义. 中国超声医学杂志, 2007, 23(1): 12-14.
[7]Mauritz GJ, Kind T, Marcus JT, et al. Progressive changes in right ventricular geometric shortening and long-term survival in pulmonary arterial hypertension. Chest, 2012, 141(4): 935-943.
[8]李召琴, 吴雅峰, 刘晓伟, 等. 超声心动图对慢性肺血栓栓塞症患者左室偏心指数的相关分析. 中国超声医学杂志,2011, 27(7): 628-631.
